Фрисопеп АС – относительно новая смесь, разработанная в 2005 году на основе глубокого гидролизата казеина. Профиль распределения пептидов в смеси Фрисопеп АС с высоким содержанием свободных аминокислот обеспечивает ее неаллергенные свойства и предполагает возможность использования ее в терапии тяжелых форм непереносимости коровьего молока. Наряду с доказанной клинической эффективностью глубокие гидролизаты имеют и ряд недостатков: плохие органолептические свойства (горький вкус, специфический запах) и высокую стоимость. Кроме того, известно, что мелкие пептиды (в составе высоких гидролизатов) не вызывают иммунного ответа, тогда как для формирования пищевой толерантности у ребенка необходим контакт иммунной системы с антигенами. Но этими свойствами обладают пептиды средних размеров (от 2 до 10 кДа), составляющие белковый компонент умеренногидролизованных профилактических смесей [8, 10]. Так, в составе смесей Фрисолак 1 ГА и Фрисолак 2 ГА преобладают олигопептиды с молекулярной массой 0,5–3,5 кДа.
Современные диетологические подходы заключаются в более широком применении профилактических (частичных) смесей-гидролизатов и в более обоснованном, с учетом строгих клинических показаний, назначении лечебных (глубоких) смесей-гидролизатов [6]. При создании ГА-смесей используется управляемый гидролиз для получения такого пептидного профиля, который снижает сенсибилизирующую активность продукта и при этом способствует формированию пищевой толерантности [10, 11]. Целью настоящего исследования была оценка эффективности в диетотерапии детей с атопическим дерматитом специализированных лечебных смесей. Исследование является результатом клинического наблюдения и лечения 66 детей с атопическим дерматитом первого года жизни. У 20 детей оценивалась эффективность диетотерапии с применением смеси на основе высокогидролизованного сывороточного белка Фрисопеп, у 46 – смеси на основе высокогидролизованного казеина Фрисопеп АС.
Результаты применения смеси Фрисопеп
Лечебную смесь на основе высокогидролизованного сывороточного белка получали 20 детей в возрасте 4–6 месяцев, с различной степенью тяжести атопического дерматита. Показатели физического развития всех детей соответствовали норме. В данной группе не отмечалось выраженных симптомов перинатального поражения ЦНС или соматической патологии. У 16 детей в ходе аллергологического обследования были выявлены повышенные уровни специфического IgE к белкам коровьего молока (БКМ) и его фракциям (1–3-й класс реакции). У 4 детей с нормальным уровнем IgE показанием к назначению безмолочной диеты с использованием высокогидролизованной лечебной смеси являлось наличие в анамнезе явных клинических реакций на продукты, содержащие БКМ. У 9 детей из этой группы выявлена поливалентная пищевая сенсибилизация к продуктам прикорма. Дети находились на искусственном вскармливании только апробируемой смесью или получали ее в сочетании с гипоаллергенными продуктами и блюдами прикорма в соответствии с возрастом ребенка и характером пищевой сенсибилизации.
В зависимости от степени тяжести проявлений атопического дерматита наблюдаемые дети были распределены на три группы: группу А1 составили 3 (15%) ребенка с легкими проявлениями атопического дерматита на момент осмотра (SCORAD < 20), в группу А2 были включены 13 (65%) детей со среднетяжелым течением атопического дерматита и умеренными проявлениями дерматита на момент осмотра (SCORAD > 20 – < 60) и группу А3 составили 4 (20%) ребенка с тяжелым течением атопического дерматита и выраженными кожными проявлениями (SCORAD > 60) (рис. 1). У 3 детей был диагностирован атопический дерматит легкого течения, ограниченной локализации, с оценкой кожных покровов по индексу SCORAD в среднем 17 баллов, 13 детей наблюдались с диагнозом «атопический дерматит, среднетяжелое течение». Оценка выраженности кожных изменений у детей этой группы по индексу SCORAD составила в среднем 44 балла.
У 4 детей с тяжелым течением атопического дерматита имелось выраженное поражение кожи – SCORAD у них в среднем составил 73,1 балла. У этих же детей отмечались более высокие уровни IgE к БКМ, соответствующие 2–3-му уровню сенсибилизации. У 6 детей была диагностирована ферментопатия – лактазная недостаточность. До перевода на смесь Фрисопеп все дети вскармливались современными адаптированными молочными смесями. Дети с тяжелыми и среднетяжелыми проявлениями атопического дерматита получали медикаментозную терапию – антигистаминные препараты (Супрастин), мембраностабилизаторы (Задитен), энтеросорбенты, местную противовоспалительную терапию с использованием глюкокортикостероидов. В период вскармливания гипоаллергенной смесью Фрисопеп медикаментозная и местная противовоспалительная терапия детям не отменялась. В группе детей с легкими проявлениями атопического дерматита использовалась только диетотерапия.
Переносимость смеси Фрисопеп
Переносимость смеси Фрисопеп была удовлетворительной. Период адаптации к смеси у всех наблюдаемых детей протекал нормально. Снижение аппетита, связанное с адаптацией к вкусовым особенностям продукта, было кратковременным (5–7 дней). В дальнейшем дети хорошо ели смесь, спокойно выдерживали промежутки между кормлениями. Динамика росто-весовых показателей была в пределах возрастной нормы, не отличалась у детей с легкими и выраженными изменениями со стороны кожи и составила в среднем для массы тела 22,0 ± 5,5 г/сут, для длины тела 2,2 ± 0,4 см/мес. (табл. 1). Анализ фактического питания на фоне диетотерапии показал, что использование смеси Фрисопеп обеспечивало возрастную потребность детей в основных пищевых веществах и энергии (табл. 2).
Клиническая эффективность смеси Фрисопеп
Из 4 детей с тяжелым течением атопического дерматита (группа А3) у троих отмечалась положительная динамика кожных симптомов: индекс SCORAD 50,7 ± 10,3 на фоне диеты против 73,1 ± 11,0 до начала приема смеси. Однако положительный эффект был неустойчивым, полной и длительной ремиссии заболевания добиться не удалось. Клинический эффект от применения смеси Фрисопеп у 1 ребенка отсутствовал, что послужило поводом для назначения смеси на основе высокого гидролизата казеина – Нутрамиген. Таким образом, вскармливание смесью Фрисопеп удовлетворяет физиологические потребности детей в основных пищевых веществах и энергии и обеспечивает адекватный рост и развитие ребенка. Смесь обладает хорошей терапевтической эффективностью у детей с легкими проявлениями атопического дерматита в качестве монотерапии. У детей со среднетяжелым течением атопического дерматита применение смеси Фрисопеп эффективно в комплексе с медикаментозной терапией. При тяжелой форме атопического дерматита у детей с выраженной сенсибилизацией к белку коровьего молока смесь Фрисопеп недостаточно эффективна.
Результаты применения смеси Фрисопеп АС
Физическое развитие всех детей (масса и длина тела) в момент начала исследования находилось в пределах 25–75 процентили для каждого возраста, что соответствует средним показателям. У 5 детей (10,8%) отмечался дефицит массы тела по отношению к росту 10–12%, что соответствовало гипотрофии I степени. Показатели гемоглобина крови у 12 (26%) детей были в пределах 90–110 г/л, что свидетельствовало о наличии железодефицитной анемии (ЖДА) I степени. У 25 (54,3%) детей атопический дерматит протекал на фоне умеренно выраженных симптомов перинатального поражения центральной нервной системы (восстановительный период). У 12 (26%) детей отмечалась частичная лактазная недостаточность, подтвержденная исследованиями экскреции углеводов с калом. Характер основного заболевания, сопутствующая патология и возраст наблюдаемых детей представлены в таблице 4. УЗИ органов брюшной полости выявило следующие нарушения: реактивные изменения поджелудочной железы у 37 детей (80,4%), дискинезия желчных путей у 10 (21,7%) детей. Изменения копрограммы (непереваренные волокна, нейтральный жир в значительных количествах и др.) были обнаружены в 19 случаях (41,3%). Иммунологическое исследование сыворотки крови обнаружило повышение общего IgE в 5–50 раз у 34 (73,9%) детей, при этом у всех детей отмечалось повышение степени чувствительности к белкам коровьего молока от средней до высокой (1–3-й класс реакции), у 30 (65,1%) – к белкам козьего молока (2–3-й класс реакции) и у 7 (15,2%) – к белкам сои (2-й и 3-й класс реакции).
Характер питания детей в начале исследования был различным. Большинство детей – 39 из 46 (84,7%) – находились на искусственном вскармливании и до включения в исследование получили от 2 до 5 различных адаптированных смесей. Отсутствие улучшения состояния кожи в течение 1–2 недель после перевода на новую смесь требовало ее замены. Из-за частой смены питания резко сокращался и период перевода на новую смесь, составляя 2–3 дня. К моменту обследования 7 детей (15,2%) получали смешанное вскармливание, в качестве докорма – молочную смесь. Семь детей (15,2%) получали смесь на основе глубокого гидролизата сывороточных молочных белков и 22 ребенка (47,8%) – смесь на основе умеренногидролизованного белка без положительного эффекта. Три ребенка (6,5%) вскармливались адаптированными молочными смесями на основе козьего молока (Нэнни), и 1 ребенок (2,1%) получал соевую смесь. Среди детей старше 6 месяцев большинство получали овощной и злаковый прикорм, фруктовые пюре, а также продукты прикорма, содержащие БКМ. У четырех детей в возрастной группе 6–12 месяцев неоднократная попытка ввести продукты прикорма вызывала обострение дерматита. В связи с этим к моменту начала наблюдения продуктов прикорма в их рационе не было. При введении смеси Фрисопеп АС соблюдались следующие правила:
- смесь Фрисопеп АС полностью заменяла молочную составляющую рациона (или соевую смесь);
- смесь вводилась постепенно начиная с 10 мл в первый день в каждое кормление, далее объем смеси увеличивался на 30–60 мл ежедневно в каждое кормление до достижения необходимого объема; полный перевод на смесь Фрисопеп АС происходил в течение 5–7 дней;
- смесь Фрисопеп АС давали только в отдельной бутылочке и не смешивали с другой смесью;
- изменение цвета стула на зеленовато-серый при вскармливании апробируемой смесью расценивалось как типичная реакция на введение продукта-гидролизата и не являлось причиной для ее отмены.
Антигистаминные препараты (Зиртек, Фенистил, Супрастин) назначались в периоде обострения атопического дерматита. Дополнительная медикаментозная терапия назначалась детям с изменениями характера стула, копрограммы, данных УЗ-исследования, иммунологических показателей крови. Применялись сорбенты (Энтеросгель, Лактофильтрум), ферментотерапия (Креон, Мезим-форте), пребиотики (Хилак форте), пробиотики (Линекс, Примадофилус), наружное лечение (Фукорцин, Бепантен, Элидел и др.).
Переносимость смеси Фрисопеп АС
Благодаря постепенному введению переход на смесь Фрисопеп АС с других ранее используемых смесей большинство детей перенесли удовлетворительно, отказов от приема пищи, срыгиваний и рвоты не было, диспепсические явления отсутствовали. Среди детей с гастроинтестинальными нарушениями, имевшими место к началу исследования, нормализация стула и исчезновение диспептических явлений отмечались через 6–8 дней после перевода на смесь Фрисопеп АС. Исчезновение всех гастроинтестинальных симптомов наблюдалось через 1–1,5 месяца от начала применения казеинового гидролизата Фрисопеп АС. Нормализация функции желудочно-кишечного тракта позволила отменить у всех пациентов ферментные препараты. Положительная динамика имела место также в физическом развитии, среднемесячная прибавка массы тела у всех наблюдаемых детей находилась в пределах нормы (табл. 5). К концу исследования показатели веса и роста у всех детей соответствовали средним возрастным нормам. Данные копрологических исследований, проводимые в динамике (через 3 месяца), свидетельствовали о хорошем усвоении продукта, что проявлялось отсутствием изменений в копрограммах. У детей с нормальным стулом смена смеси не оказала на него существенного влияния. У детей с неустойчивым характером стула и с частичной лактазной недостаточностью стул нормализовался на 5–7-й день введения смеси Фрисопеп АС. При повторном исследовании ни у одного ребенка не отмечалась экскреция лактозы с калом. По данным УЗИ органов брюшной полости у большинства детей (68%), имевших признаки реактивного панкреатита, размеры поджелудочной железы уменьшились. Через три месяца на фоне питания Фрисопеп АС и введения продуктов прикорма у детей с ЖДА I степени уровень гемоглобина в крови повысился до 110 г/л и выше.
Клиническая эффективность смеси Фрисопеп АС
Один ребенок был исключен из исследования, так как на фоне приема смеси Фрисопеп АС у него отмечалось обострение атопического дерматита. Результаты проводимого параллельно аллергологического обследования выявили высокие уровни IgE-антител к БКМ и казеиновой фракции. У остальных 45 детей (97,9%) отмечалось улучшение состояния кожных покровов. Клиническое улучшение состояния кожи начиналось на 1–2-й неделе от начала применения смеси Фрисопеп АС. Эритема, отек, экссудация являются маркерами аллергического воспаления кожи. Сухость кожи – характерная особенность атопического дерматита, свидетельствующая о недостаточности гидролипидной пленки кожи. На фоне проводимой терапии быстрее подвергались обратному развитию такие патологические признаки, как корки, мокнутие (экссудация) и экскориации. Через 3–4 недели от начала лечения они полностью исчезали. Отек и инфильтрация кожи существенно уменьшались к 3-й неделе наблюдения. Угасание папулезных высыпаний было более медленным, как и угасание эритемы. Состояние сухости кожи зависело не только от питания, но в значительной степени от проводившегося ухода за кожей, включавшего в себя средства увлажнения и релипидирования.
По мере нормализации состояния кожи с уменьшением зуда и нормализацией сна потребность в применении антигистаминных препаратов исчезла. У 13 пациентов с высоким риском формирования респираторной аллергии, в том числе бронхиальной астмы, был продолжен прием цетиризина с профилактической целью. Применение адекватного питания с включением казеинового гидролизата Фрисопеп АС позволило существенно уменьшить объем наружной терапии. Применения топических кортикостероидов не потребовалось ни у одного пациента после первого месяца диетотерапии. Объем использования крема Элидел существенно сократился через 1,5 месяца от начала применения смеси Фрисопеп АС. Отмена топической терапии не сопровождалась обострением атопического дерматита ни у одного пациента. Уровень общего IgE на фоне приема смеси Фрисопеп АС не повышался, у 17 (68%) детей отмечалось снижение чувствительности к белкам коровьего и козьего молока до 0–2-го класса реакции, у 3 (12%) детей – к белкам сои до 1–2-го класса реакции. На фоне диетотерапии с использованием смеси Фрисопеп АС всем детям последовательно были введены безмолочные продукты прикорма (каши, овощное, мясное и фруктовое пюре). Соки вводились только при достижении клинической ремиссии и отсутствии признаков функциональных нарушений со стороны органов пищеварения.
Таким образом, результаты исследования эффективности смеси на основе высокогидролизованного казеина Фрисопеп АС производства компании «ФризлендКампина» (Голландия) свидетельствуют о том, что продукт соответствует требованиям СанПиН МЗ России (М., 2002) (2.3.2 1078-01, п. 3.3.5), хорошо переносится детьми с атопическим дерматитом различной степени тяжести на фоне пищевой аллергии и сопутствующих заболеваний алиментарного характера. Высокая эффективность диетотерапии с использованием указанного продукта подтверждается стойкой положительной динамикой со стороны кожных и гастроинтестинальных проявлений аллергии, физического развития, иммунологических показателей крови, копрограммы и других лабораторных данных. Важно, что смесь Фрисопеп АС оказалась эффективной в отношении клинических проявлений атопического дерматита у 23 из 26 детей с тяжелой формой заболевания уже к концу месяца от начала приема. Это были дети, у которых до начала исследования ни одна смесь (из большого числа применявшихся) не была сколько-нибудь эффективной. К концу наблюдения все дети, получавшие смесь Фрисопеп АС, включая детей с тяжелой формой атопического дерматита, находились в состоянии ремиссии. На рисунке 3 представлены сравнительные данные по оценке эффективности исследованных высокогидролизованных смесей – смеси на основе гидролизата сывороточных белков Фрисопеп и смеси на основе гидролизата казеина Фрисопеп АС.
Заключение
Проведенный анализ показал, что как на фоне применения смеси Фрисопеп, так и на фоне применения смеси Фрисопеп АС происходит статистически значимое снижение показателя SCORAD (p < 0,001). При этом значимое снижение происходит как у детей с легкими (группы А1 и Б1, SCORAD < 20), так и с умеренными (группы А2 и Б2, SCORAD > 20 – < 60) и выраженными (группы А3 и Б3, SCORAD > 60) кожными проявлениями пищевой аллергии. У детей с тяжелым течением атопического дерматита и выраженным поражением кожи (SCORAD > 60) на фоне диетотерапии с применением смеси на основе высокогидролизованного казеина Фрисопеп АС (группа Б3) положительная динамика со стороны кожных покровов была достоверно более значимой по сравнению с детьми, получавшими смеси на основе гидролизата сывороточных белков Фрисопеп (группа А3, p < 0,001). У детей с умеренно выраженным кожным поражением (SCORAD > 20 – < 60) применение смеси Фрисопеп АС также было более эффективным (p > 0,01). У детей с легкими кожными проявлениями эффективность смесей Фрисопеп АС и Фрисопеп была одинаковой.
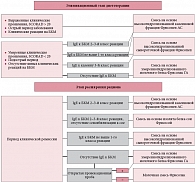
Таким образом, назначение специализированных продуктов питания позволило добиться положительного результата лечения у всех обследованных больных с пищевой аллергией. Однако проведенный сравнительный анализ двух смесей показал, что у детей с тяжелым течением атопического дерматита продуктом выбора является смесь на основе высокогидролизованного казеина Фрисопеп АС, которая оказалась достоверно более эффективна по сравнению со смесью на основе высокогидролизованного сывороточного белка Фрисопеп. На основании проведенных исследований по оценке аллергенных свойств различных специализированных смесей разработан алгоритм поэтапного назначения специализированных смесей у детей с атопическим дерматитом (рис. 4). Согласно представленному алгоритму на элиминационном этапе диетотерапии в остром периоде заболевания, в случаях среднетяжелого и тяжелого течения атопического дерматита, наличия выраженных клинических реакций на продукты, содержащие молочный белок, предпочтение должно отдаваться смесям на основе гидролизата казеина. Эти смеси являются наиболее гипоаллергенными, что также подтвердило проведенное нами исследование с использованием диагностической системы «ИФА-Лакттест» [6]. Исключение могут составлять дети с высоким уровнем сенсибилизации к казеину, поскольку в некоторых случаях переносимость смесей на основе гидролизата казеина у них может быть несколько ниже (в нашем исследовании – 1 ребенок из 43). В случаях легких кожных и гастроинтестинальных проявлений реакций на пищу, подострого течения атопического дерматита, при отсутствии выраженных клинических реакций на молочные продукты, выбор смеси целесообразно проводить в соответствии с результатами аллергологического обследования:
-
при высокой степени гиперчувствительности к молочному белку (уровни IgE соответствуют2-му и 3-му классу реакции) предпочтение следует отдавать смесям на основе высокогидролизованного казеина;
- при умеренной и низкой степени гиперчувствительности к белку коровьего молока и его фракциям (не выше 1-го класса реакции) могут быть использованы смеси на основе высокогидролизованной сывороточной фракции молочного белка;
- при отсутствии антител к белку коровьего молока и явных клинических реакций на молочные продукты проведение строгой безмолочной диеты нецелесообразно, в таких случаях в качестве базового продукта может использоваться смесь на основе умеренногидролизованного молочного белка, такая как Фрисолак ГА.
На этапе расширения рациона при достижении клинической ремиссии заболевания смесь подбирается исходя из динамики иммунологических показателей на фоне проводимой терапии. Те дети, у которых сохранились высокие титры IgE-антител к БКМ, и в дальнейшем нуждаются в сохранении безмолочной диеты. При необходимости длительного соблюдения безмолочной диеты в периоде ремиссии проявлений пищевой аллергии у детей старше 6 месяцев возможно применение смесей на основе изолята соевого белка. В тех случаях, когда на фоне элиминационной диеты произошло снижение уровня специфических IgE-антител к БКМ до нормальных показателей, возможно проведение открытой провокационной пробы и при ее отрицательном результате – введение в питание молочных продуктов. При этом в качестве переходного питания целесообразно использовать смеси на основе умеренногидролизованного белка Фрисолак ГА, применение которой позволяет снизить аллергенную нагрузку в периоде расширения рациона и снижает риск обострения на этом этапе диетотерапии. Проведение поэтапной диетотерапии пищевой аллергии с определением четких критериев назначения смеси в зависимости от особенностей сенсибилизации, клинических проявлений аллергии и фазы заболевания позволяет максимально оптимизировать проводимое лечение.