Поллиноз: выбор антигистаминного препарата
- Аннотация
- Статья
- Ссылки
- English



Введение
Сезонная аллергия, обусловленная пыльцой растений, признана одним из самых распространенных аллергических заболеваний. К сожалению, согласно результатам многочисленных эпидемиологических исследований, частота встречаемости пыльцевой аллергии как среди взрослых, так и среди детей неуклонно возрастает [1, 2]. В настоящее время для содействия активному и здоровому старению подчеркивается важность ранней диагностики и лечения аллергических заболеваний. Необходимо отметить, что возможность оптимально лечить и контролировать хронические респираторные заболевания также расширилась благодаря учебным онлайн-программам для пациентов и мобильным медицинским инструментам [3].
Поллиноз (пыльцевая аллергия, сенная лихорадка) – заболевание, в основе которого лежит аллергическая реакция немедленного типа. Оно характеризуется острым аллергическим воспалением слизистых оболочек дыхательных путей, глаз, кожи. Реже в процесс вовлекаются пищеварительная, сердечно-сосудистая, мочеполовая и нервная системы. Развитие заболевания по времени совпадает с пылением определенных растений, поэтому характеризуется сезонностью и повторяемостью.
Поллиноз относят к генетически детерминированным патологиям. Однако наследуется не само заболевание, а предрасположенность к атопии.
По данным разных исследователей, наследственная предрасположенность выявляется у 60% пациентов. Дебют патологии часто приходится на дошкольный и школьный возраст [4].
Поллиноз не является тяжелым заболеванием, однако способен существенно снизить качество жизни больных. В частности, он нередко становится причиной нарушения сна, снижения учебной и профессиональной деятельности. Кроме того, патология ассоциируется со значительными финансовыми затратами.
Экскурс в историю
Заболевание, напоминающее поллиноз, впервые было описано в трудах классика античной медицины Клавдия Галена. Примерно через 100 лет Ян Баптист ван Гельмонт указал на сезонность возникновения астмы, связанной, возможно, с воздействием пыльцы растений. Только в 1819 г. английский врач Дж. Босток сделал официальное сообщение в Лондонском медико-хирургическом обществе, изложив историю собственной болезни, которую назвал сенной лихорадкой. В 1873 г. английский врач Ч. Блэкли, который также страдал сенной лихорадкой, дал исчерпывающее описание клиники заболевания. Если ранее причиной болезни считали пыль, инсоляцию, запах цветущих растений, то Ч. Блэкли представил убедительные доказательства, что сенная лихорадка обусловлена именно пыльцой растений. На основании результатов его экспериментов были разработаны кожные и провокационные тесты. Впервые в России о сезонной аллергии сообщил в 1889 г. Л. Силич на заседании Общества русских врачей в Санкт-Петербурге. Кроме того, он представил данные о распространенности пыльцевой аллергии и изменении интенсивности симптомов в зависимости от погоды [5].
Эпидемиология
Распространенность поллиноза и спектр причинно-значимых аллергенов зависят от многих факторов: географических, климатических, агрокультуры, аллергенности растений, степени загрязнения окружающей среды и т.д. [6]. Так, в европейских странах встречаемость поллиноза превышает 40% [7], в разных регионах России колеблется от 12,7 до 24,0% [8]. Наиболее часто первые симптомы появляются в возрасте от восьми до 20 лет. Однако заболевание может развиться и у детей раннего возраста, и у лиц старших возрастных групп [9]. Среди горожан заболеваемость в четыре – шесть раз выше, чем среди жителей сельской местности [5].
Этиология
Из нескольких тысяч растений только 50 могут стать причиной поллиноза. Пыльца ветроопыляемых растений должна быть легкой и летучей, небольших размеров (от 20 до 35 мкм), обладать выраженной антигенной активностью. Растения, имеющие яркую окраску и приятный запах, а также опыляемые насекомыми, редко вызывают аллергию. Немаловажное значение также имеет концентрация пыльцы в воздухе – от десяти до 50 зерен в 1 м3 [9].
В Европейской и средней полосе России выделяют три периода поллиноза:
- весенний – с середины апреля до конца мая, связан с пылением деревьев (березы, дуба, орешника, ольхи, клена, ясеня, платана, вяза, тополя);
- летний – с начала июня до конца июля, обусловлен пылением луговых злаковых трав (тимофеевки, овсяницы луговой, ежи сборной, пырея, мятлика лугового, костера, лисохвоста, райграса), культивируемых злаков (ржи, пшеницы, кукурузы);
- летне-осенний – с конца июля до конца сентября, ассоциируется с цветением сорных трав (полыни, лебеды, амброзии, подсолнечника).
Указанные сроки могут сдвигаться на семь – десять дней в зависимости от метеорологических условий.
Степень выраженности симптомов зависит не только от количества зерен пыльцы в воздухе, но и от индивидуальной реактивности пациентов [10]. Пыльца растений имеет сложный антигенный состав и может содержать от пяти до десяти аллергенных компонентов. При этом антигенные белки могут присутствовать как в пыльце, так и в других частях растения (семенах, листьях, стеблях, плодах). Это обусловливает непереносимость пациентами с поллинозом препаратов растительного происхождения и развитие перекрестной пищевой аллергии (табл. 1) [7].
Патогенез
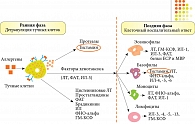
Развитие поллиноза представляет собой классический пример немедленной аллергической реакции, обусловленной иммуноглобулином (Ig) E. Механизм развития аллергического риноконъюнктивита представлен на рис. 1.
Главными участниками аллергического воспаления, обусловленного взаимодействием аллергена со специфическими IgE-антителами, в слизистой оболочке носа, бронхиального дерева, конъюнктивы являются тучные клетки, эозинофилы, лимфоциты, эпителиальные и эндотелиальные клетки. Аллергенспецифические IgE-антитела, образующиеся в избытке при контакте с аллергеном у склонных к атопии лиц, фиксируются на высокоаффинных рецепторах к ним, представленных на тучных клетках. Это приводит к сенсибилизации слизистой оболочки носа и конъюнктивы. Последующий контакт с аллергеном и связывание его с фиксированными на тучных клетках IgE-антителами способствуют активации тучных клеток и секреции медиаторов аллергического воспаления: гистамина, триптазы, простагландина, брадикинина, цистеиниловых лейкотриенов (ЛТ) С4, D4, E4, фактора активации тромбоцитов (ФАТ), фактора некроза опухоли (ФНО) альфа, колониестимулирующего фактора гранулоцитов и макрофагов (ГМ-КСФ). Воздействие медиаторов на эндотелиальные клетки сосудов и нейрорецепторы слизистой оболочки носа, конъюнктивы приводит к развертыванию клинической симптоматики поллиноза: зуду, чиханию, ринорее, заложенности носа, слезотечению, гиперемии конъюнктивы. Через шесть – восемь часов после ранней фазы аллергического ответа развивается поздняя фаза (клеточный воспалительный ответ). Для нее не требуется дополнительного контакта с аллергеном. Высвобождаемые в процессе активации тучных клеток хемотаксические медиаторы (ЛТ, ФАТ, интерлейкин (ИЛ) 5) способствуют аккумуляции в очаге аллергического воспаления эозинофильных лейкоцитов, базофилов, моноцитов, лимфоцитов. Их локальная активация приводит к формированию поздней фазы аллергической реакции, основными признаками которой являются отек и инфильтрация слизистой оболочки, а также повреждение эпителия. Клинически это выражается затруднением носового дыхания, вызванным прежде всего заложенностью, а также назальной и окулярной гиперреактивностью.
Гистамин активно участвует в формировании как ранней, так и поздней фазы аллергической реакции, обусловливая подавляющее большинство клинических проявлений поллиноза. Будучи важнейшим медиатором аллергической реакции немедленного типа, он обладает широким спектром биологических эффектов. Его действие реализуется за счет активации клеточных поверхностных специфических Н1-, Н2-, Н3-, Н4-рецепторов. Так, в результате активации Н1-рецепторов повышается проницаемость сосудов, отмечаются отек, гиперсекреция, спазм гладкой мускулатуры. Именно эти эффекты гистамина блокируются антигистаминными препаратами [11].
Клинические проявления
Для поллиноза характерно острое и рецидивирующее течение. Как отмечалось ранее, тяжесть сезонного обострения зависит от концентрации пыльцы в воздухе, длительности пыльцевого сезона и индивидуальной чувствительности пациентов.
Среди особенностей поллиноза выделяют:
- связь с периодом цветения растений;
- связь с пребыванием в определенной местности;
- сочетание с аллергией на препараты растительного происхождения;
- сочетание с перекрестной пищевой аллергией;
- зависимость течения от погоды (обострение симптомов в сухую, солнечную, ветреную погоду и облегчение в сырую, дождливую погоду, что обусловлено снижением концентрации пыльцы в воздухе);
- в период обострения развитие синдрома синергичной аллергии (клинические проявления возникают на аллергены, на которые пациенты реагируют вне сезона пыления);
- в период палинации обострение хронических заболеваний (ишемической болезни сердца, язвенной болезни и др.);
- асептичность (если не присоединится вторичная инфекция);
- приступообразность (наиболее выраженные проявления в утренние и дневные часы, когда в воздухе находится максимальное количество пыльцы).
К наиболее частым проявлениям поллиноза относят аллергический ринит (АР) – 95–98% случаев, аллергический конъюнктивит (АК) – 91–95%, бронхиальную астму (БА) – 30–40% больных [5]. В ряде исследований было доказано, что симптомы со стороны органов зрения повышают роль ринита как провоцирующего фактора развития бронхиальной астмы и влияют на дневную активность у детей [12].
Типичным проявлением поллиноза является риноконъюнктивальный синдром: зуд и покраснение глаз, ощущение инородного тела в глазах, светобоязнь, слезотечение, в тяжелых случаях блефароспазм. Одновременно имеют место зуд в носу, носоглотке, ушных проходах, профузный насморк, приступы чихания, затруднение носового дыхания (чаще всего двустороннее, разной степени), гиперемия и мацерация кожи преддверия и крыльев носа, обонятельные расстройства, такие как аносмия или гипоосмия. В аллергическое воспаление могут вовлекаться пазухи носа, носоглотка, слуховые трубы, гортань, обусловливая развитие синусита, евстахиита, фарингита, ларингита [13].
При прогрессирующем течении в среднем через три – пять лет от дебюта поллиноза может развиться БА, для которой также характерна сезонность проявлений. В большинстве случаев БА сочетается с аллергическим риноконъюнктивитом, однако у 4% пациентов встречается как изолированный симптом поллиноза. Изолированная БА отличается тяжелым течением и формированием астматических статусов.
Около 20% пациентов, страдающих поллинозом, в сезон пыления причинно-значимых растений жалуются на головную боль, резкую слабость, повышенную утомляемость, потливость, озноб, гипертермию, нарушение сна (бессонницу или сонливость), раздражительность, плаксивость. Различные сочетания указанных симптомов составляют астенический синдром, обусловленный так называемой пыльцевой интоксикацией. Данные симптомы наблюдаются при тяжелом течении поллиноза и поддаются терапии глюкокортикостероидами (ГКС), антигистаминными препаратами [9, 13].
У некоторых пациентов отмечаются кожные проявления аллергии: контактная крапивница, атопический дерматит и контактный дерматит. Контактная крапивница характеризуется четкой сезонностью, в редких случаях может быть единственным клиническим проявлением поллиноза. Контактный аллергический дерматит – редкое проявление поллиноза. Он может возникать на открытых участках кожи при контакте с листьями или стеблем растений. Проявляется в виде гиперемии с последующими везикулезными высыпаниями на пораженных участках.
Клиническими симптомами перекрестной реактивности являются синдром оральной аллергии, гастроинтестинальные симптомы, острая крапивница, ангиоотеки и анафилактический шок. Синдромом оральной аллергии страдают от 40 до 70% больных поллинозом. Пациенты жалуются на зуд, покалывание и отек губ, языка, неба, глотки, ощущение комка в горле при употреблении продуктов, содержащих перекрестно-реагирующие аллергены (табл. 1). Гастроинтестинальные симптомы встречаются реже. К таковым относятся тошнота, боль в животе, кишечная колика, рвота и диарея. Указанные реакции возможны и вне периода палинации. В ряде случаев они могут угрожать жизни пациентов. Это необходимо учитывать при ведении данной группы больных.
Изменения со стороны сердечно-сосудистой и нервной систем носят функциональный характер и не регистрируются вне периода цветения. К нарушениям сердечно-сосудистой системы, обусловленным пыльцевой аллергией, относятся тахикардия, приглушенные тоны сердца, систолический шум на верхушке, повышение артериального давления. Описаны также случаи пыльцевого аллергического миокардита.
Поражение урогенитального тракта (вульвовагинит, уретрит, цистит, нефрит) при поллинозе встречается крайне редко [5].
Диагностика
Обследование пациентов с поллинозом включает:
- сбор аллергологического анамнеза (сезонность проявлений, зависимость от погодных условий, пребывания на улице, за городом, смены места жительства или климата в сезон клинических проявлений, непереносимость ряда пищевых продуктов, а также препаратов растительного происхождения, наследственная предрасположенность) [2, 6];
- осмотр для установления типичной клинической картины;
- выполнение передней риноскопии и эндоскопического исследования;
- проведение специфической аллергологической диагностики, включающей постановку кожных проб с аллергенами, определение специфических IgE-антител, выполнение назального провокационного теста со специфическими аллергенами.
Все методы специальной диагностики проводятся врачами аллергологами-иммунологами в специально оборудованных кабинетах. Кожные пробы (прик-тесты, скарификационные и внутрикожные) выполняют в фазе ремиссии аллергического заболевания, после отмены антигистаминных препаратов. Необходимо отметить, что такие пробы служат уникальным инструментом для определения причинно-значимых аллергенов при условии правильного выполнения и оценки результатов. В случае невозможности проведения кожных проб, трудностей интерпретации их результатов, а также неудачи при попытке выявить «виновный» аллерген определяют специфические IgE в сыворотке крови.
Последние годы применяют молекулярную аллергодиагностику. Для ее проведения используют тест-систему ImmunoCAP, которая позволяет дифференцировать истинную аллергию от перекрестной реактивности.
Молекулярная аллергодиагностика признана диагностическим подходом третьей линии после сбора анамнеза (первая линия), выполнения кожных тестов с аллергенами и определения аллергенспецифических IgE (вторая линия). Она применяется, если методы первой и второй линии не позволяют установить точный диагноз.
Молекулярная аллергодиагностика играет важную роль в трех случаях:
- при дифференциации истинной сенсибилизации и перекрестной реактивности у полисенсибилизированных пациентов, что улучшает выявление причинных аллергенов;
- оценке риска развития острых системных реакций, вместо слабых и местных при пищевой аллергии, что уменьшает необоснованное волнение пациента и необходимость проведения провокационных тестов с пищевыми аллергенами;
- выявлении объективных критериев для назначения аллергенспецифической иммунотерапии и прогнозировании эффекта [14].
Результаты кожных и лабораторных тестов необходимо сопоставлять с симптомами заболевания, поскольку наличие сенсибилизации к аллергенам не всегда сопровождается клиническими проявлениями. В случае расхождения данных аллергологического анамнеза и результатов кожных проб проводят провокационные тесты с аллергенами (назальный, ингаляционный, конъюнктивальный) [15].
При диагностике поллиноза также целесообразны:
- выполнение передней риноскопии и/или эндоскопии, позволяющей выявить патологию слизистой оболочки или отклонения в анатомическом строении носа (например, анатомическую патологию перегородки, гипертрофию аденоидов или носовой перегородки, носовые опухоли/травмы/инородные тела, полипы, гранулемы) [16, 17];
- проведение микроскопии мазка из полости носа; помогает подтвердить наличие эозинофилов, уровень которых при АР превышает 10% общего количества клеток;
- измерение назальной пиковой скорости вдоха, риноманометрия, тест «Дыхание с закрытым ртом» [18];
- проведение офтальмоскопии для оценки типичной картины АК – отечности век, гиперемии и отечности конъюнктив, в тяжелых случаях – блефароспазма, отделяемого скудного, чаще бесцветного, прозрачного, без патологических примесей (кровь, гной и др.) [19];
- выполнение рентгенографии придаточных пазух носа. В частности, может определяться пристеночное затемнение пазух носа, при длительном обострении – симметричное гомогенное затемнение верхнечелюстных пазух, реже решетчатого лабиринта и основных пазух;
- оценка сопутствующих заболеваний (астмы, синусита, ларингита, фарингита, хронического среднего отита, снижения слуха, головной боли);
- оценка качества жизни (влияние на учебу и работу, нарушение сна и социальной активности). Изменение качества жизни пациентов с пыльцевой аллергией анализируют с помощью специальных опросников для оценки качества жизни при риноконъюнктивитах (Rhinoconjunctivitis Quality of Life Questionnaire – RQLQ) и аллергенспецифического нарушения работоспособности (Work Productivity and Activity Impairment Allergic Specific – WPAI-AS), Визуальной аналоговой шкалы [20, 21];
- изучение функции внешнего дыхания с помощью бронхолитического теста. У пациентов могут иметь место снижение объемных и скоростных показателей дыхания (объема форсированного выдоха за первую секунду маневра, пиковой скорости выдоха (ПСВ), мгновенных объемных скоростей), обратимость бронхиальной обструкции, что свидетельствует о наличии БА [21].
Тактика ведения пациентов
Согласно концепции персонализированного подхода, план лечения аллергического заболевания следует обсуждать с пациентом. Обязательным условием при выборе тактики остается учет клинической формы и тяжести патологии, а также социальных, поведенческих и психологических аспектов, существенных для пациента.
Цель лечения – полный контроль над симптомами поллиноза. Его основными принципами являются:
- предотвращение или сокращение контакта с аллергенами и триггерами;
- обучение пациента;
- проведение аллергенспецифической иммунотерапии;
- применение фармакотерапии.
Элиминационные мероприятия. Элиминация аллергенов уменьшает выраженность проявлений поллиноза и потребность в медикаментозном лечении. Так, при аллергии на пыльцу растений пациентам в сезон цветения рекомендуется:
- ограничить время пребывания на улице, особенно в сухую ветреную погоду в утренние часы;
- пользоваться очистителями воздуха, улавливающими пыльцу растений в помещении;
- менять климатическую зону;
- носить темные очки для уменьшения попадания пыльцы на слизистую оболочку глаз;
- по возвращении домой менять одежду, принимать душ.
Не рекомендуется:
- часто проветривать помещения на работе и дома, а также открывать окна машины, особенно в ранние утренние часы;
- выезжать за город или на природу;
- применять фитопрепараты, косметические средства растительного происхождения;
- проводить профилактические прививки и плановые оперативные вмешательства [9].
Образовательные программы. Доказано, что обучение пациентов способно изменить течение заболевания за счет улучшения контроля состояния и изменения образа жизни. Пациенты должны быть проинформированы о природе заболевания, причинах и механизмах симптомов, доступных методах лечения. Необходимо также предоставить им информацию о способах элиминации или ограничения контакта с аллергеном.
Аллергенспецифическая иммунотерапия является основным патогенетическим методом лечения аллергического риноконъюнктивита и атопической БА.
Иммунотерапия аллергенами представляет собой лечение возрастающими концентрациями и дозами аллергена, вводимого подкожно или сублингвально. Принципиальными ее преимуществами перед другими методами терапии являются способность видоизменять характер реагирования организма на аллерген, влиять на патогенез заболевания и, следовательно, на все патогенетические звенья аллергической реакции. На фоне такой терапии уменьшаются продолжительность обострений, выраженность симптомов, потребность как в базисных, так и в симптоматических препаратах. Влияя на течение заболевания, аллергенспецифическая иммунотерапия предотвращает переход его легких форм в более тяжелые и трансформацию аллергического ринита в БА, а также расширение спектра аллергенов, к которым формируется повышенная чувствительность. Необходимо отметить, что такое лечение должно проводиться только под наблюдением аллерголога и иммунолога [22].
Фармакотерапия. Для достижения контроля над заболеванием используют:
- системные и топические антигистаминные препараты;
- топические ГКС;
- стабилизаторы тучных клеток (интраназальные и интраокулярные кромоны);
- антилейкотриеновые препараты.
К симптоматическим препаратам относятся:
- топические и системные деконгестанты;
- интраназальные антихолинергические средства;
- системные ГКС.
Так как наиболее частым проявлением поллиноза является АР, считаем более целесообразным остановиться на лечении именно этого заболевания.
В последних международных согласительных документах по аллергическому риниту и его влиянию на астму (Allergic Rhinitis and its Impact on Asthma – ARIA) и детской астме (Practical Allergology – PRACTALL) обоснован ступенчатый подход к достижению контроля над АР [23, 24]. При этом каждая из четырех ступеней предполагает назначение разных вариантов фармакотерапии в зависимости от выраженности симптомов АР (рис. 2) [23].
Ступенчатый подход к лечению заключается в увеличении объема терапии/переходе на ступень вверх (step-up) в отсутствие контроля симптомов АР и снижении объема терапии/переходе на ступень вниз (step-down) в случае достижения, а также поддержания контроля над заболеванием.
Симптоматическая терапия
Как было отмечено ранее, для симптоматического лечения поллиноза применяют три группы препаратов.
Интраназальные деконгестанты. К ним относятся сосудосуживающие симпатомиметики (альфа-адренергические агонисты, например фенилэфрин, оксиметазолин, ксилометазолин). Эти препараты можно использовать в качестве симптоматических средств при АР в случае заложенности носа. Они не оказывают антиаллергического или противовоспалительного действия и не устраняют зуд, чихание и выделения из носа. Важный момент: интраназальные деконгестанты не следует использовать длительными курсами, поскольку у значительного числа пациентов уже через три дня от начала лечения развивается толерантность к препаратам данной группы и/или медикаментозный ринит [25]. Рекомендуемый срок использования интраназальных деконгестантов – не более пяти – десяти дней [26].
Интраназальные антихолинергические препараты. Если ведущим симптомом АР является ринорея, следует рассмотреть возможность назначения ипратропия бромида – препарата антимускаринового ряда. Данный класс лекарственных средств малоэффективен в контроле чихания и заложенности носа [25], но высокоэффективен в контроле ринореи. Ипратропия бромид не вызывает толерантности и при приеме в рекомендованных дозах редко способствует развитию местных нежелательных явлений. В целом побочные эффекты такой терапии минимальны. Препарат обладает аддитивным лечебным действием при одновременном использовании с пероральными антигистаминными препаратами и интраназальными ГКС без увеличения риска развития нежелательных реакций [27].
Пероральные ГКС. Это препараты «отчаяния», то есть крайняя мера. Их следует использовать непродолжительный период времени при невозможности купировать симптомы другими адекватными способами. Короткий прием пероральных ГКС способен разрешить тяжелые, не поддающиеся коррекции симптомы АР.
Роль антигистаминных препаратов
Препаратами номер один для контроля аллергического воспаления признаны антигистаминные средства, или блокаторы Н1-рецепторов [28]. В таблице 2 представлена классификация антигистаминных препаратов.
Антигистаминные препараты первого поколения имеют целый ряд нежелательных побочных эффектов, обусловленных их низкой специфичностью к Н1-рецепторам (сухость слизистых, задержка мочи, тахикардия, повышение аппетита и др.), характеризуются короткой продолжительностью действия (требуется двух-четырехкратное применение), липофильностью и высокой степенью прохождения через гематоэнцефалический барьер (выраженное седативное действие), развитием тахифилаксии (быстрое привыкание и снижение эффекта). Их применение ограничено не только побочными эффектами, но и неблагоприятным, потенцирующим взаимодействием с алкоголем, психотропными и снотворными средствами. Кроме того, антигистаминные препараты первого поколения противопоказаны при сопутствующей БА.
Антигистаминные препараты второго поколения практически лишены седативного эффекта. Последний, как правило, не отличается от действия плацебо. Они не влияют на холинергические и адренергические рецепторы или это влияние незначительно. Данные препараты высокоэффективны в отношении купирования таких симптомов АР, как чихание, зуд, ринорея, и малоэффективны в отношении устранения заложенности носа и восстановления носового дыхания. При пероральном приеме антигистаминные препараты второго поколения также влияют на сопутствующие проявления аллергии: симптомы конъюнктивита, атопического дерматита или крапивницы, облегчают течение астмы.
В экспериментальных исследованиях выявлено, что спектр фармакологической активности антигистаминных препаратов второго поколения не ограничивается лишь связыванием с H1-рецепторами. Они также подавляют высвобождение провоспалительных медиаторов (гистамина, ЛТ), снижают экспрессию адгезионных молекул (ICAM-1 и Р-селектина) и некоторых цитокинов (ИЛ-4, -6, -8, -13, ГМ-КСФ). Полученные данные позволяют предположить наличие у современных антигистаминных препаратов противовоспалительного эффекта, опосредованного даун-регуляцией, то есть снижением экспрессии транскрипционных факторов, таких как ядерный фактор каппа B и активирующий протеин 1, отвечающих за синтез провоспалительных цитокинов и молекул адгезии [29].
Опыт применения антигистаминных препаратов второго поколения при АР (сезонном и круглогодичном) позволил определить основные требования к ним:
- высокая клиническая эффективность в отношении симптомов интермиттирующего и персистирующего АР;
- способность подавлять симптомы со стороны органов зрения;
- эффективность у детей и пожилых лиц;
- отсутствие тахифилаксии при длительном применении;
- отсутствие нежелательных побочных эффектов;
- улучшение качества жизни больных.
В настоящее время на отечественном фармацевтическом рынке представлен широкий спектр антигистаминных препаратов второго поколения. Одним из наиболее изученных является эбастин (Эспа-Бастин®).
Эбастин
Эбастин – селективный, длительно действующий обратный агонист Н1-рецепторов.
В отношении рассматриваемого препарата проведено более 100 сравнительных рандомизированных клинических исследований с общей продолжительностью лечения около 2 млн дней [30].
Эбастин был выведен на фармакологический рынок в 1990 г. На сегодняшний день он зарегистрирован для применения более чем в 80 странах.
Значимый терапевтический эффект эбастина наблюдается уже через час после приема. Антигистаминное действие сохраняется в течение 48 часов. При длительном приеме отмечается высокий уровень блокады периферических H1-рецепторов без развития тахифилаксии.
После пятидневного курса лечения антигистаминная активность сохраняется еще в течение 72 часов за счет действия активного метаболита.
Препарат выпускается в виде таблеток, содержащих 10 и 20 мг эбастина. Режим применения – один раз в день.
Важно подчеркнуть, что гибкость дозирования позволяет уменьшить симптомы заболевания именно тогда, когда это необходимо. Так, при увеличении концентрации пыльцы или нахождении пациента в зоне повышенного содержания аллергенов симптомы аллергии могут усилиться, поэтому дозу антигистаминного препарата можно увеличить с 10 до 20 мг, не опасаясь развития побочных эффектов.
Эбастин показан для лечения АР различной этиологии (сезонный и/или круглогодичный), крапивницы у лиц старше 12 лет.
После перорального приема эбастин подвергается быстрому метаболизму системой цитохрома P450 (CYP) в активный метаболит каребастин. После однократного приема 20 мг препарата максимальная концентрация каребастина в плазме крови отмечается через один – три часа и составляет 157 нг/мл. Связывание с белками плазмы крови эбастина и каребастина достигает более 95%. Период полувыведения каребастина – от 15 до 19 часов, 66% препарата выводится в виде конъюгатов через почки. Прием пищи не оказывает влияния на его клинические эффекты. У пациентов пожилого возраста фармакокинетические показатели существенно не изменяются. Эритромицин и кетоконазол повышают концентрацию эбастина в сыворотке крови, поэтому не следует назначать эти препараты одновременно. Клинически значимого взаимодействия с теофиллином, непрямыми антикоагулянтами, циметидином, диазепамом, этанолом и этанолсодержащими препаратами не выявлено. В терапевтических дозах эбастин не влияет на способность к вождению транспортных средств и механизмов [31].
Помимо способности связываться с Н1-рецепторами было изучено влияние эбастина на другие медиаторы воспаления. Установлено, что эбастин ингибирует анти-IgE-обусловленное высвобождение простагландинов и лейкотриенов клетками назальных полипов, а также цитокинов ГМ-КСФ, ФНО и ИЛ-8. Эбастин редуцирует высвобождение ГМ-КСФ в назальном секрете, уменьшает назальную эозинофилию, количество эозинофилов в крови и уровень эозинофильного катионного протеина (ЕСР) в плазме [32].
Клиническая эффективность. Согласно результатам клинических исследований, эбастин характеризуется высокой эффективностью при аллергическом риноконъюнктивите.
Терапевтический эффект эбастина при сезонном аллергическом рините оценивали в восьми исследованиях. Препарат оказался более эффективным, чем плацебо, в уменьшении симптомов сезонного AР [33–40].
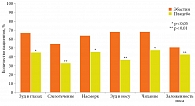
Проведено двойное слепое сравнительное исследование эффективности эбастина и плацебо у пациентов с круглогодичным аллергическим риноконъюнктивитом. Число участников – 151. Активная субстанция − эбастин 10 мг. Показано, что эбастин наряду с улучшением назальных симптомов снижает выраженность проявлений конъюнктивита (р < 0,01) (рис. 3) [41].
Для сравнения эффективности эбастина 10 мг, эбастина 20 мг и цетиризина 10 мг проведено двойное слепое исследование. Общее число пациентов с сезонным АР – 343. По эффективности эбастин в дозах 10 и 20 мг был сопоставим с цетиризином в дозе 10 мг, однако максимальный клинический эффект достигался быстрее при использовании 20 мг эбастина (р = 0,027) [37].
Возможность двукратного увеличения дозы является одним из преимуществ эбастина перед другими антигистаминными препаратами второго поколения. Это подтверждают результаты метаанализа результатов четырех исследований, включавших 2089 больных, 749 из которых получали эбастин 20 мг, 739 – лоратадин 10 мг, 601 – плацебо [42]. Так, эбастин в дозе 20 мг превосходил лоратадин по терапевтической эффективности при АР.
Известно, что антигистаминные препараты недостаточно эффективны в отношении такого клинического симптома АР, как заложенность носа. Поскольку эбастин обладает противовоспалительным свойством, предположили, что он способен влиять и на этот симптом. Анализ результатов трех исследований продемонстрировал, что применение эбастина в дозе 20 мг у больных сезонным АР способствовало уменьшению не только ринореи, зуда и чихания, но и заложенности носа, что превосходило эффект эбастина 10 мг. При этом действие лоратадина в дозе 10 мг практически не отличалось от действия плацебо [43].
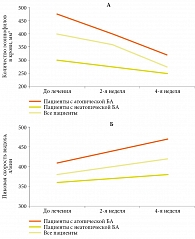
Влияние эбастина на воспаление в нижних дыхательных путях изучено в открытом исследовании с участием 20 больных астмой (11 с атопической БА и девять с неатопической БА), получавших 10 мг эбастина в течение четырех недель [44]. У всех пациентов до начала и после окончания исследования определяли уровень сывороточного ЕСР, эозинофилы крови, а также функциональные параметры – пиковую скорость выдоха и степень бронхиальной гиперреактивности. На фоне лечения эбастином у пациентов с атопической БА значимо снизился уровень ЕСР (с 25,0 ± 3,0 до 16,3 ± 2,4 мг/л, р < 0,0014) и эозинофилов (с 468,2 ± 44,4 до 417,3 ± 47,8 мм3, р < 0,0253) (рис. 4А), а также значительно повысилась пиковая скорость выдоха (с 410,9 ± 16,1 до 440,0 ± 19,1 л/мин, р < 0,0189) (рис. 4Б). У больных неатопической БА эти изменения были незначительны. Влияния терапии на степень бронхиальной гиперреактивности не наблюдалось.
Переносимость и безопасность. Эбастин обладает высокой степенью безопасности. Препарат не оказывает выраженного антихолинергического и седативного эффекта, не проникает через гематоэнцефалический барьер. Не отмечено влияния препарата в дозе 100 мг (превышает рекомендованную суточную дозу в пять раз) на интервал QT при проведении электрокардиографии. Эбастин не влияет на способность управлять транспортным средством. Его можно применять при использовании этанола и этанолсодержащих препаратов. Прием пищи не снижает клинический эффект эбастина [31].
Частота нежелательных явлений во время лечения эбастином в дозах 5, 10 и 20 мг не превосходила таковую на фоне приема плацебо или других антигистаминных препаратов второго поколения. Наиболее часто отмечались головная боль, сонливость и сухость во рту.
Анализ объединенных данных пяти многоцентровых плацебоконтролируемых исследований не выявил каких-либо статистически значимых различий в максимальном интервале QT у пациентов, принимавших эбастин (0,405 с для эбастина 10 мг, 0,411 с – 20 мг) и плацебо (0,411 с) [45]. Из 1076 взрослых пациентов с сезонным АР, которым проводили электрокардиографию, интервал QT не превышал 0,5 с и не отклонялся от базовых значений более чем на 15%. 24-часовое холтеровское мониторирование в подгруппе из 226 больных также не выявило каких-либо серьезных изменений.
Кроме того, у добровольцев не обнаружено значимых изменений интервала QT при приеме эбастина 60 мг/сут в течение недели, а также 100 мг однократно [46].
Заключение
Своевременная диагностика и адекватное лечение поллиноза с использованием современных препаратов позволяют добиться быстрого купирования симптомов, улучшить качество жизни пациентов, значительно уменьшить риск развития осложнений.
Поскольку гистамин играет значительную роль в патогенезе аллергического риноконъюнктивита и бронхиальной астмы, применение антигистаминных препаратов второго поколения считается стратегией первого выбора при поллинозе. Одним из представителей данного класса препаратов является эбастин (Эспа-Бастин®). Он селективно блокирует Н1-рецепторы, что обусловливает высокую клиническую эффективность и безопасность при аллергическом (сезонном и круглогодичном) риноконъюнктивите. При недостаточном эффекте 10 мг препарата терапевтическую дозу можно увеличить до 20 мг. Это не повлияет на безопасность лечения.
Ye.P. Terekhova, PhD, N.M. Nenasheva, DM, PhD, Prof., G.L. Osipova, DM, PhD, D.V. Terekhov, PhD
Russian Medical Academy of Continuing Professional Education
Research Institute of Pulmonology of FMBA of Russia
Contact person: Yekaterina P. Terekhova, e.p._terekhova57@mail.ru
The article discusses the prevalence of pollinosis, immunological mechanisms, clinical manifestations, modern methods of diagnosis and therapy. The advantages of histamine inverse agonists in the treatment of seasonal allergies are described in detail. Ebastin is one of the main representatives of this class of drugs. Based on a number of studies, it has been shown that Ebastine is characterized by high efficacy in relieving the symptoms of seasonal allergic rhinoconjunctivitis, is well tolerated and improves the quality of life of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.