Первая линия терапии аллергических заболеваний: как выбрать правильный препарат
- Аннотация
- Статья
- Ссылки
- English
Во всем мире, особенно в развитых странах, аллергические заболевания занимают одно из ведущих мест по распространенности. Ими страдают преимущественно дети, подростки и трудоспособные взрослые. Известно несколько состояний заболеваний: аллергический ринит (АР), бронхиальная астма (БА), прежде всего аллергическая форма, атопический дерматит, контактная, пищевая и лекарственная аллергия. Крапивница также может возникать как результат аллергического ответа. Глобальная распространенность аллергических заболеваний достигает 30% [1]. Различные возраст-зависимые и орган-специфические клинические проявления аллергических заболеваний, которые зачастую возникают одновременно у одного и того же индивидуума, способствуют растущему глобальному бремени аллергии. За последние несколько десятилетий распространенность аллергических заболеваний увеличилась повсеместно в два-три раза. Возросла распространенность АР и БА среди молодых мужчин в Финляндии [2]. Результаты немецкого исследования демонстрируют распространенность сезонного АР у 14,8% взрослых и 10,7% детей, БА – у 8,6 и 4,7% соответственно [3, 4]. Аналогичные изменения в распространенности аллергических заболеваний отмечаются и в азиатской популяции, в частности среди детей и подростков Республики Корея [5]. В России также наблюдается тенденция к росту распространенности аллергических заболеваний [6, 7]. Согласно опубликованным в 2014 г. результатам исследования распространенности хронических заболеваний дыхательных путей в 12 регионах России, до 19% взрослого населения РФ имеют назальные симптомы – ринорею, чихание, заложенность носа. Причем у половины из них отмечаются и глазные симптомы, что позволяет предположить наличие у этих респондентов АР [8]. Данные эпидемиологических исследований свидетельствуют о наличии симптомов АР у 12–24% населения нашей страны в зависимости от региона [9].
Как известно, к наиболее распространенным аллергическим заболеваниям относится АР. В мире им страдает свыше 500 млн человек, в Европе – до 30% популяции [10]. При этом истинное количество пациентов с аллергией может недооцениваться, поскольку многие из них не обращаются за медицинской помощью. Кроме того, иногда вместо АР диагностируют, например, вазомоторный ринит. Предполагается, что почти в 45% случаев правильный диагноз аллергического заболевания остается неустановленным [11].
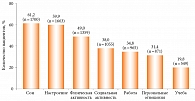
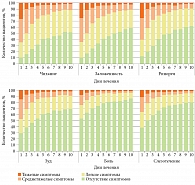
Симптомы ринита оказывают выраженное негативное влияние на связанное со здоровьем качество жизни пациентов. Такие симптомы нарушают не только повседневную активность пациентов, но и качество сна. Как следствие – усталость в течение дня, снижение работоспособности и способности к обучению (рис. 1) [10, 12, 13].
АР является классическим IgE-обусловленным аллергическим заболеванием первого типа, развивающимся в результате воздействия аллергенов на слизистую оболочку носа. Когда специфические IgE-антитела, связанные с высокоаффинными рецепторами тучных клеток или базофилов, связывают аллерген, тучная клетка активируется и высвобождает активные медиаторы, такие как гистамин, цистеиниловые лейкотриены, тромбоцит-активирующий фактор. Именно эти медиаторы вызывают развитие аллергической реакции немедленного типа. К симптомам носовой триады относятся пароксизмальное и повторяющееся чихание, ринорея и заложенность носа. Кроме того, у большинства пациентов, особенно с сезонным АР, развиваются симптомы аллергического конъюнктивита.
Аллергический ринит подразделяют на интермиттирующий и персистирующий в зависимости от продолжительности симптомов и сезонный и круглогодичный – в зависимости от этиологического аллергена(ов) [10].
Лечение АР включает удаление или минимизацию контакта с аллергенами, фармакологическую терапию, аллергенспецифическую иммунотерапию и в редких, как правило осложненных, случаях хирургическое вмешательство. Фармакологическое лечение в свою очередь предполагает применение антигистаминных препаратов (АГП) (системных и топических), антагонистов лейкотриеновых рецепторов, топических глюкокортикостероидов, вазоконстрикторов. Надо отметить, что именно АГП наиболее широко применяются при АР [10, 12, 13].
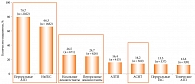
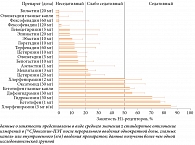
Результаты ряда исследований, выполненных в разных регионах мира, показали, что пациенты с АР чаще (> 50%) получают системные АГП, предпочитая их остальным группам препаратов для лечения АР (рис. 2) [13, 14].
АГП в клинической практике применяются давно. Те, которые впервые появились на фармацевтическом рынке, называются АГП первого поколения (АГП I). АГП второго поколения (АГП II) применяются с 1980-х гг. АГП I характеризуются рядом нежелательных побочных эффектов (выраженное седативное/снотворное действие, низкая специфичность к Н1-гистаминовым рецепторам и значительные антихолинергические эффекты), что существенно ограничивает их применение в настоящее время. Для преодоления этих недостатков при создании АГП II были предприняты существенные фармакологические модификации молекул АГП [15]. Ввиду многообразия и доступности АГП II сегодня АГП I не рекомендуются при аллергических заболеваниях. Исключение составляют редкие случаи атопического дерматита, сопровождающегося выраженным нарушением сна из-за ночного зуда, или ситуации, когда требуется парентеральное введение АГП. Вместе с тем наличие множества АГП II диктует необходимость понимания фармакологических характеристик отдельных лекарственных средств, что крайне важно для эффективного и более безопасного использования АГП II в клинической практике.
Почему АГП являются препаратами первого выбора в терапии АР?
Гистамин образуется в виде биологического амина из L-гистидина благодаря действию гистидиндекарбоксилазы. К клеткам, продуцирующим гистамин, относятся гистаминовые нейроны, энтерохромаффиноподобные клетки желудка, тучные клетки и базофилы. Действие гистамина проявляется через четыре типа рецепторов гистамина H1, H2, H3 и H4 (рецепторы, связанные с G-белком) и связано с нейротрансмиссией, сокращением гладких мышц, проницаемостью сосудов, секрецией желудочной кислоты, функцией активированных тучных клеток и базофилов. Гистамин – один из основных медиаторов немедленной аллергической реакции, развивающейся в назальной слизистой при воздействии аллергена(ов). Эффекты гистамина при этом типе аллергического ответа осуществляются через Н1-рецепторы, с которыми в основном связаны АГП. Н1-рецепторы распределяются в различных клетках: клетках центральной нервной системы, клетках гладких мышц (кровеносных сосудов и дыхательной системы), эндотелиальных клетках, хондроцитах, гепатоцитах, дендроцитах, моноцитах, нейтрофилах и лимфоцитах. H1-антигистаминные препараты структурно не связаны с гистамином и являются обратными агонистами, связывающимися с сайтами рецепторов, отличающимися от сайтов, с которыми связывается гистамин, переводя таким образом Н1-рецептор в неактивное состояние и блокируя эффекты гистамина [16].
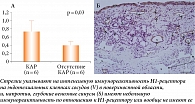
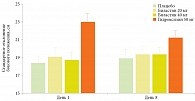
Обоснованием эффективности АГП при АР служат результаты исследования локализации и экспрессии Н1-гистаминовых рецепторов в назальной слизистой при круглогодичном аллергическом рините (КАР) [17]. В биопсийном материале назальной слизистой пациентов с КАР изучали экспрессию H1-гистаминовых рецепторов в слизистой носовых раковин с помощью полимеразной цепной реакции в режиме реального времени, вестерн-блоттинга и иммуногистохимического анализа. Продемонстрирована высокая экспрессия мРНК Н1-рецептора у больных КАР. Уровень экспрессии белка Н1-рецептора у пациентов с аллергией (КАР) был выше, чем у пациентов с неаллергическим ринитом (рис. 3) [17]. При этом, согласно данным иммуногистохимического исследования, эпителиальные и сосудистые эндотелиальные клетки больных демонстрируют интенсивную иммунореактивность к Н1-гистаминовому рецептору. Избыточная экспрессия Н1-рецептора в назальной слизистой пациентов с АР является следствием избыточной продукции гистамина и закономерно требует коррекции, что обусловливает целесообразность назначения и эффективность АГП. АГП II за счет влияния на факторы транскрипции и последующего снижения синтеза провоспалительных белков обладают противовоспалительной/противоаллергической активностью: предотвращение дегрануляции тучных клеток, снижение экспрессии адгезионных молекул, уменьшение хемотаксиса эозинофилов и нейтрофилов, усиление апоптоза воспалительных клеток (эозинофилов), уменьшение экспрессии воспалительных цитокинов и нейрогенного провоспалительного влияния [15, 16].
В исследованиях по моделированию взаимодействия АГП с Н1-рецептором показано, что АГП II, содержащие карбоксильную группу (например, биластин, фексофенадин, левоцетиризин и олопатадин), связываются с сайтом Н1-рецептора более селективно, что может транслироваться в меньшую частоту нежелательных побочных эффектов и соответственно лучшую переносимость [15].
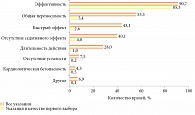
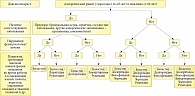
Лучшей демонстрацией высокой эффективности и хорошей переносимости АГП II у пациентов с АР являются исследования, проведенные в реальной клинической практике. Одно из таких обширных исследований под красноречивым названием «Причины для назначения антигистаминных препаратов второго поколения для лечения аллергического ринита в реальной клинической практике и ответ пациентов» было проведено сравнительно недавно во Франции [18]. Главной целью исследования стало выявление основных критериев, определяющих выбор АГП II специалистами-аллергологами Франции. Пациенты с аллергическим ринитом или риноконъюнктивитом, включенные в исследование, наблюдались в течение 30 дней после назначения АГП II в монорежиме. Пациенты заполняли вопросники ежедневно в течение первых десяти дней назначенного лечения и в конце периода наблюдения, через 30 дней. Данные об эффективности, переносимости, безопасности, частоте и типе реакции на лечение, а также об удовлетворенности пациентов были записаны и проанализированы. Вторичной целью исследования была оценка эффективности и переносимости новых АГП II, появившихся на фармацевтическом рынке Франции, прежде всего биластина. Именно биластин в этом исследовании был наиболее часто назначаемым препаратом у пациентов с АР – 89,9% случаев. Далее следовали эбастин – 4,8% случаев и дезлоратадин – 1,9% [18]. 237 аллергологов Франции включили в исследование 1080 пациентов с АР, в основном от умеренного до тяжелого (82,0%). Как показали результаты, чаще всего выбор конкретного АГП II врачи обосновывали ожидаемой эффективностью – 85,3% респондентов (рис. 4) [18]. Монотерапия АГП II (в 90% случаев это был биластин) показала высокую эффективность, хотя абсолютное большинство пациентов имели неконтролируемые среднетяжелые и тяжелые симптомы. На рисунке 5 представлена положительная динамика назальных и глазных симптомов АР в результате монотерапии системными АГП II [18].
Среднее время наступления общего облегчения симптомов АР составило 6,6 ± 3,7 дня (медиана – 6 дней). В течение десяти дней лечения 86,1% пациентов отметили эффект, и только 13,9% не ответили на лечение. Среди ответивших 78,2% имели ранний (в течение шести дней лечения) и 7,9% поздний ответ (после шести дней лечения). Лишь 66 (6,1%) пациентов отметили нежелательные явления на фоне лечения (сонливость, усталость, головная боль, сухость во рту). По мнению 67,9% больных, новый АГП II был эффективнее предыдущего лечения в облегчении симптомов АР.
Таким образом, данное наблюдательное исследование, включавшее 1080 пациентов с неконтролируемыми симптомами АР, продемонстрировало высокую эффективность АГП II, в частности биластина, который в 90% случаев назначали в монорежиме, в отношении редукции назальных и глазных симптомов АР. Интересно, что, исходя из одного критерия включения в исследование, пациенты должны были получать пероральный АГП II в монорежиме в зависимости от решения врача. В соответствии с рекомендациями ARIA [10], этот критерий должен соответствовать только пациентам с легкими симптомами АР. Тем не менее большинство пациентов – участников исследования имели умеренный или тяжелый ринит. Данные этого наблюдения согласуются с данными другого проведенного во Франции перекрестного исследования выписанных рецептов и подтверждают, что в условиях реальной практики врачи назначают АГП II в первой линии терапии. Еще одним важным результатом стала хорошая переносимость биластина, отмеченная пациентами.
Каковы фармакологические характеристики АГП II, в частности препарата биластин – одной из последних разработанных молекул АГП II с благоприятным профилем переносимости?
Седативные свойства АГП (сонливость, снижение работоспособности и т.д.) обусловлены угнетением функций центральных гистаминовых нейронов. Их клеточные тела локализуются в туберомамиллярном ядре гипоталамуса, причем нервные волокна широко распределяются от всего мозга к части спинного мозга с образованием моноаминергической нервной системы [15, 19]. В состоянии пробуждения нейроны гистамина возбуждаются для высвобождения гистамина, и высвобожденный гистамин в качестве нейротрансмиттера активирует функцию коры головного мозга либо непосредственно через рецепторы H1 и H2, либо путем возбуждения ацетилхолиновых нейронов и норадреналиновых нейронов в стволе мозга, ацетилхолиновых нейронов и глютаминовых нейронов в гипоталамусе. Активация функции коры головного мозга нейронами гистамина тесно связана с поддержанием состояния возбуждения, усилением когнитивных функций и подавлением аппетита [19].
Для реализации седативных свойств АГП должны проникать в мозг и связываться с Н1-рецепторами. Таким образом, занятость H1-рецептора мозга (H1RO, Н1-receptor occupancy) была исследована как показатель седативного потенциала АГП [20]. Для измерения этого индекса используются [11C]доксепин и позитронно-эмиссионная томография (ПЭТ) [19, 20]. Была показана корреляция между возникновением седативных эффектов и H1RO, измеренной с помощью ПЭТ.
K. Yanai и соавт. измерили H1RO многих АГП I и АГП II и предложили классифицировать их по уровню H1RO [21]. Важность H1RO как показателя неседативных свойств АГП отмечалась также экспертами Британского общества аллергии и клинической иммунологии на заседании Консенсусной группы по новому поколению антигистаминных препаратов (CONGA) [22]. На основании показателя H1RO после однократного перорального приема АГП подразделяются на три группы: неседативные (< 20%), слабо седативные (20–50%) и седативные (≥ 50%) (рис. 6) [15]. Согласно результатам измерений нескольких исследовательских групп, неседативная группа АГП II включает: биластин (20 мг), фексофенадин (60–120 мг), левоцетиризин (5 мг), эпинастин (20 мг), эбастин (10 мг), лоратадин (10 мг), терфенадин (60 мг), цетиризин (10 мг), олопатадин (5 мг) и бепотастин (10 мг) (рис. 6) [15]. Химическая структура АГП II, принадлежащих к неседативной группе, характеризуется наличием гидрофильных функциональных групп, то есть карбоксильной группы (-COOH) и/или аминогруппы (-NH), способных препятствовать проникновению через гематоэнцефалический барьер (ГЭБ).
Среди неседативных АГП II показатель оккупации Н1-рецепторов головного мозга биластина и фексофенадина практически равен нулю. То есть эти препараты можно позиционировать как «не проникающие в головной мозг», что обусловлено еще и достаточно большим молекулярным весом. Кроме того, как и большинство неседативных АГП, эти препараты являются субстратами P-гликопротеина, и их проникновение через ГЭБ ограниченно [19].
Следует отметить, что биластин обладает умеренной аффинностью к H1-рецептору, тогда как аффинность фексофенадина относительно невелика. Проявлять активность, сходную с таковой биластина, фексофенадин может только в более высокой дозе.
Как уже отмечалось, биластин в силу наличия карбоксильной группы проявляет высокую специфичность к Н1-рецепторам, имеет короткое время до максимальной концентрации в плазме (tmax = 1,3 ч) и длительный период полувыведения (t1/2 = 14,5 ч). Биластин не метаболизируется или минимально метаболизируется, не требует коррекции дозы в соответствии с уровнем дисфункции печени и коррекции дозы для пациентов с почечной дисфункцией.
Реальное влияние биластина на способность управлять автомобилем оценивали в тесте по вождению на дороге в двойном слепом четырехстороннем перекрестном исследовании с участием 22 здоровых добровольцев. Они получали (случайным образом) рекомендуемую дозу биластина (20 мг) или его удвоенную дозу (40 мг) один раз в день, гидроксизин 50 мг (активный контроль) или плацебо восемь дней подряд [23]. Первичную переменную эффективности, SDLP (стандартное отклонение бокового положения) в тесте дорожного слежения, оценивали в первый и восьмой дни периода лечения каждым препаратом. Существенных различий между биластином 20 или 40 мг и плацебо в отношении значений SDLP в первый и восьмой дни не установлено (рис. 7) [23]. И наоборот, несмотря на снижение степени нарушения вождения к восьмому дню лечения, SDLP был значительно увеличен при использовании гидроксизина по сравнению с плацебо в оба дня оценки. Продемонстрировано отсутствие толерантности с течением времени к седативным эффектам препарата. Важно, что на способность управлять автомобилем после однократных и многократных доз биластин не влиял, что говорит о его безопасности в дозах до 40 мг для водителей. Исследователи пришли к выводу, что, согласно имеющимся данным, биластин характеризуется оптимальным соотношением «польза – риск», удовлетворяет условиям обеспечения безопасности водителей, которые нуждаются в приеме АГП, и, следовательно, может считаться у них препаратом выбора среди антигистаминных средств [23].
В двойном слепом пятистороннем перекрестном рандомизированном исследовании анализировали психомоторные характеристики с помощью множественных объективных тестов (оценки двигательной активности, восприятия, внимания и ассоциативной интеграции) у 20 здоровых субъектов с использованием биластина (20, 40 или 80 мг), гидроксизина (25 мг) и плацебо один раз в день в течение семи дней [24]. Значимые психомоторные нарушения отмечались на фоне приема гидроксизина и лишь 80 мг биластина, тогда как биластин в дозах 20 и 40 мг не влиял на психомоторные реакции.
Эффективность и хорошая переносимость биластина доказаны в рандомизированных контролируемых исследованиях у пациентов не только с сезонным [25, 26], но и круглогодичным АР [27, 28]. У больных КАР биластин оказался так же эффективен, как цетиризин и фексофенадин, при этом частота сонливости на фоне приема биластина (20 мг один раз в день) и фексофенадина (60 мг два раза в день) в течение двух недель у японских пациентов с КАР составила 0,8 и 0,4% соответственно [28].
Таким образом, как отмечалось выше, биластин в обычной дозе (20 мг) является эффективным АГП II в достижении и поддержании контроля симптомов АР у взрослых пациентов. При этом он демонстрирует хорошую переносимость и безопасность. В обычной и двукратной дозе (40 мг) биластин не вызывает психомоторных нарушений и не влияет на способность управления автомобилем. В обычной дозе (20 мг) препарат не вступает во взаимодействие с алкоголем [29].
Экспертные заключения относительно благоприятного выбора АГП II для лечения пациентов с АР
Как показывают данные рандомизированных контролируемых исследований, эффективность большинства АГП II при АР в основном одинакова. Результаты исследования в реальной клинической практике показали высокую эффективность биластина в монорежиме. Между тем исследование не было сравнительным, и говорить о более высокой эффективности препарата по сравнению с другими АГП II неправомерно. Значит, выбор АГП II будет основываться на характеристиках безопасности и переносимости, а в этом случае преимущества биластина очевидны. Препарат относится к неседативным АГП II, не вызывает психомоторных нарушений, в обычной и двукратной дозе не влияет на способность управлять автомобилем, в стандартной дозе не вступает во взаимодействие с алкоголем. Кроме того, биластин практически не подвергается метаболизму и не влияет на функции печени и почек [19]. Поэтому можно в полной мере согласиться с консенсусным заключением экспертов Азиатско-Тихоокеанского региона, что выбор оптимального АГП II зависит от многих факторов, в частности от безопасности и эффективности лекарственных средств, их влияния на психомоторные способности и седативного эффекта. Необходимо также учитывать такие факторы, как доступность препаратов и фармакоэкономическая эффективность. Результаты проведенного экспертами исследования и анализа показывают, что биластин является предпочтительным выбором для терапии АР вследствие его высокой эффективности и безопасности, пригодности для особых групп пациентов и отсутствия седативного эффекта (рис. 8) [30].
Таким образом, биластин можно рассматривать как препарат, наиболее полно отвечающий требованиям экспертов ARIA [10] к АГП: селективная блокада H1-рецепторов, высокий антиаллергический эффект, быстрое наступление клинического эффекта, продолжительность действия 24 часа, отсутствие тахифилаксии и хорошая переносимость.
N.M. Nenasheva, MD, PhD, Prof.
Russian Medical Academy of Continuing Professional Education
Contact person: Natalya M. Nenasheva, 1444031@gmail.com
Antihistamines refer to the most often prescribed pharmacological therapies for allergic diseases, including allergic rhinitis (AR). The article considers topical issues for a practitioner: why antihistamines drugs are of the first choice in the treatment of AR? What are the pharmacological characteristics of second-generation antihistamines, in particular bilastine – one of the last developed second-generation antihistamines molecules with the favorable tolerability profile? Besides, provided expert opinions on the favorable selection of second-generation antihistamines for the treatment of patients with AR.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.