Роль современных антигистаминных препаратов в лечении сезонной аллергии
- Аннотация
- Статья
- Ссылки
- English





Введение
Последние 30 лет повсеместно наблюдается рост распространенности аллергических заболеваний, в структуре которых одно из ведущих мест занимает сезонная аллергия, обусловленная пыльцой растений. Заболеваемость поллинозом увеличивается из-за многочисленных факторов, включая генетику, загрязнение окружающей среды, климатические, экологические, географические характеристики регионов, уровень их социально-экономического развития, профессиональную деятельность [1, 2]. В европейских странах встречаемость поллиноза превышает 40% [3], в регионах России колеблется от 12,7 до 24,0% [4].
Поллиноз (пыльцевая аллергия, сенная лихорадка) – заболевание, в основе которого лежит аллергическая реакция немедленного типа. Заболевание характеризуется острым аллергическим воспалением слизистых оболочек дыхательных путей, глаз, кожи. Реже в процесс вовлекаются пищеварительная, сердечно-сосудистая, мочеполовая и нервная системы. Развитие заболевания по времени совпадает с пылением определенных растений, поэтому характеризуется сезонностью и повторяемостью. Поллиноз относят к генетически детерминированной патологии. Однако наследуется не собственно заболевание, а предрасположенность к атопии. По данным разных исследователей, наследственная предрасположенность выявляется у 60% пациентов. Дебют патологии часто приходится на дошкольный и школьный возраст [5].
Поллиноз не является тяжелым заболеванием, тем не менее способен существенно снизить качество жизни больных. В частности, он нередко становится причиной нарушения сна, снижения учебной и профессиональной деятельности.
Кроме того, патология ассоциируется со значительными финансовыми затратами. Нередко первые симптомы появляются в возрасте от восьми до 20 лет. Вместе с тем заболевание может развиться и у детей раннего возраста, и у лиц старших возрастных групп [6]. Среди горожан заболеваемость в 4–6 раз выше, чем среди жителей сельской местности [7].
Этиология и патогенез
Чтобы вызвать сенсибилизацию, пыльца ветроопыляемых растений должна быть легкой и летучей, небольших размеров (от 20 до 35 мкм), обладать выраженной антигенной активностью. Немаловажное значение имеет и концентрация пыльцы в воздухе – от десяти до 50 зерен в 1 м3 [6]. В европейской и средней полосе России выделяют три периода поллиноза:
- весенний – с середины апреля до конца мая связан с пылением деревьев (береза, дуб, орешник, ольха, клен, ясень, платан, вяз, тополь);
- летний – с начала июня до конца июля обусловлен пылением луговых злаковых трав (тимофеевка, овсяница луговая, ежа сборная, пырей, мятлик луговой, костер, лисохвост, райграс), культивируемых злаков (рожь, пшеница, кукуруза);
- летне-осенний – с конца июля до конца сентября ассоциируется с цветением сорных трав (полынь, лебеда, амброзия, подсолнечник).
Указанные сроки могут сдвигаться на 7–10 дней в зависимости от метеорологических условий. Сегодня в связи с глобальным потеплением климата весенняя аллергия наступает на 10–14 дней раньше, чем 20 лет назад.
Степень выраженности симптомов зависит не только от количества зерен пыльцы в воздухе, но и от индивидуальной реактивности пациентов [8]. Пыльца растений имеет сложный антигенный состав и содержит от пяти до десяти аллергенных компонентов. При этом антигенные белки могут присутствовать как в пыльце, так и в других частях растения (семенах, листьях, стеблях, плодах). Это обусловливает непереносимость пациентами с поллинозом препаратов растительного происхождения и развитие перекрестной пищевой аллергии (табл. 1) [7].
Механизм развития поллиноза – классический пример немедленной обусловленной иммуноглобулином (Ig) E аллергической реакции первого типа, развивающейся под воздействием аллергенов на слизистую оболочку носа, бронхиального дерева, конъюнктивы. Когда специфические IgE-антитела, связанные с высокоаффинными рецепторами тучных клеток или базофилов, связывают аллерген, тучная клетка активируется и высвобождает активные медиаторы, такие как гистамин, цистеиниловые лейкотриены, тромбоцит-активирующий фактор. Именно эти медиаторы вызывают развитие аллергической реакции немедленного типа. Гистамин активно участвует в формировании как ранней, так и поздней фазы аллергической реакции, обусловливая подавляющее большинство клинических проявлений поллиноза. Будучи важнейшим медиатором аллергической реакции немедленного типа, гистамин характеризуется широким спектром биологической активности. Его действие реализуется за счет активации клеточных поверхностных специфических Н1-, Н2-, Н3-, Н4-рецепторов. Основные эффекты гистамина в результате активации Н1-рецепторов выражаются в повышении проницаемости сосудов, отеке, гиперсекреции, спазме гладкой мускулатуры. Именно эти эффекты гистамина блокируются антигистаминными препаратами (АГП) [9].
Клинические проявления
Для поллиноза характерны сезонность и острые, рецидивирующие клинические проявления. Тяжесть сезонного обострения заболевания зависит от концентрации пыльцы в воздухе, длительности пыльцевого сезона, степени индивидуальной чувствительности.
К наиболее частым проявлениям поллиноза относятся аллергический ринит (АР) − 95–98%, аллергический конъюнктивит (АК) – 91–95%, пыльцевая бронхиальная астма (БА) − 30–40% [7].
Типичным проявлением поллиноза считается риноконъюнктивальный синдром: зуд и покраснение глаз, ощущение инородного тела в глазах, светобоязнь, слезотечение, в тяжелых случаях блефароспазм. Одновременно имеют место зуд в носу, носоглотке, ушных проходах, профузный насморк, приступы чихания, затруднение носового дыхания (чаще двустороннее, разной степени), гиперемия и мацерация кожи преддверия и крыльев носа, обонятельные расстройства, такие как аносмия или гипоосмия.
В аллергическое воспаление могут вовлекаться пазухи носа, носоглотка, слуховые трубы, гортань, что приводит к развитию синусита, евстахиита, фарингита, ларингита [10]. При прогрессирующем течении в среднем через 3–5 лет от дебюта поллиноза может развиться БА, для которой также характерна сезонность проявлений.
Около 20% пациентов, страдающих поллинозом, во врем пыления причинно-значимых растений жалуются на головную боль, резкую слабость, повышенную утомляемость, потливость, озноб, гипертермию, нарушение сна (бессонницу или сонливость), раздражительность, плаксивость. Различные сочетания указанных симптомов составляют астенический синдром, обусловленный так называемой пыльцевой интоксикацией. Данные симптомы наблюдаются при тяжелом течении поллиноза и поддаются терапии глюкокортикостероидами (ГКС), АГП [6, 10]. У некоторых пациентов отмечаются кожные проявления аллергии: контактная крапивница, атопический и контактный дерматиты. Клиническими симптомами перекрестной реактивности являются оральный аллергический синдром, гастроинтестинальные симптомы, острая крапивница, ангиоотек и анафилактический шок. Оральным аллергическим синдромом страдают от 40 до 70% больных поллинозом. Пациенты жалуются на зуд, покалывание и отек губ, языка, неба, глотки, ощущение кома в горле при употреблении продуктов, содержащих перекрестно-реагирующие аллергены (табл. 1). Гастроинтестинальные симптомы встречаются реже. К таковым относятся тошнота, боль в животе, кишечная колика, рвота и диарея. Указанные реакции возможны и вне периода палинации. В ряде случаев они могут угрожать жизни пациентов, что необходимо учитывать при ведении данной группы больных. Изменения со стороны сердечно-сосудистой и нервной систем носят функциональный характер и не регистрируются вне периода цветения.
Диагностика
Достоверная диагностика поллиноза зависит от тщательной интерпретации анамнеза, жалоб, результатов физикального, общеклинического и аллергологического обследования.
Аллергологический анамнез
Сбор анамнеза, имеющий первостепенное значение в диагностике поллиноза, включает:
- наличие аллергических заболеваний в семье или у самого пациента;
- связь симптомов с определенным временем года (сезонность проявлений);
- зависимость от погодных условий;
- пребывания на улице, за городом;
- смена места жительства или климата в сезон клинических проявлений;
- непереносимость ряда пищевых продуктов, а также препаратов растительного происхождения [2, 11].
Физикальное обследование
Физикальное исследование предполагает проведение осмотра для установления типичной клинической картины поллиноза.
Для оценки симптомов поллиноза целесообразны:
- выполнение передней риноскопии и/или эндоскопии, позволяющей выявить патологию слизистой оболочки или отклонения в анатомическом строении носа (например, анатомическую патологию перегородки, гипертрофию аденоидов или носовой перегородки, носовые опухоли/травмы/инородные тела, полипы, гранулемы) [12, 13];
- микроскопия мазка из полости носа (помогает подтвердить наличие эозинофилов, уровень которых при АР превышает 10% общего количества клеток [13]);
- измерение назальной пиковой скорости вдоха, проведение риноманометрии, теста «Дыхание с закрытым ртом» [14];
- офтальмоскопия для оценки типичной картины АК – отечности век, гиперемии и отечности конъюнктив, в тяжелых случаях – блефароспазма, отделяемого скудного, чаще бесцветного, прозрачного, без патологических примесей (кровь, гной и др.) [15];
- рентгенография придаточных пазух носа. В частности, может определяться пристеночное затемнение пазух носа, при длительном обострении – симметричное гомогенное затемнение верхнечелюстных пазух, реже решетчатого лабиринта и основных пазух;
- оценка сопутствующих заболеваний (астма, синусит, ларингит, фарингит, хронический средний отит, снижение слуха, головная боль);
- оценка качества жизни (влияние на учебу, работу, нарушение сна и социальной активности). Изменение качества жизни пациентов с пыльцевой аллергией анализируют с помощью специальных опросников для оценки качества жизни при риноконъюнктивитах (Rhinoconjunctivitis Quality of Life Questionnaire – RQLQ) и аллергенспецифического нарушения работоспособности (Work Productivity and Activity Impairment Allergic Specific – WPAI-AS), визуальной аналоговой шкалы (ВАШ) – инструмента для оценки контроля АР. Для оценки глазных симптомов разработана шкала Total Ocular Symptom Score (TOSS), включающая такие критерии, как гиперемия, зуд и слезотечение [16, 17];
- изучение функции внешнего дыхания с помощью бронхолитического теста. У пациентов могут иметь место снижение объемных и скоростных показателей дыхания (объема форсированного выдоха за первую секунду маневра, пиковой скорости выдоха, максимальной объемной скорости), обратимость бронхиальной обструкции, что свидетельствует о наличии БА [18].
Специфическое аллергологическое обследование
Все методы специфической диагностики проводятся врачами аллергологами-иммунологами в специально оборудованных кабинетах. Кожные пробы (скарификационные и внутрикожные), провокационные тесты с аллергенами выполняют в фазе ремиссии аллергического заболевания, после отмены АГП. Если проведение и интерпретация кожных проб невозможны, а также попытка выявить «виновный» аллерген оказалась безуспешной, определяют специфические IgE в сыворотке крови. В последние годы применяют молекулярную аллергодиагностику, которая позволяет повысить точность диагноза и прогноза при аллергии [19] (рис. 1).
Лечение
Цель лечения – полный контроль над симптомами поллиноза, предусматривающий:
- предотвращение или сокращение контакта с аллергенами и триггерами;
- применение фармакотерапии;
- проведение аллергенспецифической иммунотерапии;
- обучение пациента.
Элиминационные мероприятия
Элиминация аллергенов уменьшает выраженность проявлений поллиноза и потребность в медикаментозном лечении. Так, при аллергии на пыльцу растений пациентам в сезон цветения рекомендуется:
- ограничить время пребывания на улице, особенно в сухую ветреную погоду в утренние часы;
- пользоваться очистителями воздуха, улавливающими пыльцу растений в помещении;
- сменить климатическую зону;
- носить темные очки для уменьшения попадания пыльцы на слизистую оболочку глаз;
- по возвращении домой менять одежду, принимать душ.
Не рекомендуется:
- часто проветривать помещения на работе и дома, а также открывать окна машины, особенно в ранние утренние часы;
- выезжать за город или на природу;
- применять фитопрепараты, косметические средства растительного происхождения;
- проводить профилактические прививки и плановые оперативные вмешательства [6].
Аллергенспецифическая иммунотерапия
Аллергенспецифическая иммунотерапия (АСИТ) предполагает применение возрастающих концентраций и доз аллергена, вводимого подкожно или сублингвально. АСИТ имеет принципиальные преимущества перед другими методами терапии, поскольку не воздействует на симптомы заболевания, а видоизменяет характер реагирования организма на аллерген, вмешивается собственно в патогенез заболевания и влияет на все патогенетические звенья аллергической реакции. АСИТ проводится только под наблюдением врача аллерголога-иммунолога [20].
Образовательные программы
Доказано, что обучение пациентов способно изменить течение заболевания за счет улучшения контроля состояния и изменения образа жизни. Пациенты должны быть проинформированы о природе заболевания, причинах и механизмах симптомов, доступных методах лечения. Необходимо также предоставить им информацию о способах элиминации или ограничения контакта с аллергеном.
Фармакотерапия
Для достижения контроля над заболеванием используют:
- системные и топические АГП;
- топические ГКС;
- стабилизаторы мембран тучных клеток (интраназальные и интраокулярные кромоны);
- антилейкотриеновые препараты.
К симптоматическим препаратам относятся:
- топические и системные деконгестанты;
- интраназальные антихолинергические средства;
- системные ГКС.
Роль АГП в лечении сезонной аллергии
История создания АГП началась в 1907 г., когда был открыт гистамин. Его синтез из имидазолпропионовой кислоты осуществил Генри Халлет Дейл (Dale Henry Hallett). В 1937 г. A. Staub и D. Bouvet описали тормозящее действие некоторых ароматических аминов на сокращение гладкой мускулатуры, вызванное гистамином. Однако в лечении аллергических заболеваний эти соединения не использовались из-за их высокой токсичности. Первым АГП, примененным в клинической практике, стал хлоропирамин, созданный и изученный B. Halpern в 1942 г. Позже им были описаны фенотиазин и его производные, широко применяемые до настоящего времени [21].
Препаратами номер один для контроля аллергического воспаления признаны АГП, или блокаторы Н1-рецепторов [22].
Существуют две группы АГП: первого поколения (седативные) и второго поколения (неседативные). Классификация АГП представлена в табл. 2.
Применение АГП первого поколения ограничивается их седативным и антихолинергическим эффектами. Их существенными недостатками также являются короткий период полувыведения, отсутствие противовоспалительного действия, сонливость, головокружение, нарушение координации. К этим препаратам быстро развивается привыкание (тахифилаксия), и уже через неделю от начала применения требуется изменение формата лечения. Важно помнить, что АГП первого поколения обладают М-холинолитическим эффектом, а следовательно, вызывают сухость слизистых оболочек и ухудшают отхождение и без того вязкой мокроты, поэтому нежелательны для пациентов с поллинозом и обструктивным бронхитом. АГП первого поколения нельзя использовать:
- у больных БА: увеличивая вязкость мокроты, они усиливают обструкцию бронхов и ухудшают течение заболевания;
- пациентов с сердечно-сосудистыми заболеваниями: некоторые АГП первого поколения вызывают удлинение интервала QT.
В международном документе EAACI-ARIA указано на риск приема АГП первого поколения, связанный с их проникновением через гематоэнцефалический барьер (ГЭБ) и седативным воздействием. Гистамин широко представлен в центральной нервной системе, он участвует в общей мозговой активности, регулировании цикла сна и бодрствования, концентрации внимания, процессах памяти, обучения, активности. Кроме того, гистамин оказывает опосредованный антидепрессивный эффект через серотонинергическую систему. Блокирование гистаминовых рецепторов в головном мозге нарушает все эти функции. АГП первого поколения с первой же терапевтической дозой блокируют большинство гистаминовых рецепторов головного мозга. Именно по этому критерию первое поколение АГП отличают от второго. Недавно появилась публикация с оценкой последствий антихолинергического эффекта, характерного для АГП первого поколения. В статье, опубликованной в 2015 г., по результатам ретроспективного анализа 3434 историй болезни прием пожилыми пациентами препаратов с антихолинергической активностью, включая АГП первого поколения, авторы связали с увеличением риска старческой деменции и болезни Альцгеймера [23]. В соответствии с рекомендациями EAACI, GA2LEN (Global Allergy and Asthma European Network – Европейский консорциум по изучению аллергических заболеваний и бронхиальной астмы), WAO, седативные АГП первого поколения больше не должны использоваться в качестве терапии первого выбора, за исключением случаев, когда АГП второго поколения недоступны или преимущества их использования перевешивают риски [24]. В частности, речь идет о редких случаях атопического дерматита, сопровождающегося выраженным нарушением сна из-за ночного зуда, или ситуации, когда требуется парентеральное введение АГП.
Современные международные рекомендации по лечению аллергического ринита содержат специальные требования к АГП.
Основные требования EAACI-ARIA к эффективности Н1-блокаторов сводятся к следующему:
- селективная блокада H1-рецепторов;
- быстронаступающий выраженный противоаллергический эффект;
- продолжительность действия 24 часа (однократный прием);
- высокая эффективность при продолжительном применении (нет необходимости менять препарат);
- доказанная эффективность при всех видах АР, в том числе персистирующем;
- доказанная эффективность при заложенности носа и других симптомах АР;
- доказанная эффективность у детей раннего возраста и пожилых лиц;
- положительное влияние на астму.
Требования EAACI-ARIA к безопасности Н1-блокаторов предусматривают:
- отсутствие седации и влияния на познавательные и психомоторные функции;
- отсутствие атропиноподобного действия;
- отсутствие кардиотоксического эффекта;
- отсутствие негативного влияния на другие заболевания;
- доказанную безопасность у детей раннего возраста и пожилых лиц;
- отсутствие клинически значимых взаимодействий с пищей, лекарственными средствами, транспортными белками, системой цитохромов P4503А (СYP3A).
Кроме того, H1-блокаторы не должны вызывать увеличения массы тела.
Согласно международным рекомендациям ARIA 2008 г. [25], а также современным европейским позиционным документам [26], пероральные и топические АГП второго поколения следует назначать на любой ступени терапии АР в силу их клинической эффективности, хорошего профиля безопасности и противовоспалительной активности.
Основные требования к АГП второго поколения были сформулированы исходя из опыта их применения при АР:
- высокая клиническая эффективность в отношении симптомов интермиттирующего и персистирующего АР;
- способность подавлять глазные симптомы;
- эффективность у детей и пожилых лиц;
- отсутствие тахифилаксии при длительном применении;
- отсутствие нежелательных побочных эффектов;
- улучшение качества жизни больных [27].
Согласно федеральным клиническим рекомендациям, при сезонной форме АР профилактическая противоаллергическая терапия назначается после анализа данных о течении заболевания в предыдущем сезоне (выраженность клинических проявлений, эффективность назначенных препаратов и результаты обследования) за одну-две недели до предполагаемого сезонного обострения. Учитывая особенности течения АР, наличие таких феноменов, как минимальное персистирующее воспаление и эффект прайминга, АГП второго поколения следует применять на протяжении всего периода цветения и отменять через 2–4 недели после окончания сезона пыления [18].
На отечественном фармацевтическом рынке представлен широкий выбор АГП второго поколения. Препарат биластин – одна из последних разработанных молекул АГП второго поколения с благоприятным профилем переносимости.
АГП биластин – производное бензимидазол-пиперидина появился в арсенале врачей в 2011 г. В нашей стране он зарегистрирован в 2017 г. Биластин является отдельным химическим веществом, а не структурным производным от других соединений этого класса. Стандартная рекомендуемая доза биластина составляет 20 мг однократно в сутки и назначается при аллергическом риноконъюнктивите (сезонном и круглогодичном) и крапивнице взрослым и подросткам старше 12 лет.
Препарат имеет некоторые отличия от других представителей своего класса, заслуживающие внимания клиницистов. Прежде всего необходимо отметить, что в исследованиях in vitro биластин продемонстрировал высокую специфическую аффинность к Н1-рецепторам при очень низкой аффинности к другим рецепторам (Н2, Н3, Н4, серотониновым, брадикининовым, М- и адренорецепторам) [28]. По данному показателю биластин в три раза превосходит цетиризин и в пять раз – фексофенадин. Антигистаминный эффект начинается через 30 минут, максимальный эффект персистирует с 30-й минуты до 26 часов. Особенностью препарата является то, что он практически не подвергается метаболизму, не взаимодействует с CYP 450 и не требует коррекции дозы у пациентов с печеночной и почечной дисфункцией [29].
Клиническая эффективность препарата биластин
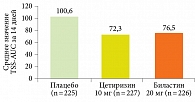
Эффективность биластина изучали в 118 исследованиях I фазы, пяти исследованиях II фазы и пяти исследованиях III фазы с участием пациентов в возрасте 11–83 лет с сезонным АР, круглогодичным АР и хронической идиопатической крапивницей. В сравнительном исследовании биластина и цетиризина у больных сезонным АР эффективность биластина была сопоставима с таковой цетиризина в отношении уменьшения симптомов заболевания через 14 дней терапии (рис. 2). В отношении профиля безопасности биластин продемонстрировал преимущество: на фоне его применения значительно реже, чем при использовании цетиризина и плацебо, развивались такие побочные эффекты, как сонливость (1,8, 7,5 и 2,2% соответственно) и усталость (0,4, 4,8 и 3,1% соответственно) [30].
В другом клиническом исследовании, проведенном в Венской провокационной камере, были продемонстрированы скорость наступления и длительность клинического эффекта биластина [31]. Пациенты подвергались шестичасовой провокации аллергеном в первый день, после чего следовала четырехчасовая провокация той же концентрацией аллергена на второй день. Препараты принимали внутрь однократно, через два часа после начала провокации аллергеном в первый день (время 0). На рисунке 3 представлена динамика эффекта биластина 20 мг, цетиризина 10 мг, фексофенадина 120 мг и плацебо и аллерген-индуцированного увеличения общей оценки назальных симптомов, которая проводилась каждые 15 минут в Венской провокационной камере. Скорость наступления эффекта была равна одному часу для всех трех препаратов, и между ними не было статистической разницы (рис. 3А).
Вместе с тем на второй день (через 22–26 часов после приема препарата) биластин и цетиризин обеспечивали значимую защиту от симптомов аллергии по сравнению с фексофенадином (p = 0,0012 и p < 0,001 для биластина и цетиризина соответственно) (рис. 3Б). Это свидетельствует о том, что они имеют более продолжительное действие.
Переносимость и безопасность препарата биластин
Безопасность биластина оценивали у здоровых добровольцев, которые получали препарат 14 дней. Как показали результаты, препарат в дозах 20–100 мг/сут хорошо переносится, частота неблагоприятных событий не отличается от таковой при использовании плацебо.
В исследованиях с участием пациентов с аллергическим риноконъюнктивитом получены аналогичные результаты. Биластин метаболизируется незначительно, после однократного применения до 95% принятой дозы выводится в неизмененном виде почками (28,3%) и с желчью (66,5%) [20]. Биластин также не влияет на работу изоферментов цитохрома Р450 (CYP) и не обладает значимым потенциалом лекарственных взаимодействий [32].
Биластин в дозах до 100 мг/сут не вызывает побочных эффектов со стороны сердечно-сосудистой системы, в том числе не изменяет интервал QT. Одновременный прием биластина 20 мг и кетоконазола 400 мг не усиливает изменения на электрокардиограмме [33].
Седативные свойства АГП (сонливость, снижение работоспособности и т.д.) обусловлены угнетением функций центральных гистаминовых нейронов. Их клеточные тела локализуются в туберомамиллярном ядре гипоталамуса, причем нервные волокна широко распределяются от всего мозга к части спинного мозга с образованием моноаминергической нервной системы [34, 35]. В состоянии пробуждения нейроны гистамина возбуждаются для высвобождения гистамина, и высвобожденный гистамин в качестве нейротрансмиттера активирует функцию коры головного мозга либо непосредственно через рецепторы H1 и H2, либо путем возбуждения ацетилхолиновых нейронов и норадреналиновых нейронов в стволе мозга, ацетилхолиновых нейронов и глютаминовых нейронов в гипоталамусе. Активация функции коры головного мозга нейронами гистамина тесно связана с поддержанием состояния возбуждения, усилением когнитивных функций и подавлением аппетита [35]. Для реализации седативных свойств АГП должны проникать в мозг и связываться с Н1-рецепторами. Таким образом, занятость H1-рецептора мозга (H1RO, Н1-receptor occupancy) была исследована как показатель седативного потенциала АГП [36]. Для измерения этого индекса используются [11C] доксепин и позитронно-эмиссионная томография (ПЭТ) [35, 36]. Была показана корреляция между возникновением седативных эффектов и H1RO, измеренной с помощью ПЭТ.
K. Yanai и соавт. измерили H1RO многих АГП первого и второго поколений и предложили классифицировать их по уровню H1RO [37].
Важность H1RO как показателя неседативных свойств АГП отмечалась также экспертами Британского общества аллергии и клинической иммунологии на заседании Консенсусной группы по новому поколению антигистаминных препаратов (CONGA) [38].
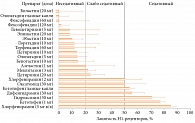
На основании показателя H1RO после однократного перорального приема АГП подразделяются на три группы: неседативные (< 20%), слабо седативные (20–50%) и седативные (≥ 50%) (рис. 3) [34]. Согласно результатам измерений нескольких исследовательских групп, неседативная группа АГП второго поколения включает: биластин (20 мг), фексофенадин (60–120 мг), левоцетиризин (5 мг), эпинастин (20 мг), эбастин (10 мг), лоратадин (10 мг), терфенадин (60 мг), цетиризин (10 мг), олопатадин (5 мг) и бепотастин (10 мг) (рис. 4) [34].
Химическая структура АГП второго поколения, принадлежащих к неседативной группе, характеризуется наличием гидрофильных функциональных групп, то есть карбоксильной группы (-COOH) и/или аминогруппы (-NH), способных препятствовать проникновению через ГЭБ. Среди неседативных АГП второго поколения показатель оккупации Н1-рецепторов головного мозга биластина и фексофенадина практически равен нулю. То есть эти препараты можно позиционировать как не проникающие в головной мозг, что обусловлено еще и достаточно большим молекулярным весом. Кроме того, как и большинство неседативных АГП, эти препараты являются субстратами P-гликопротеина, и их проникновение через ГЭБ ограниченно [35].
Следует отметить, что биластин обладает умеренной аффинностью к H1-рецептору, тогда как аффинность фексофенадина относительно невелика. Проявлять активность, сходную с таковой биластина, фексофенадин может только в более высокой дозе.
Реальное влияние биластина на способность управлять автомобилем оценивали в тесте по вождению на дороге в двойном слепом четырехстороннем перекрестном исследовании с участием 22 здоровых добровольцев. Они получали (случайным образом) рекомендуемую дозу биластина (20 мг) или его удвоенную дозу (40 мг) один раз в день, гидроксизин 50 мг (активный контроль) или плацебо восемь дней подряд [39]. Первичную переменную эффективности, SDLP (стандартное отклонение бокового положения) в тесте дорожного слежения, оценивали в первый и восьмой дни периода лечения каждым препаратом. Существенных различий между биластином 20 или 40 мг и плацебо в отношении значений SDLP в первый и восьмой дни не установлено (рис. 5) [39]. И наоборот, несмотря на снижение степени нарушения вождения к восьмому дню лечения, SDLP был значительно увеличен при использовании гидроксизина по сравнению с плацебо в оба дня оценки. Продемонстрировано отсутствие толерантности с течением времени к седативным эффектам препарата. Важно, что после однократных и многократных доз биластин не влиял на способность управлять автомобилем, что говорит о его безопасности в дозах до 40 мг для водителей. Исследователи пришли к выводу, что биластин характеризуется оптимальным соотношением «польза – риск», удовлетворяет условиям обеспечения безопасности водителей, которые нуждаются в приеме АГП, и, следовательно, может считаться у них препаратом выбора среди АГП [39].
Заключение
Своевременная диагностика и адекватное лечение сезонных проявлений аллергии с использованием современных препаратов позволяют добиваться быстрого купирования симптомов поллиноза, улучшать качество жизни пациентов, значительно уменьшать риск развития осложнений. Современные АГП второго поколения являются эффективными средствами для купирования симптомов сезонной аллергии.
Биластин можно рассматривать как препарат, наиболее полно отвечающий требованиям экспертов ARIA к АГП: селективная блокада H1-рецепторов, высокий антиаллергический эффект, быстрое наступление клинического эффекта, продолжительность действия 24 часа, отсутствие тахифилаксии и хорошая переносимость.
Ye.P. Terekhova, PhD, N.M. Nenasheva, MD, PhD, Prof., D.V. Terekhov, PhD
Russian Medical Academy of Continuing Professional Education
Research Institute of Pulmonology of FMBA of Russia
Contact person: Yekaterina P. Terekhova, e.p._terekhova57@mail.ru
Seasonal allergy caused by pollen from plants is known as one of the most common allergic diseases. The article discusses the prevalence of hay fever, etiology, clinical manifestations, modern methods of diagnosis and therapy. Second generation antihistamines are the first choice in the treatment of hay fever. The benefits of reverse histamine agonists in treating seasonal allergies are examined in detail. The drug bilastin is one of the lately developed molecules of antihistamines in the second generation with a favorable safety profile and high efficiency in relieving the symptoms of seasonal allergic rhinoconjunctivitis. Its mechanism of action is presented in the article.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.