Положительный опыт комплексного консервативного лечения острого и хронического гайморита в стадии обострения
- Аннотация
- Статья
- Ссылки

Рост воспалительных заболеваний околоносовых пазух происходит в первую очередь из-за серьезных экологических сдвигов, в частности, возросшей загрязненности и загазованности воздушной среды, увеличения числа респираторных вирусных инфекций, количества ингалируемых аллергенов, снижения резервных возможностей верхних дыхательных путей, возросшей резистентности флоры в результате нерационального применения антибиотиков.
Физиология
Приступая к обсуждению этиологии и патогенеза синусита, следует определиться с терминологией и классификацией. Чаще всего бактериальный синусит развивается у здорового человека на фоне респираторной вирусной инфекции, и лечение заболевания проводится в амбулаторных условиях. Эту основную по численности группу синуситов называют внебольничными. Помимо нее существуют госпитальные, одонтогенные синуситы, а также синуситы, развившиеся у больных с иммунодеффицитными состояниями. Возбудители и патогенез этих форм принципиально различаются.
Риносинусит – это воспаление слизистой оболочки носа и околоносовых пазух, практически всегда вызываемое застоем секрета, нарушением аэрации пазух и, как следствие, инфицированием. Острые риносинуситы обычно имеют вирусную или бактериальную этиологию, хронические – бактериальную, реже грибковую.
Пусковым моментом в развитии острого синусита, как правило, бывает вирусная инфекция, причем наиболее типичным возбудителем являются риновирусы (более 80% случаев). Исследования, проведенные с использованием компьютерной, магнитно-резонансной томографии, а также в результате реоэнцефалографии и биомикроскопии, показали, что почти у 90% больных ОРВИ в слизистой оболочке околоносовых пазух выявляются изменения в виде отека, нарушения микроциркуляции и застоя секрета. Однако лишь у 0,5–2% больных развивается бактериальный воспалительный процесс. Для возникновения инфекционного процесса ведущее значение, наряду с вирулентными свойствами возбудителя, имеет состояние макроорганизма. Оно определяется сложным комплексом факторов и механизмов, тесно связанных между собой, и характеризуется как чувствительность и резистентность к инфекции. Не менее важную роль в развитии синусита (и особенно для его хронизации) играют аномалии строения внутриносовых структур и решетчатого лабиринта. Нарушение нормальных анатомических взаимоотношений в полости носа изменяет аэродинамику, способствуя попаданию неочищенного воздуха в околоносовые пазухи, повышая тем самым риск развития воспаления. Полипы, отечная слизистая оболочка, искривленная перегородка носа, шипы и гребни перегородки носа (расположенные на уровне среднего носового хода), булла и парадоксальный изгиб средней носовой раковины, патологические варианты строения крючковидного отростка нарушают проходимость естественных отверстий околоносовых пазух и приводят к стагнации секрета и снижению парциального давления кислорода в околоносовых пазухах. Дополнительное соустье верхнечелюстной пазухи в задней фонтанелле также является патологическим фактором, предрасполагающим к развитию синусита. Из-за противоположной направленности мукоциллиарного транспорта на внутренней и внешней поверхностях фонтанеллы наличие двух или более отверстий создает условия для рециркуляции, то есть заброса побывавшей в полости носа и инфицированной слизи обратно в верхнечелюстную пазуху.
Переходя к рассмотрению микробного пейзажа синусита, следует подчеркнуть, что вирусное инфицирование является лишь первой фазой заболевания, и оно «прокладывает путь» бактериальной инфекции. В условиях нормального функционирования механизма мукоциллиарного транспорта бактерии не имеют возможности для достаточно длительного контакта с клетками эпителия полости носа. При поражении слизистой оболочки вирусом продлевается время контакта патогенных бактерий с клетками и становится возможным вторичное бактериальное инфицирование.
Ранее существовало представление о стерильности околоносовых пазух. Однако это вряд ли возможно, так как согласно законам нормальной физиологии околоносовые пазухи имеют постоянный контакт с другими отделами верхних дыхательных путей, где постоянно вегетирует самая разнообразная микрофлора. Возбудителями инфекционного синусита могут быть как патогенные, так и условно-патогенные микроорганизмы. Последние являются естественными обитателями организма человека и вызывают заболевания при снижении местного и общего иммунитета. Именно представители условно-патогенной микрофлоры являются наиболее значимыми возбудителями бактериального синусита, подтверждая положение, что при любом синусите в той или иной степени страдает иммунитет.
Среди возбудителей синусита наиболее значимыми в настоящее время являются S.pneumoniae, H.influenzae, реже встречается Moraxella catarrhalis.
Streptococcus pneumoniae – это грамположительный кокк из группы α-гемолитических стрептококков. Различные серотипы пневмококка, последовательно сменяя друг друга, колонизируют носоглотку сразу после рождения. По мере выработки в организме соответствующих факторов иммунитета и элиминации одного микроорганизма его сменяет другой, причем период персистенции конкретного серотипа может длиться от одного до двеннадцати месяцев. Поскольку Streptococcus pneumoniae имеет более 90 различающихся по антигенным свойствам серотипов, этот микроорганизм может присутствовать в полости носа годами и способен в любой момент вызвать развитие бактериального синусита. Некоторые авторы отмечают, что серьезные внутричерепные и орбитальные осложнения при остром синусите обычно являются результатом инфицирования S.pneumoniae.
H.influenzae – мелкая грамотрицательная палочка, более вирулентная и резистентная к антибиотикам, чем пневмококк. С ней также связывают развитие внутричерепных осложнений. Так же как и пневмококк, ее разные штаммы, сменяя друг друга, колонизируют носоглотку.
Среди других возбудителей выделяют Moraxella catarrhalis (примерно в 4% случаев у взрослых и 12% у детей) и стрептококки других групп.
В процентном соотношении при остром синусите в 44,9% случаев выделяется S.pneumoniae, в 17,3% – H.influenzae, в 10,2% – анаэробы, в 7,1% – ассоциации аэробов (S.pneumoniae и H.influenzae). Приведенные данные коррелируют с исследованиями, проведенными в других странах. Существует и альтернативное мнение о том, что самой многочисленной группой микроорганизмов, вызывающих воспалительные заболевания слизистой оболочки полости носа и околоносовых пазух, являются стафилококки, составляя 77% всех посевов, при этом около 40% принадлежит эпидермальному, а 60% – золотистому стафилококку. Однако, по мнению других авторов, золотистый стафилококк не относится к типичным возбудителям острого синусита, несмотря на высокую частоту высеваемости. Этот микроорганизм является «путевой» флорой, попадая на тампон или пункционную иглу с волосков преддверия полости носа. Считается, что S.aureus ответственен за наиболее тяжелые случаи госпитального (нозокомиального) синусита.
При хронических синуситах микробная флора отличается большим разнообразием, и спектр возбудителей несколько смещается в пользу анаэробной флоры. Так, по данным ряда исследований, в 52% случаев выделяются аэробы (различные стрептококки – 21%, гемофильная палочка – 16%, синегнойная палочка – 15%, золотистый стафилококк и моракселла – по 10%), и в 48% случаев – анаэробы (Prevotella – 31%, анаэробные стрептококки – 22%, Fusobacterium –15% и др.).
Препараты терапии
Антибиотики для местного воздействия. Многочисленные исследования показали, что препараты для местного воздействия особенно эффективны в лечении синусита в тех случаях, когда хорошо проходимы естественные соустья пазух. Кроме того, существует целый ряд работ, показывающих целесообразность использования местных препаратов у больных после различных операций в полости носа и околоносовых пазухах, когда особенности течения послеоперационного периода диктуют необходимость проведения именно местного лечения. Преимуществами местной терапии в данном случае являются: непосредственное воздействие на послеоперационную область, возможность создания оптимальной концентрации препарата в очаге, отсутствие системного действия за счет крайне низкой их системной абсорбции.
Системная антибиотикотерапия является основным направлением в лечении инфекционных синуситов за рубежом. Наличие широкого выбора эффективных антибактериальных средств, исчерпывающей информации о чувствительности и природной резистентности к ним микроорганизмов, с определенной частотой ассоциированных с тем или иным заболеванием, а также отсутствие надежных методов ускоренной бактериологической диагностики превращают эмпирическую антибактериальную терапию в наиболее рациональную стратегию этиотропной терапии в период возникновения острых гнойных или обострения хронических синуситов на начальном этапе их лечения.
Огромный арсенал современных антибиотиков, безусловно, расширяет возможности клинициста. Успешной реализации указанных задач способствует хорошая ориентированность в спектре действия, в фармакокинетике, микробиологическом влиянии препарата, а также информированность о его доказанной эффективности и безопасности. Большинство ошибок при назначении антибиотика в амбулаторной практике связано именно с неправильным выбором препарата. Главным критерием при этом по-прежнему является возможность воздействия на основных возбудителей воспаления. Приоритетом для выбора того или иного препарата служит не широкий, а оптимальный спектр антибактериальной активности, то есть тот, что охватывает наиболее значимые по статистическим данным в настоящее время и наиболее вероятные именно для данного больного возбудители. Другая проблема при назначении антибиотиков заключается в отсутствии учета уровня приобретенной резистентности возбудителей в популяции. Бесконтрольное и зачастую необоснованное применение ряда антибактериальных средств привело к росту региональной резистентности, что нашло отражение в исследованиях по данной проблеме. Сведения об активности различных групп антибиотиков в отношении «главного» возбудителя острого синусита Streptococcus pneumoniae показывают следующее: имеется тенденция к снижению чувствительности к бета-лактамам. Устойчивость к пенициллину в России не превышает 2%, но штаммы с умеренной чувствительностью составляют 10–20%. Бета-лактамы сохраняют полную клиническую эффективность в отношении пенициллин-резистентных пневмококков, но определяется снижение эффективности цефалоспоринов 1–2‑го поколения.
Существует тревожная тенденция – рост устойчивости к макролидам: в Европе – от 8 до 35%, в России – около 12%. Наблюдается крайне высокая резистентность в России к котримоксазолу и тетрациклинам (более 50%), очень низкая активность в отношении ранних фторхинолонов, существенное увеличение частоты резистентных штаммов к этим антибиотикам. Приведенные данные позволяют избежать ошибок при выборе конкретного препарата, например, назначения сульфаниламидов, линкомицина, доксициклина, ципрофлоксацина и других антибактериальных средств, широко применяемых до сих пор на уровне поликлиники. Уменьшение нерационального приема антибиотиков в ряде стран Европейского сообщества за последние годы позволило несколько улучшить ситуацию в отношении уровня резистентности Streptococcus pneumoniae, что проявилось в снижении с 20 до 13% пенициллин-резистентных штаммов данного микроорганизма.
Проблема резистентности в отношении Haemophilus influenzae заключается в следующем: продукция бета-лактамаз в мире составляет от 1 до 40%, в России – не превышает 10%. Практически не отмечено резистентности к аминозащищенным пенициллинам, цефалоспоринам второго-четвертого поколений, фтрохинолонам. Следует обратить внимание на низкую активность цефалоспоринов первого поколения в отношении данного возбудителя.
Спектр значимых возбудителей и характер резистентности в отношении антибактериальных препаратов в настоящее время таковы, что для терапии гнойных синуситов на современном этапе используют В‑лактамы, фторхинолоны и макролиды.
Достаточно высокой эффективностью при лечении синуситов обладают цефалоспорины, которые на протяжении 40 лет занимают ведущие позиции среди антибиотиков. Достоинствами, объясняющими такое долголетие, являются:
- высокая избирательность действия на прокариотическую клетку и связанная с этим безопасность применения у новорожденных и беременных;
- меньший аллергенный потенциал по сравнению с пенициллинами;
- быстрое бактерицидное действие.
Пероральные цефалоспорины 3‑й генерации. Супракс (цефиксим) хорошо зарекомендовал себя как препарат с удобным режимом дозирования (1 раз в сутки), а также высоким уровнем антибактериальной активности по сравнению с цефалоспоринами предыдущих поколений, в отношении пенициллин-резистентных пневмококков, а также β-лактам-устойчивых гемофиллов и моракселл. Достоинством препарата Супракс (цефиксим) является оптимальная фармакокинетика в ЛОР-органах, позволяющая сохранять высокие концентрации действующего вещества в слизистой оболочке околоносовых пазух.
Флюдитек (карбоцистеин) – единственный препарат среди отхаркивающих средств, обладающий одновременно мукорегулирующим и муколитическим эффектами. Препарат нормализует количественное соотношение кислых и нейтральных сиаломуцинов бронхиального секрета, что восстанавливает вязкость и эластичность слизи. Данный эффект достигается за счет фермента сиаловой трансферразы, вырабатываемого бокаловидными железами слизистой оболочки.
На фоне применения препарата восстанавливается секреция IgA, улучшается мукоцилиарный транспорт, происходит регенерация структур слизистой оболочки. Действие препарата распространяется на слизистую оболочку всех отделов дыхательного тракта.
Одновременное назначение карбоцистеина и антибиотиков потенцирует лечебную эффективность последних при воспалительных процессах в области как верхнего, так и нижнего отдела дыхательного тракта. Кроме того, Карбоцистеин взаимно повышает эффективность глюкокортикостероидной терапии, усиливает бронхолитический эффект теофиллина. Активность Карбоцистеина ослабляют противокашлевые и атропиноподобные средства.
Материалы и методы
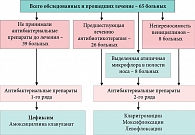
Для подтверждения тезиса о возможности консервативной терапии синуситов нами проведено обследование и лечение 65 больных, страдающих острым или хроническим гайморитом в стадии обострения, диагноз которого устанавливался на основании жалоб, анамнестических данных, результатов оториноларингологического осмотра, лабораторного и инструментального обследования.
Следует отметить, что данная группа была сформирована из больных, отказавшихся от проведения им пункционного метода лечения. Для лечения 39 больных нами была использована следующая схема лечения:
- Супракс (цефиксим) по 400 мг 1 раз в день в течение 10 дней,
- Флюдитек (карбоцестеин) по 750 мг (15 мл сиропа) 3 раза в сутки в течение 10 дней.
Ксилометазолина гидрохлорид 0,1% по 2–3 капли в каждую ноздрю 3 раза в день на протяжении 7 дней.
Распределение больных по полу было приблизительно одинаковым. Среди них было 39 женщин (60%) и 26 мужчин (40%) в возрасте от 18 до 63 лет (39 ± 10,82 лет). Следует отметить, что 67% больных находились в активном трудоспособном возрасте (20–50 лет).
У 45 больных (69,2%) данной группы был диагностирован острый гайморит, из них у 22 больных – двусторонний, у 23 больных – односторонний процесс. У 20 (30,8%) больных отмечалось обострение хронического гайморита, в том числе у 16 больных – двусторонний, у 4 больных – односторонний процесс.
На неэффективность предшествующей амбулаторной антибиотикотерапии указывали 26 (40%) больных. В 6 случаях принимали амоксициллин по 500 мг 2–3 раза в день в течение 7 дней, в 9 случаях – ко-тримоксазол-480 по 2 таблетки 2 раза в сутки в течение 7–9 дней, в 3 случаях – амоксициллин/клавуланат по 375 мг 3 раза в сутки в течение 7–10 дней, в 5 случаях – ципрофлоксацин по 250 мг 2 раза в сутки в течение 5 дней, в 3 случаях – цефазолин внутримышечно по 500 мг 2 раза в сутки в течение 7–9 дней.
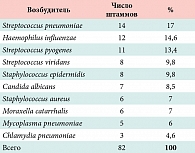
На неэффективность предшествующего пункционного лечения указывали 18 (28,1%) больных. У 60 (92,3%) больных после проведенного микробиологического исследования была выявлена патогенная микрофлора (табл. 1).
Микробные ассоциации отмечены у 20 (30,7%) больных. При проведении сахаринового теста для оценки транспортной функции мерцательного эпителия, у подавляющего числа больных – 56 человек (86%) – выявлено увеличение времени появления сладкого привкуса во рту (>13 мин), что может свидетельствовать о снижении мукоциллиарного клиренса.
У 7 из 65 больных на третьи сутки после начала лечения отсутствовала положительная динамика субъективных и объективных симптомов гайморита. Этим больным дополнительно назначен курс пункционного лечения до получения результатов микробиологического исследования ввиду опасности развития внутричерепных осложнений. 4 из них после получения данных бактериологического исследования была произведена коррекция схемы лечения в соответствии с антибиотикограммой. У 2 больных был выделен золотистый стафилококк, резистентный к большинству антибиотиков. Назначен ципрофлоксацин по 500 мг 2 раза в сутки в течение 5 дней. У 2 больных выявлен также резистентный к большинству антибиотиков эпидермальный стафилококк. Антибиотиком 2‑го ряда стал левофлоксацин по 500 мг 1 раз в сутки в течение 5 дней. У 3 оставшихся больных возбудители не были идентифицированы, назначен антибактериальный препарат 2‑го ряда (Моксифлоксацин в дозировке 500 мг 1 раз в сутки в течение 5 дней). У остальных больных, схема лечения не претерпела каких либо изменений (рис. 1).
В результате проведенного лечения у всех больных отмечена нормализация картины периферической крови, что выражалось в статистически значимом (р<0,01) уменьшении относительного количества лейкоцитов и скорости оседания эритроцитов (рис. 2, 3).
Повторное бактериологическое исследование проводилось на 10‑е сутки после начала лечения, а повторная диагностика методом полиразмерной цепной реакции (ПЦР-диагностика) – на 30‑е сутки после лечения (ввиду того, что на более ранних сроках возможны ложноположительные результаты из-за высокой чувствительности метода) (табл. 2).
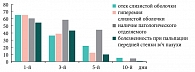
При сравнении показателей риноманометрии, проведенной всем больным до начала лечения и после его окончания, у большинства больных (45–69,2%) отмечено улучшение. Данные изменения статистически достоверны (р<0,01).
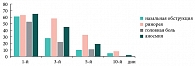
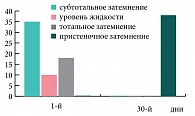
Таким образом, на фоне проводимого лечения с 3‑го дня установлена устойчивая тенденция (р=0,055) к снижению, а к 5‑м суткам значительное уменьшение субъективной и объективной симптоматики гайморита, к 10‑м суткам определялись бактериологическая санация носового секрета (в отношении атипичных возбудителей – к 30‑м суткам) и статистически достоверное улучшение функции мерцательного эпителия (р<0,01). Положительная динамика патологических изменений в пазухах по данным ультразвукового исследования начиналась с 3‑х суток. А к 30‑м суткам у большинства больных результаты рентгенологического и ультразвукового исследований соответствовали норме (рис. 4). Данные изменения были статистически достоверны (р< 0,05).
Клинический пример
Больная К., 44 года, (история болезни № 28385/04) поступила в клинику с жалобами на выделения гнойного характера из обеих половин носа, умеренную заложенность носа с обеих сторон, периодическую головную боль, нарастающую к вечеру, гипосмию.
Длительность заболевания составляла 7 дней, в течение которых больная закапывала сосудосуживающие капли в нос. Обратилась в клинику в связи с отсутствием улучшения состояния. 5 лет назад также по поводу двустороннего острого гайморита больной амбулаторно проводился курс консервативного лечения, включая пункции верхнечелюстных пазух.
При осмотре слизистая оболочка полости носа гиперемирована, средние и нижние носовые раковины сильно увеличены в объеме за счет отека, средний носовой ход значительно сужен, в общем, носовом ходе большое количество слизисто-гнойного отделяемого содержимого.
При обследовании в общем анализе крови отклонений от нормы не выявлено. При эндоскопии полости носа видимых патологических изменений в области остиомеатального комплекса не выявлено. Бактериологическое исследование показало рост Streptococcus pneumoniae (107).
Заключение оториноларинголога: Острый двусторонний гнойный гайморит. Аллергический рино-синусит.
Заключение пульмонолога: скрытая бронхоконстрикция.
Больная принимала Супракс (цефиксим) по 400 мг 1 раз в день в течение 10 дней, Флюдитек (карбоцестеин) по 750 мг (15 мл сиропа) 3 раза в сутки в течение 10 дней. Ксилометазолина гидрохлорид 0,1%-ный по 2–3 капли в каждую ноздрю 3 раза в день на протяжении 7 дней.
Через 2 дня после начала лечения головная боль прекратилась, периоды затрудненного носового дыхания сократились, появились обильные выделения из носа слизисто-гнойного характера. Через 5 дней насморк не прекратился, однако выделения приобрели слизистый характер, значительно уменьшился отек и гиперемия слизистой оболочки, восстановилось обоняние.
За последующие 5 дней слизистая оболочка полости носа приобрела равномерную розовую окраску, полностью исчез ее отек и стали обозримы средние носовые ходы. Сохранялись периодические слизистые выделения из носа.
При повторном бактериологическом исследовании роста микрофлоры выявлено не было. Сахариновое время для правой и левой половин носа уменьшилось соответственно до 17 и 15 мин.
Спустя 30 дней больная жалоб не предъявляла, а риноскопическая картина полностью нормализовалась.
Однако по-прежнему многие практические врачи крайне скептически относятся к попыткам беспункционного лечения гайморита, называя в качестве главного аргумента неизбежную хронизацию процесса при использовании только системной антибактериальной терапии. Ошибочная постановка знака равенства между пункцией и антибактериальной терапией нередко приводит к нежелательным последствиям. В случае консервативного, неинвазивного лечения должна быть найдена альтернатива пункции как дренирующему мероприятию для эвакуации патологического секрета из пазухи, начиная с медикаментозных средств и заканчивая щадящими инструментальными пособиями. А индивидуальный подход к каждому конкретному больному с учетом частой сопутствующей патологии со стороны нижних дыхательных путей позволит в значительной мере оптимизировать результаты лечения и избежать частых обострений и рецидивов со стороны как верхнего, так и нижнего отдела дыхательной системы.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.