Повторное применение ингибиторов контрольных точек иммунного ответа у пациентов с метастатической меланомой кожи: обзор литературы и клинический пример
- Аннотация
- Статья
- Ссылки
- English
Наш обзор литературы и клиническая иллюстрация как раз и адресованы одной из таких ситуаций. Уместно ли повторное применение ИКТИ, эффективна ли и безопасна ли такая тактика для пациентов с приобретенной резистентностью или ранней непереносимостью ИКТИ?
Наш обзор литературы и клиническая иллюстрация как раз и адресованы одной из таких ситуаций. Уместно ли повторное применение ИКТИ, эффективна ли и безопасна ли такая тактика для пациентов с приобретенной резистентностью или ранней непереносимостью ИКТИ?





Введение
Ингибиторы контрольных точек иммунитета (ИКТИ) заняли прочное место в терапии пациентов с метастатической меланомой. Сегодня при лечении пациента с метастатической меланомой блокаторы PD-1 (ниволумаб, пембролизумаб, а в России также и пролголимаб) играют важнейшую роль. Медицинское и пациентское сообщества, пожалуй, единодушны в том, что наилучшие шансы на излечение от метастатической меланомы связаны с применением именно этого класса препаратов.
Если обратиться к данным клинических исследований, которые к настоящему моменту имеют достаточный период наблюдения (CheckMate 067, CheckMate 066, KEYNOTE-001, KEYNOTE-006, DreamSeq и MIRACULUM [1–6]), можно отметить вполне закономерную тенденцию. Применение ИКТИ (особенно комбинации aнти-PD-1 + aнти-CTLA-4 (aPD1 + aCTLA4) – ипилимумаба и ниволумаба) как можно раньше после выявления метастатической болезни приводит к невероятным до сегодняшнего дня результатам лечения: пациенты с метастатической меланомой, прежде в половине случаев не переживавшие и одного года, могут жить более шести или семи лет. Этот срок ограничен, пожалуй, только периодом наблюдения в рамках исследования. Впервые в истории клинических исследований с участием пациентов с метастатической меланомой меланома-специфическая выживаемость (то есть шансы умереть от прогрессирования меланомы) стала важным показателем, потеснив немного общую выживаемость (ОВ) [1]. Так, при анализе 7,5-летних результатов в исследовании CheckMate 067 ОВ составила 48% в группе комбинированной иммунотерапии ниволумабом и ипилимумабом и 42% в группе ниволумаба, в то время как меланома-специфическая выживаемость составила 55 и 47% соответственно [1].
В ходе данных исследований было показано, что именно глубина ответа на лечение (полные ответы (ПО) vs частичные ответы (ЧО) vs стабилизация болезни (СБ) vs прогрессирование болезни (ПБ)) становится самым важным предиктором его длительности и шанса на излечение.
К сожалению, глубокие (полные или частичные ответы) встречаются не слишком часто: приблизительно у 40% пациентов на фоне монотерапии блокаторами aPD1 и у 60% пациентов, получающих комбинированную терапию aPD1 + aCTLA4 [1–6], а первичная резистентность, особенно при отсутствии драйверных мутаций в опухоли, обнуляет все открытия фармакологии прошлого десятилетия и по сути подталкивает их к применению малоэффективных цитостатиков в качестве жеста отчаяния.
Но те же пациенты, которые по все более понятным причинам хорошо отвечают на проводимую иммунотерапию (болезнь у них отступает или исчезает), оказываются перед выбором: продолжать начатую несколько месяцев назад терапию (как правило, отлично переносимую) или же делать «лекарственные каникулы».
При проведении противоопухолевого лечения по поводу других солидных опухолей «лекарственные каникулы», как правило, являются вынужденной мерой, так как мало кто из живущих людей сможет безопасно и длительно получать цитостатики.
Но в случае с ИКТИ подавляющее большинство нежелательных явлений (НЯ) происходит в первые несколько месяцев терапии (именно в этот срок реализуется и большинство противоопухолевых эффектов), а далее у большинства пациентов терапия не приносит существенного вреда.
С другой стороны, предполагаемый механизм действия этого революционного класса лекарственных препаратов, отмеченный Нобелевской премией в 2018 г., рассчитывает на то, что лекарством становятся собственные иммунные клетки пациента. А раз они уже справились с опухолью, следует ли продолжать лекарственную стимуляцию [7]?
После публикации первых результатов и при меньшем периоде наблюдения казалось, что пациенты, глубоко ответившие на иммунотерапию в первые несколько месяцев, надежно защищены от возврата болезни, а лекарства можно даже полностью отменить спустя некоторое время (например, так было в исследовании KEYNOTE-006). Нельзя не отметить, что данные результаты в целом хорошо воспроизводятся и в реальной клинической практике с намного более разнообразной популяцией пациентов в контексте распространенности заболевания, коморбидности и нерегулярности доступа к препаратам [8].
Однако по мере увеличения периода наблюдения число случаев приобретенной резистентности стало вполне осязаемым: приблизительно у 15–20% пациентов с полным ответом на монотерапию aPD1 и до 35–40% у пациентов с частичным ответом на монотерапию aPD1 прогрессирование болезни развивалось спустя 3–7 лет [6].
Естественно, при наличии активирующей мутации в гене BRAF пациенты могут быть переведены на эффективную терапию ингибиторами BRAF и MEK, которая будет поддерживать как минимум половину из них не менее 12 месяцев [4, 9].
У другой части пациентов иммунотерапия может быть прервана в более ранние сроки (как правило, еще до оценки противоопухолевого эффекта) из-за развития НЯ. Такие пациенты также могут получить пользу от комбинированной таргетной терапии и примерно в половине случаев в те же сроки (через 12 месяцев) вновь окажутся в ситуации выбора следующей линии терапии.
Развитие глубоких ответов на фоне ИКТИ и резистентность
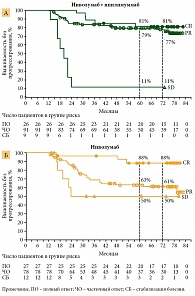
C. Robert и соавт. в 2020 г. представили анализ пациентов, достигших ПО, получающих ниволумаб в комбинации c ипилимумабом или монотерапию ниволумабом в исследованиях CheckMate 067 и 066. Минимальное время наблюдения после рандомизации последнего пациента в каждое исследование составило 60 месяцев; объединенная из двух исследований медиана периода наблюдения составила 63 месяца для группы ипилимумаба с ниволумабом (n = 409) и 64 месяца для группы ниволумаба (n = 526) [2]. Полный ответ был зарегистрирован у 96 (23%) пациентов в группе комбинированной иммунотерапии и у 102 (19%) пациентов в группе ниволумаба. Среди пациентов, которые были живы через пять лет, ПО сохранялся у 75/79 (95%) и 85/91 (93%) между группами соответственно, и пациенты не получали последующей терапии. Исходные характеристики, которые в значительной степени были связаны с ПО: первоначально нормальный уровень лактатдегидрогеназы (ЛДГ) и меньшее число органов с метастазами – меньшая опухолевая нагрузка (оба варианта лечения); М-подстадия M0–M1b IV стадии заболевания (для группы комбинированной иммунотерапии); PD-L1 ≥ 5% при иммуногистохимическом исследовании (монотерапия ниволумабом). Медиана продолжительности ПО и медиана времени до последующей системной терапии не были достигнуты ни в одной из групп. Медиана времени до ПО составила 9,1 месяца (2,8–23,1) для комбинированной иммунотерапии и 11,8 месяца (5,8–26,5) для монотерапии аPD1. У пациентов с ПО, который развился в срок 12 месяцев, пятилетняя ОВ составила 85 и 86%; выживаемость без прогрессирования (ВБП) составила 84 и 82% соответственно по группам.
Как было показано в исследовании CheckMate 067 и представлено на рис. 1, пациенты, достигшие полного ответа на фоне комбинированной иммунотерапии или на фоне монотерапии аPD1, лучше защищены от прогрессирования, но не на 100%. И, несмотря на высокие результаты ВБП, приблизительно у 15–20% пациентов с полным ответом на монотерапию aPD1 и 35–40% пациентов с частичным ответом на монотерапию aPD1 прогрессирование болезни развивалось спустя 3–7 лет.
Еще одним исследованием, оценивающим роль монотерапии аPD1 в лечении пациентов с метастатической и/или неоперабельной меланомой, является исследование KEYNOTE-006. Основной отличительной особенностью данного исследования было то, что лечение монотерапией аPD1 (в данном случае пембролизумабом) ограничивалось двумя годами терапии с последующей остановкой лечения вне зависимости от ответа, а также возможностью включения пациентов, которые ранее получали одну линию терапии (это в основном касалось пациентов с мутацией в гене BRAF, получавших в качестве терапии первой линии ингибиторы BRAF/MEK) [10]. В исследование были включены 834 пациента в группу пембролизумаба (каждые две недели, n = 279; каждые три недели, n = 277) или группу ипилимумаба (n = 278). В течение двух лет 103 (19%) из 556 пациентов завершили лечение пембролизумабом, из которых 21 (20%) пациент достиг ПО, 69 (67%) – ЧО и 13 (13%) – СБ. Ответы сохраняются у 16 (76%) из 21 пациента с ПО, у 53 (77%) из 69 пациентов с ЧО и у 7 (54%) из 13 пациентов с СБ. У 8 (8%) пациентов с ЧО зарегистрирован ПО после прекращения терапии пембролизумабом.
Также в рамках данного исследования допускалось завершать терапию в случае развития ПО раньше окончания двухлетнего периода лечения. И были 23 пациента с ПО, которые завершили лечение по протоколу раньше двух лет (получали по крайней мере шесть месяцев терапии пембролизумабом и две дополнительные дозы после первого исследования, где ПО был зарегистрирован). Двухлетняя ВБП составила 86,4% (95% доверительный интервал (ДИ) 63,4–95,4), что сопоставимо с данными для пациентов с ПО, завершивших двухгодичный курс терапии пембролизумабом. После медианы наблюдения 34,2 месяца и завершения терапии пембролизумабом расчетная двухлетняя ВБП от момента завершения терапии пембролизумабом составила 78,4% (95% ДИ 68,3–85,6) для всех 103 пациентов и 85,4% (95% ДИ 61,3–95,1) для пациентов с ПО, 82,3% (95% ДИ 70,3–89,8) для пациентов с ЧО и 39,9% (95% ДИ 8,1–71,4) для пациентов с СБ. По цифрам ВБП в зависимости от ответа мы видим четкую связь: чем глубже и лучше ответ, тем больше шансы на стойкую ремиссию.
Несмотря на высокие показатели ВБП и ОВ, у четверти пациентов развивается прогрессирование заболевания в последующем даже при достижении исходно объективного ответа. Анализ 103 пациентов, завершивших двухгодичный курс терапии пембролизумабом, продемонстрировал, что 76 (74%) остаются без признаков прогрессирования заболевания, а у 27 (26%) развивается прогрессирование болезни с медианой времени до прогрессирования 33,3 месяца от момента окончания терапии пембролизумабом [10].
Исследование II фазы с российским оригинальным анти-PD-1-ингибитором пролголимабом (MIRACULUM) включало пациентов c метастатической и/или неоперабельной меланомой вне зависимости от мутации в гене BRAF (допускалось включение пациентов с некожными формами меланомы, а также использование ингибиторов BRAF/MEK в качестве терапии первой линии) [5]. Частота объективного ответа (ЧОО) составила 38%, трехлетняя ОВ – 57,1% для всех включенных в исследование пациентов. При анализе пациентов первой линии терапии при меланоме кожи ЧОО составляет 49% [5]. Исследование MIRACULUM было рассчитано на 12 месяцев терапии, и далее по решению исследователя пациенты, которым, по мнению врача, требовалось продолжение терапии, могли продолжить получать пролголимаб в рамках продленной фазы исследования (Ext) столько, сколько это было необходимо по мнению исследователя. Примерно у 75% пациентов с объективным ответом он сохраняется при сроке наблюдения два года.
Повторное использование ИКТИ у пациентов с меланомой
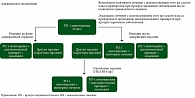
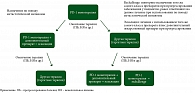
С. Gebhardt и соавт. в 2020 г. опубликовали статью, касающуюся общей терминологии, которую целесообразно использовать в дальнейшем для лучшего понимания и интерпретации того, что происходит с пациентом в зависимости от сроков прогрессирования и варианта терапии [12]. Термины rechallenge и retreatment были разделены, и были даны определения. Rechallenge – повторное применение препаратов того же самого терапевтического класса после прогрессирования заболевания у пациентов, у которых ранее было зарегистрировано клиническое улучшение или ответ при использовании по поводу неоперабельной/метастатической меланомы. Retreatment – повторное лечение с использованием препаратов того же самого терапевтического класса при рецидиве/прогрессировании заболевания после завершения курса адъювантной терапии. В 2021 г. Schadendorf и соавт. более подробно описали сценарии rechallenge и retreatment применительно к иммунотерапии ингибиторами контрольных точек при меланоме (рис. 2, 3) [13]. Среди пациентов с метастатической меланомой при лечении ИКТИ возможно выделить два типа: с первичной нечувствительностью опухоли к проводимой терапии и с приобретенной со временем резистентностью после ответа на проводимое лечение. Термин rechallenge (повторное назначение) более применим ко второму сценарию.
Одним из основных исследований, позволяющих четко провести анализ возможности повторного назначения аPD1, является исследование KEYNOTE-006: в соответствии с протоколом после двух лет терапии вне зависимости от достигнутого ответа лечение aPD1 (пембролизумабом) прекращали, а в случае, если позднее в ходе дальнейшего наблюдения развивалось прогрессирование заболевания, допускался повторный курс терапии пембролизумабом. В 2020 г. на конференции American Society of Clinical Oncology (ASCO) были представлены обновленные результаты, включая оценку 15 пациентов, которые получили повторный курс терапии. Наилучший ответ при первом назначении составил: ПО – шесть пациентов, ЧО – шесть пациентов, СБ – три пациента. Медиана времени от окончания первой линии терапии пембролизумабом до повторного назначения составила 24,5 месяца (4,9–41,4 месяца). Медиана наблюдения за пациентами, получившими повторное назначение пембролизумаба, составила 8,3 месяца (1,4–12,6 месяца). Наилучший ответ при повторном назначении пембролизумаба составил: ПО – три пациента, ЧО – пять пациентов (у семи пациентов ответы продолжаются), СБ – три пациента (два ответа продолжаются), и у двух пациентов зарегистрировано ПБ (один летальный исход); у двух пациентов ответ на момент публикации еще не оценен. Авторы делают вывод о том, что возможно повторное назначение того же самого лечения у пациентов, у которых ранее наблюдался объективный ответ или стабилизация заболевания [13].
Одно из крупных ретроспективных одноцентровых исследований, оценивающее роль повторного назначения аPD1 у пациентов с меланомой, было опубликовано A.B. Warner и соавт. в 2020 г. В данной работе коллеги из Memorial Sloan Kettering проанализировали исходы терапии у 396 пациентов, которые прекратили монотерапию aPD1 по разным причинам. У 102 (25,8%) был ранее зарегистрирован полный ответ на терапию тем или иным способом. При дальнейшем наблюдении 78 пациентам из 396, у которых было отмечено прогрессирование заболевания, повторно назначали ИКТИ: монотерапия аPD1 была назначена 34 (45,6%) пациентам, а комбинация аPD1 с аCTLA4 (ипилимумабом) – 44 (56,4%) пациентам. Эффективность повторного назначения аPD1 составила 14,7% (пятеро из 34 пациентов достигли объективного ответа, включая два полных ответа). Эффективность повторного назначения аPD1 с эскалацией и добавлением ипилимумаба составила 25% (11 из 44 пациентов достигли объективного ответа, включая три полных ответа). Взаимосвязь между достигнутым объективным ответом при первом использовании аPD1 и при повторном назначении в данной работе оценена не была [14]. Интересно, что только двое из десяти пациентов, которые при первом применении имели полный ответ на лечение, ответили на повторное применение ИКТИ.
Средняя продолжительность повторного курса терапии составила 1,6 месяца (диапазон < 1,0–28,3 месяца). Предполагаемая медиана ОВ для всех 78 пациентов, прошедших повторное лечение, с начала повторного лечения составила 9,9 месяца (95% ДИ 6,8–17,9 месяца); двухлетняя ОВ составила 37,6% (95% ДИ 25,5%–49,7%), что несопоставимо меньше в сравнении с эффектом терапии при первом применении [14].
В 2021 г. был опубликован систематический обзор и мета-анализ данных повторного назначения ИКТИ при различных злокачественных новообразованиях [15]. Результаты отличались в зависимости от причин прекращения терапии ранее. Так, в подгруппе пациентов, которые ранее завершили лечение по поводу прогрессирования заболевания, ЧОО составила 15,2%, медиана ВБП –
2,9 месяца, медиана ОВ – 7,9 месяца. В подгруппе пациентов, которые завершили терапию по причине развития нежелательных явлений, ЧОО составила 44% с медианой ВБП 13,2 месяца. Следует также отметить, что приобретенная резистентность к ИКТИ, судя по всему, является серьезной клинической проблемой, которая хотя и встречается существенно реже, чем первичная резистентность, но по мере накопления популяции пациентов, получивших пользу от ИКТИ, может потребовать новых клинических подходов, например применения блокаторов новых контрольных точек [16] или клеточной терапии [17].
Но поскольку такие клинические подходы пока не слишком близки к реальной клинической практике, повторное назначение ИКТИ у пациентов, ранее ответивших на иммунотерапию, может быть вполне успешным.
Приводим клинический пример повторного назначения монотерапии аPD1 пролголимабом у пациента с метастатической и/или неоперабельной меланомой.
Клинический случай
Пациент, 1950 г.р., мужчина. Последнее обращение на консультацию в апреле 2022 г. в связи с прогрессированием меланомы кожи спины. Сопутствующая патология представлена сердечно-сосудистыми заболеваниями: пароксизмальная форма фибрилляции предсердий, по поводу которой пациенту установлен искусственный водитель сердечного ритма в 2015 г., а также контролируемая гипертоническая болезнь. Пациент получает лекарственную терапию.
Из анамнеза известно, что в октябре 2016 г. пациенту было выполнено хирургическое лечение – иссечение меланомы кожи спины и установлена стадия на основании морфологического исследования первичной опухоли – T4bN0M0, IIC. В связи с высоким риском прогрессирования заболевания при данной стадии с октября 2016 г. по февраль 2017 г. пациент получал адъювантную терапию интерфероном, которая была прекращена в связи с локорегионарным прогрессированием в подмышечные лимфоузлы слева. В феврале 2017 г. выполнено хирургическое лечение в объеме подмышечной лимфаденэктомии слева. По данным молекулярно-генетического тестирования, в опухоли не было выявлено мутации в гене BRAF. Далее пациент наблюдался до декабря 2017 г., когда было диагностировано прогрессирование заболевания: метастазы в забрюшинные лимфоузлы, единичный метастаз в мягкие ткани спины. Уровень ЛДГ был в норме от декабря 2017 г.
В связи с прогрессированием заболевания, метастатической формой, что соответствует М1а подстадии IV стадии – поражению мягких тканей и отдаленных лимфатических узлов, при нормальном уровне ЛДГ, пациенту была начата иммунотерапия аPD1-препаратом пролголимабом в рамках клинического исследования II фазы MIRACULUM. Пациент получал лечение пролголимабом в дозе 3 мг/кг внутривенно каждые 14 дней с декабря 2017 г. по декабрь 2019 г.
На фоне лечения у пациента развились следующие НЯ: гипертиреоз 1-й степени с января по февраль 2018 г., гипотиреоз 2-й степени с января 2019 г., по поводу которого пациент начал получать заместительную терапию левотироксином. Заместительная терапия продолжалась до 2021 г., далее терапия была отменена под контролем эндокринолога и регулярного мониторинга гормонов щитовидной железы (не обнаружено отклонений при обследованиях после отмены левотироксина). В декабря 2018 г. у пациента развилась надпочечниковая недостаточность 2-й степени, по поводу нее была назначена заместительная терапия, которую пациент принимает по настоящее время. Других НЯ не отмечено.
Также у пациента в 2018 г. был зафиксирован пароксизм фибрилляции предсердий, связанный с сопутствующей патологией и купированный медикаментозно.
Одновременно с началом иммунотерапии у пациента в январе 2018 г. была диагностирована меланома кожи теменной области, по поводу которой выполнено хирургическое лечение – иссечение меланомы кожи теменной области, pT2aN0M0, IB.
Уже при первом обследовании спустя лишь три месяца от начала иммунотерапии аPD1 пролголимабом в марте 2018 г. у пациента был зафиксирован частичный ответ, который перешел в полный ответ, по данным обследования в январе 2019 г. Таким образом, у пациента спустя год лечения наступил полный ответ. Терапия была продолжена два года.
С декабря 2019 г. пациент перешел под динамическое наблюдение при сохранном качестве жизни и без дальнейшей противоопухолевой терапии до апреля 2022 г., когда при очередном контрольном обследовании было выявлено прогрессирование заболевания.
На момент обращения в апреле 2022 г. у пациента выявлены метастазы в мезентериальные лимфоузлы в виде конгломерата размерами 37 × 25 мм, SUVmax 23,26 и мягкотканный метастаз в малом тазу над семенными пузырьками размерами 49 × 39 × 46 мм без накопления SUV, по данным позитронно-эмиссионной и компьютерной томографии (ПЭТ/КТ) от 26.04.2022 (рис. 4).
13.05.2022 выполнена core-биопсия конгломерата лимфоузлов. По результатам морфологического исследования верифицирован метастаз меланомы. Уровень ЛДГ был в норме от апреля 2022 г. Таким образом, у пациента в настоящее время эквивалент IV стадии заболевании, М1а(0) подстадии – метастатическое поражение мягких тканей и отдаленных лимфоузлов с нормальным уровнем ЛДГ.
С учетом ранее достигнутого полного ответа на фоне первой линии иммунотерапии аPD1, удовлетворительной переносимости терапии, длительного периода без лечения (более двух лет), отсутствия мутации в гене BRAF было принято решение о повторном назначении иммунотерапии аPD1 пролголимабом.
С 26.05.2022 начата терапия пролголимабом в рамках рутинной практики в зарегистрированной дозе 1 мг/кг каждые 14 дней в/в капельно. На фоне лечения не было отмечено НЯ. Мониторинг гормонов щитовидной железы (ТТГ, Т3св, Т4св) проводится ежемесячно, отклонений в показателях не выявлено.
Уже при первом контрольном обследовании от 22.08.2022 (рис. 5) на фоне повторного назначения иммунотерапии у пациента был зафиксирован частичный ответ по критериям RECIST 1.1 (таблица).
С учетом ответа лечение было продолжено. При последующем обследовании от 17.11.2022 (рис. 6) был зафиксирован полный ответ по критериям RECIST 1.1 (см. таблицу).
Таким образом, спустя полгода лечения у пациента повторно наступил полный ответ на фоне иммунотерапии аPD1.
В настоящий момент пациент продолжает получать лечение пролголимабом (суммарно год от начала терапии), переносит лечение удовлетворительно. При последнем обследовании от 14.02.2023 (рис. 7) сохраняется полный ответ. Планируется проведение контрольного обследования в ближайшее время.
Выводы
На сегодняшний день нет данных проспективных исследований, позволяющих оценить роль повторного назначения при различных клинических сценариях: при прогрессировании на фоне терапии или после ее окончания, при развитии НЯ и др. Имеющиеся данные демонстрируют возможность использовать повторно ИКТИ как возможную стратегию лечения у некоторых пациентов с метастатической и/или неоперабельной меланомой, в первую очередь у пациентов, прекративших лечение аPD1 без признаков прогрессирования заболевания.
K.V. Orlova, PhD, A.E. Akhmetianova, I.V. Samoylenko, PhD, S.A. Tyulyandin, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Kristina V. Orlova, krisman03@gmail.com
The prognosis of patients with metastatic and/or unresectable melanoma has changed dramatically over the past decade. When using modern medications (immune checkpoint inhibitors and BRAF/MEK inhibitors), more than 50% of patients survive 6.5 years. The use of immune checkpoint inhibitors (anti-PD-1 monotherapy) as the first line of therapy reduces the risk of progression or death by 60% (5-year progression-free survival in the nivolumab group was 28%, and in the dacarbazine group 3%, OR 0.4, 95% CI: 0.33–0.54; p = 0.0001) in the CheckMate 066 study. Despite the high results of anti-PD-1 monotherapy and overall survival, approximately 15–20% of patients with a complete response to aPD1 monotherapy and up to 35–40% of patients with a partial response to aPD1 monotherapy developed disease progression after 3–7 years.
If there is an activating mutation in the BRAF gene, patients can be prescribed effective therapy with BRAF and MEK inhibitors, which will support at least half of them for at least 12 months. In another part of patients, immunotherapy may be interrupted at an earlier date (usually even before the antitumor effect is assessed) due to the development of adverse events. And such patients can also benefit from combined targeted therapy and in about half of the cases, in the same time frame (about 12 months), they will again find themselves in the situation of choosing the next line of therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.