Предиабет: современное состояние проблемы и клинические рекомендации
- Аннотация
- Статья
- Ссылки
- English
С учетом постоянного роста числа новых случаев нарушений углеводного обмена крайне важным является своевременная их диагностика, особенно на ранних этапах.
Работы конца XX – начала XXI в. по профилактике СД 2 типа на предиабетических стадиях обнадеживают. Поэтому необходимо как можно шире использовать полученный опыт в клинической практике.
В статье рассмотрены группы риска развития СД 2 типа, методы диагностики нарушений углеводного обмена и терапевтические подходы, применяемые на стадии предиабета для профилактики прогрессирования нарушений углеводного обмена.
С учетом постоянного роста числа новых случаев нарушений углеводного обмена крайне важным является своевременная их диагностика, особенно на ранних этапах.
Работы конца XX – начала XXI в. по профилактике СД 2 типа на предиабетических стадиях обнадеживают. Поэтому необходимо как можно шире использовать полученный опыт в клинической практике.
В статье рассмотрены группы риска развития СД 2 типа, методы диагностики нарушений углеводного обмена и терапевтические подходы, применяемые на стадии предиабета для профилактики прогрессирования нарушений углеводного обмена.



Нарушения углеводного обмена и, конечно, сахарный диабет (СД) являются одними из частых во врачебной практике и требуют незамедлительных действий со стороны специалистов.
Ранние стадии этих нарушений объединены под общим понятием «предиабет» и в основном обсуждаются в контексте развития СД 2 типа [1]. К предиабету относят любые нарушения углеводного обмена, такие как нарушенная гликемия натощак (НГН) и/или нарушенная толерантность к глюкозе (НТГ) [2].
В опубликованном в 2021 г. десятом издании атласа Международной диабетической федерации отмечается, что общее количество больных СД в возрастной группе 20–79 лет составляет 537 млн, или 10,5% населения, при этом прирост идет опережающими прогнозы темпами. Пациентов с НТГ насчитывается уже 541 млн, с НГН – 319 млн, что составляет почти 17,0% населения. Это принципиально важно, так как кумулятивный прогресс НГН и НТГ в СД 2 типа в пятилетней перспективе составляет 26 и 50% соответственно [1].
В Российской Федерации периодически проводятся как локальные, так и масштабные эпидемиологические исследования по выявлению нарушений углеводного обмена. Последнее крупное исследование NATION состоялось в середине прошлого десятилетия.
NATION – первое национальное эпидемиологическое кросс-секционное исследование распространенности СД 2 типа на территории Российской Федерации. В ходе исследования обнаружено, что ранние нарушения углеводного обмена, такие как НТГ и НГН, зафиксированы у 20,7 млн (19,3%) лиц в возрасте 20–79 лет [3]. Исследование NATION не ставило задачу дифференцировки ранних нарушений углеводного обмена. Однако, согласно данным российского регистра СД, а также международной статистики, большую часть состояния, называемого предиабетом, составляет НТГ. Это важно, так как в различных исследованиях показано, что именно НТГ является первым нарушением углеводного обмена, лица с НТГ быстрее переходят в группу больных СД 2 типа. Более того, согласно данным исследования DECODE, в котором были представлены результаты десяти европейских когортных исследований с более 22 тыс. участников, именно среди пациентов с НТГ регистрировалась повышенная смертность. Корреляция между изменением уровня глюкозы плазмы натощак и частотой смерти отсутствовала [4].
В связи со сказанным выше предиабет, особенно НТГ, представляет важную медико-экономическую проблему для медицинского сообщества.
На сегодняшний день продолжаются попытки более детального изучения патогенеза ранних нарушений углеводного обмена. Большое значение придается избыточному весу, висцеральному ожирению и резистентности тканей к инсулину. Так, нарушения углеводного обмена встречаются более чем у половины пациентов с ожирением.
В современном мире ожирение стало одной из наиболее важных медицинских и социальных проблем, требующих значительных материальных затрат на лечение ассоциированных с ним заболеваний. Распространенность избыточной массы тела и ожирения в Российской Федерации составляет 59,2 и 24,1% соответственно.
Согласно данным седьмого доклада Организации Объединенных Наций, в 2013 г. Российская Федерация занимала 19-е место в мире по распространенности ожирения. Исходя из данных многоцентрового (охватившего 11 регионов России) наблюдательного исследования ЭССЕ-РФ, в котором приняли участие 25 224 человека в возрасте 25–64 лет, встречаемость ожирения в популяции составила 29,7%.
Ожирение признано важнейшим фактором риска развития сердечно-сосудистых заболеваний (ССЗ) и СД 2 типа. Так, эксперты Всемирной организации здравоохранения отмечают, что избыточная масса тела и ожирение лежат в основе развития 44–57% случаев СД 2 типа. Значительно выше вероятность возникновения сахарного диабета у лиц с ожирением и НТГ. Ежегодная конверсия НТГ в СД наблюдается у 5–10% пациентов, в течение пяти лет – у 20–34%, при сочетании НГН и НТГ – у 38–65% [5].
Накопленные данные свидетельствуют, что предиабет значимо повышает риск развития не только сахарного диабета, но и ССЗ на всех этапах сердечно-сосудистого континуума – от эндотелиальной дисфункции до сердечной недостаточности [6].
В ходе 14-летнего наблюдения за 11 057 лицами, исходно не имевшими СД 2 типа, установлено увеличение риска развития сердечной недостаточности на 40% при предиабетическом уровне HbA1c от 6,0 до 6,5% по сравнению с нормогликемией [7].
Приведенные данные свидетельствуют о том, что предиабет индуцирует развитие серьезных заболеваний и состояний, значительно ухудшающих качество жизни и прогноз больных.
Факторы риска и подходы к скринингу на наличие нарушений углеводного обмена
Эпидемиологические исследования в разных странах, в том числе российское исследование NATION, выявили прямую корреляцию нарушений углеводного обмена с возрастом, индексом массы тела (ИМТ), малоподвижным образом жизни, артериальной гипертензией [3]. Это позволило определить группу и основные факторы риска развития СД 2 типа. В первую очередь речь идет о возрастной группе старше 45 лет с избыточной массой тела или ожирением. К факторам риска относятся отягощенный семейный анамнез, низкая физическая активность, гестационный СД или рождение крупного плода в анамнезе, артериальная гипертензия (≥ 140/90 мм рт. ст. или медикаментозная антигипертензивная терапия), уровень холестерина липопротеинов высокой плотности ≤ 0,9 ммоль/л и/или уровень триглицеридов ≥ 2,82 ммоль/л, синдром поликистозных яичников, наличие черного акантоза.
Кроме того, НГН и/или НТГ являются самостоятельными и очень важными факторами риска развития СД 2 типа.
Таким образом, скрининг с целью выявления ранних нарушений углеводного обмена, таких как НГН и НТГ, должны проходить все лица старше 45 лет, а также пациенты любого возраста с избыточной массой тела и одним из факторов риска [2].
В связи со сказанным отдельно стоит остановиться на метаболическом синдроме. Данный термин был предложен для выделения категории лиц с повышенным риском развития ССЗ и СД 2 типа. Доказано, что пациенты с метаболическим синдромом подвержены двукратному риску развития ССЗ и пятикратному риску развития СД 2 типа.
Метаболический синдром, описанный G.M. Reaven в 1988 г. и активно обсуждаемый в последние десятилетия, включает в себя такие параметры, как ожирение по абдоминальному типу (окружность талии у женщин более 80 см, у мужчин более 94 см), артериальная гипертензия, дислипидемия с повышением уровня триглицеридов более 1,7 ммоль/л, холестерина липопротеидов низкой плотности более 3 ммоль/л и снижением уровня липопротеинов высокой плотности (менее 1,2 ммоль/л у женщин и менее 1,0 ммоль/л у мужчин), нарушение углеводного обмена.
Несмотря на то что в определении метаболического синдрома отсутствуют такие важные параметры, как курение, пол, возраст, состояние не является самостоятельным диагнозом, а некоторые исследователи вообще оспаривают его как полезный клинический критерий, активный поиск нарушений углеводного обмена целесообразен у пациентов с абдоминальным ожирением и одним или двумя дополнительными признаками метаболического синдрома [8].
Критерии диагностики предиабета
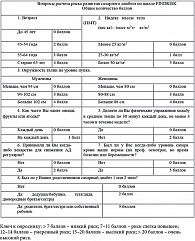
Эксперты Российской ассоциации эндокринологов (РАЭ) определили критерии для постановки диагноза «предиабет» (табл. 1) [2]. Для более четкого выделения групп риска развития предиабета и СД рекомендован специальный опросник (рис. 1). В таблице 2 представлены возрастные группы, факторы риска и частота скрининговых мероприятий.
Подтверждением НТГ служат результаты перорального глюкозотолерантного теста (ПГТТ). Стандартизованный ПГТТ проводится утром после 8–14-часового голодания. Кровь берется до теста и через 120 минут после приема в течение пяти минут 75 г глюкозы, растворенной в 250–300 мл воды. Началом теста считается первый глоток. Для исследования используется плазма венозной крови [2].
Отдельно необходимо отметить определение уровня гликированного гемоглобина (HbA1c) для оценки нарушений углеводного обмена. На текущий момент времени данный показатель еще остается среди диагностических критериев. Однако в 2022 г. эксперты Американской диабетической ассоциации (American Diabetes Association – ADA) уже исключили его из рекомендаций для диагностики, оставив только для скрининга и оценки эффективности сахароснижающей терапии.
Необходимо также подчеркнуть разницу в референсном диапазоне для HbA1c. Более строгие значения для предиабета, принятые в США (HbA1c от 5,7 до 6,4%), связаны с более строгими нормальными значениями гликемии натощак (до 5,6 ммоль/л).
Соответствие гликемии и гликированного гемоглобина по-прежнему достаточно широко обсуждается. В ряде публикаций отмечены существенные различия между показателями HbA1c и данными ПГТТ для диагностики предиабета и диабета, особенно при избыточной массе тела. Таким образом, все приведенные критерии ранних нарушений углеводного обмена требуют дальнейших исследований для оптимизации и унификации диагностики ранней гипергликемии.
В настоящее время эксперты РАЭ рекомендуют использовать ПГТТ в качестве основного метода выявления НТГ и НГН [2].
Патогенез
Соотношение двух ведущих компонентов патогенеза, таких как инсулинорезистентность и дисфункция островкового аппарата, лежит в основе запуска ранних нарушений углеводного обмена. Инсулинорезистентность – это снижение способности инсулина оказывать биологические эффекты. Она обусловлена многими факторами, такими как малоподвижный образ жизни, ожирение, гиперлипидемия.
Именно висцеральный тип ожирения способствует развитию инсулинорезистентности. Для висцерального жира характерны низкая чувствительность к антилиполитическому действию инсулина и повышенная чувствительность к липолитическому действию катехоламинов. Поэтому при данном типе ожирения усилен липолиз, в результате чего образуется большое количество свободных жирных кислот, которые препятствуют нормальному связыванию инсулина с гепатоцитами, устраняют его ингибирующее влияние на продукцию глюкозы в печени и ухудшают утилизацию глюкозы в мышцах. Свободные жирные кислоты также вызывают продукцию активных форм кислорода, которые блокируют работу субстрата инсулинового рецептора 1 и сигнального пути PI3K-Akt рецепторов к инсулину, приводя к снижению активности глюкозного транспортера 4. Кроме того, среди механизмов инсулинорезистентности выделяют пострецепторные дефекты в виде недостаточности активации ферментных систем и белковых структур, передающих сигналы инсулина или участвующих в транспорте глюкозы внутрь клетки.
Длительное время инсулинорезистентность компенсируется гиперинсулинемией. Продолжительное функциональное напряжение β-клеток обусловливает нарушение секреции инсулина с изменением его плазменного уровня. Секреторная функция β-клеток может изменяться по ряду причин, среди которых наиболее значимыми являются глюкозотоксичность (отрицательное влияние длительной гипергликемии, приводящей к снижению секреторного ответа β-клеток на повышение уровня глюкозы в крови), липотоксичность (отрицательное влияние избыточного содержания в крови свободных жирных кислот), повышение в β-клетках синтеза и агрегации амилина, играющего регуляторно-ингибирующую роль в секреции инсулина, снижение количества глюкозного транспортера 2, который является единственным транспортером глюкозы в β-клетках [9].
Еще одним важным патогенетическим звеном ранних нарушений углеводного обмена и СД 2 типа является дефект инкретиновой системы. У здоровых лиц инкретины отвечают за 50–70% секреции инсулина после употребления глюкозы, что указывает на их важное физиологическое значение в поддержании нормогликемии.
Наиболее изученные сегодня инкретины – глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид 1 (ГПП-1). Они способны усиливать секрецию инсулина и снижать уровень глюкозы в крови. На сегодняшний день активно обсуждаются их системные эффекты. Так, в последнее время инкретинам отводится особая роль в развитии ожирения.
Гормоны инкретинового ряда, являясь звеньями одной системы, действуют по принципу взаимной регуляции: ГИП, гормон проксимального отдела тонкой кишки, стимулирует продукцию ГПП-1, гормона дистального отдела тонкой кишки.
Отмечено, что секреция ГПП-1, вызванная приемом пищи, зависит от массы тела, уровня глюкагона и свободных жирных кислот натощак, а также от активности дипептидилпептидазы 4 и уровня HbA1c. У лиц с ожирением секреция ГПП-1 при приеме глюкозы или смешанной пищи снижена, а секреция ГИП увеличивается при приеме глюкозы и уменьшается при приеме белковой пищи. Инкретиновый дефект при СД 2 типа заключается не только в снижении секреции инкретинов, но и в развитии инкретинорезистентности, прежде всего в отношении ГИП. Выявлено, что при НТГ эффект ГИП снижается более выраженно, чем эффект ГПП-1 [10].
Лечебные мероприятия
Основная цель ведения пациентов с предиабетом заключается в профилактике развития СД 2 типа и сердечно-сосудистых осложнений.
На сегодняшний день у лиц с ранними нарушениями углеводного обмена доказана эффективность как немедикаментозной, так и медикаментозной стратегии. Кроме того, получено большое количество данных о возможности профилактики ССЗ при предиабете.
В отечественных и зарубежных рекомендациях по профилактике развития СД 2 типа у лиц с предиабетом подчеркивается ведущая роль мероприятий по изменению образа жизни (ИОЖ). Целью данных мероприятий является снижение массы тела на 5–7% от исходной. Снижения массы тела необходимо достигать за счет умеренно гипокалорийного питания с преимущественным ограничением потребления жиров и простых углеводов, а также за счет регулярной физической активности умеренной интенсивности. Продемонстрировано, что только лица с высокой приверженностью ИОЖ достигали необходимого снижения массы тела.
Однако мероприятия по ИОЖ, которые проводятся в рамках клинических исследований, зачастую сложно реализовывать в реальной клинической практике. Поэтому для профилактики СД 2 типа у лиц с предиабетом и неэффективностью мероприятий по ИОЖ обоснованно применение медикаментозной терапии [11].
Согласно алгоритмам управления СД 2 типа Американской ассоциации клинических эндокринологов (American Association of Clinical Endocrinologists – AACE) и Американского колледжа эндокринологии 2019 г., основу ИОЖ должны составлять:
- поддержание оптимального веса с ограничением калорий (если ИМТ увеличен);
- физическая активность не менее 150 минут в неделю с умеренной физической нагрузкой (например, ходьба, подъем по лестнице), силовые тренировки, увеличивающиеся по мере возможности как по длительности, так и по интенсивности;
- не менее семи часов сна в день;
- ограничение алкоголя и табакокурения.
Питание
Целью диеты при ранних нарушениях углеводного обмена является снижение массы тела. Снижение массы тела на 5–10% в течение 6–12 месяцев (оптимальным считается снижение на 2–4 кг, но не более 5 кг в месяц), вполне осуществимое для большинства пациентов, сопровождается достоверным уменьшением риска для здоровья и нормализацией гликемических показателей.
У пациентов с ранними нарушениями углеводного обмена показана гипокалорийная диета. Для составления сбалансированной диеты необходимо рассчитать количество калорий, которое допустимо употребить за сутки с учетом индивидуальных энергозатрат. Уже из расчета суточной нормы калорий можно составить меню на день. Необходимо отметить, что снижения калорийности рациона следует достигать преимущественно за счет уменьшения количества жиров и частично углеводов. На жиры должно приходиться не более 30% общего числа калорий в суточном рационе, на насыщенные жиры – не более 7–10%. Углеводы признаны основным источником энергии для организма. В суточном рационе они должны составлять 50%. Белки являются главным строительным материалом в организме и должны составлять 15–20% суточного рациона (в отсутствие нефропатии).
Очень низкокалорийные диеты дают кратковременный результат и не рекомендуются. Голодание противопоказано.
У лиц с предиабетом целевым считается снижение массы тела на 5–7% от исходной [2, 12].
В настоящее время доказано, что терапия ожирения замедляет развитие предиабета [12] и является важным фактором профилактики СД 2 типа. Так, в некоторых исследованиях установлено, что снижение массы тела на 10% сокращало риск развития СД 2 типа в будущем на 80% [13].
Согласно последним стандартам медицинской помощи больным СД 2 типа ADA, пациентам с предиабетом рекомендуется снижение массы тела на 7%, поскольку этот результат доказанно уменьшает риск развития диабета в будущем. У пациентов с СД 2 типа и ожирением устойчивое снижение массы тела приводит к улучшению гликемического контроля и снижению доз сахароснижающих препаратов [13].
Физическая активность и медикаментозная терапия
Физическая активность увеличивает расход кислорода и метаболических субстратов как источников энергии. В состоянии покоя неэтерифицированные жирные кислоты (НЭЖК) являются главным источником энергии для скелетных мышц. При небольшой по продолжительности и интенсивности нагрузке источником энергии помимо НЭЖК выступает глюкоза. При умеренной физической нагрузке источником энергии являются глюкоза, которая преимущественно образуется из гликогена в печени, и НЭЖК, высвобождаемые в результате липолиза.
Известно, что печень взрослых содержит запас глюкозы (около 10–200 г) в виде гликогена, достаточный для поддержания гликемии в течение 24 часов после последнего приема пищи.
При длительной физической нагрузке запасы гликогена в печени уменьшаются, что вызывает адренергическую стимуляцию, приводящую к усиленному липолизу, результатом чего является высвобождение НЭЖК из триглицеридов жирового депо и окисление их в мышечной ткани.
Физические упражнения повышают активность и количество переносчиков глюкозы в мембранах миоцитов.
У пациентов с впервые выявленным СД 2 типа физическая нагрузка повышает поглощение глюкозы тканями в 7–20 раз.
Длительное улучшение контроля гликемии обеспечивают силовые тренировки вследствие увеличения соотношения капилляров к мышечным волокнам, а также емкости запасов гликогена.
Согласно алгоритмам AACE и РАЭ, физическая активность умеренной интенсивности длительностью не менее 30 минут должна иметь место в большинстве дней недели и в общей сложности составлять не менее 150 минут в неделю [2, 14].
Роль ИОЖ и метформина в качестве методов профилактики СД 2 типа была оценена сначала в исследовании DPP, в динамике через 15 лет в исследовании DPPOS, следующей части исследования DPP, которая была посвящена возможностям длительной профилактики СД 2 типа и ССЗ.
В исследование DPP было включено 3234 пациента с предиабетом в возрасте старше 25 лет и ИМТ более 25 кг/м2, которые были разделены на три группы [15]. Первая группа получала плацебо и стандартные рекомендации по ИОЖ, вторая – метформин в дозе 1700 мг/сут, третья была мотивирована на активное ИОЖ (16 индивидуальных учебных занятий со специалистом с учетом особенностей пациента и последующие ежемесячные индивидуальные или групповые занятия).
Средняя продолжительность наблюдения составила 4,8 года.
Снижение массы тела на 0,1, 2,1 и 5,6 кг отмечено в группах плацебо, метформина и ИОЖ соответственно. Риск развития СД 2 типа максимально уменьшился (на 58%) в группе ИОЖ (р < 0,001 против групп плацебо и метформина). В группе метформина снижение составило 31% (р < 0,001 против группы плацебо). Большая эффективность метформина была продемонстрирована у пациентов с ИМТ ≥ 30 кг/м2 (максимально ≥ 35 кг/м2), в возрасте до 60 лет (максимально в 25–44 года), а также с уровнем глюкозы плазмы натощак 6,1–6,9 ммоль/л (рис. 2). Следует отметить, что при приеме метформина у пациентов с предиабетом не было зафиксировано развития гипогликемии [15].
В дальнейшем значительная часть (88%) участников исследования DPP перешла в исследование DPPOS. В группах плацебо и метформина не было изменений по ведению пациентов, тогда как в группе ИОЖ частота занятий была уменьшена до шести в год. Это привело к тому, что в группе метформина достигнутое в ходе исследования DPP снижение веса сохранилось, тогда как в группе ИОЖ оно достаточно быстро нивелировалось.
Полученные результаты привели к тому, что с 2011 г. сначала в США, а затем и в других странах метформин стали рекомендовать в качестве препарата первой линии для профилактики СД 2 типа у лиц с НТГ и ожирением в возрасте до 60 лет.
Согласно алгоритмам диагностики и лечения СД, предложенным экспертами РАЭ, препаратом выбора для лечения ранних нарушений углеводного обмена является метформин.
Уникальность действия метформина при предиабете заключается:
- в снижении до 50% продукции глюкозы печенью;
- увеличении поглощения глюкозы периферическими тканями (преимущественно скелетными мышцами, печенью);
- благотворном влиянии на липидный спектр за счет уменьшения уровня свободных жирных кислот и триглицеридов;
- замедлении всасывания глюкозы в тонкой кишке и возможном изменении структуры микробиоты;
- активации фибринолиза и снижении агрегационных свойств тромбоцитов.
Применение метформина в дозе 500–850 мг два раза в день (в зависимости от переносимости) может быть рассмотрено у лиц с предиабетом, особенно моложе 60 лет с ИМТ > 30 кг/м2 [2, 14].
Согласно результатам исследования DPPOS, у мужчин в группе метформина частота развития и выраженность атеросклероза коронарных артерий, который оценивался по индексу коронарного кальция, были достоверно ниже, чем в группах плацебо и ИОЖ. При этом антиатерогенный эффект метформина не зависел от демографических, антропометрических или метаболических факторов, использования статинов и факта развития СД 2 типа в дальнейшем.
Такой эффект метформина может быть обусловлен не столько гипогликемическим, сколько дополнительным кардиопротективным действием [16].
У пациентов с предиабетом также продемонстрирована эффективность метформина в снижении систолического артериального давления (особенно у лиц с НТГ и ожирением) и гипертрофии миокарда левого желудочка [17].
До недавнего времени метформин был препаратом выбора при СД 2 типа. Его начинают принимать с дозы 500 мг в ужин или на ночь. Максимальная доза может составлять 2,5–3,0 г/сут в несколько приемов. В связи с накоплением лактата на фоне приема метформина его не рекомендуют назначать при тяжелой сердечно-сосудистой патологии, гипоксии любой этиологии и нарушении функции печени. Вместе с этим за последние годы не отмечалось случаев фатального лактатацидоза. Частота лактатацидоза на фоне приема метформина в среднем составляет 0,03 случая на 1000 пациенто-лет. Все случаи лактатацидоза, отмеченные за последние десять лет, были связаны с нарушением приема препарата. Не обнаружено корреляции между дозой препарата и развитием лактатацидоза. Следует помнить, что у пожилых пациентов возможно уменьшение терапевтической дозы препарата в связи со снижением функции почек.
На сегодняшний день, согласно клиническим рекомендациям, метформин постепенно переходит в число опций для лечения предиабета. В данном случае начальная доза препарата составляет 500–850 мг и дотитровывается до 500–850 мг два раза в день. Длительность терапии определяется индивидуально [2].
A.V. Zilov, PhD
N.V. Sklifosovsky Institute of Clinical Medicine of I.M. Sechenov First Moscow State Medical University
Contact person: Aleksey V. Zilov, zilov_a_v@staff.sechenov.ru
Currently, there are more than 537 million patients with type 2 diabetes mellitus and about 850 million with initial disorders of carbohydrate metabolism in the world.
Taking into account the constant increase in the number of new cases of carbohydrate metabolism disorders, it is extremely important to diagnose them timely, especially at early stages.
The works of the late XX – early XXI century on the prevention of type 2 diabetes in the pre-diabetic stage are is encouraging. Therefore, it is necessary to use the experience gained in clinical practice as widely as possible.
The article discusses the risk groups for type 2 diabetes, methods for diagnosing of carbohydrate metabolism disorders and therapeutic approaches used at the prediabetes stage to prevent the progression of carbohydrate metabolism disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.