Прекоитальная профилактика острого цистита, связанного с половым актом
- Аннотация
- Статья
- Ссылки
- English
Цель исследования: изучить эффективность предварительного приема D-маннозы для профилактики развития посткоитального цистита.
Материал и методы. В исследование включено 39 женщин (средний возраст 26,4 года), у которых не менее половины эпизодов цистита связаны с половым актом (ПА). На первом этапе (первые пять ПА) пациентки должны были следовать общим рекомендациям по гигиене. На втором этапе (последующие пять ПА) они дополнительно принимали D-маннозу (Цистэль, две капсулы) за 30 минут до коитуса. На обоих этапах после ПА пациентки делали общий анализ мочи (тест-полоски), при наличии отклонений в моче – посев мочи, брали общий гинекологический мазок, а также заполняли опросник симптомов острого цистита (acute cystitis symptom score – ACSS). При появлении симптомов ИМП пациентки досрочно завершали этап и проходили лечение согласно рекомендациям Российского общества урологов.
Результаты. Оценено состояние пациенток после 109 ПА на первом этапе и 182 ПА на втором этапе. Цистит чаще развивался на первом этапе – 33 случая против 12 (р = 0,0083). При сравнении данных первого и второго этапов обнаружены отклонения в уровне лейкоцитов (включая «следы» белка) – 90 случаев против 84 (р = 0,002), наличии нитритов – 62 против 68 (p = 0,049), степени бактериурии – 3,34 против 1,59 (р < 0,001), общем гинекологическом мазке – 59 случаев против 91 (р = 0,701). Кроме того, выявлены различия в общем балле по блоку Typical шкалы ACSS – 5,36 против 1,56 (р < 0,001) и блоку Quality of life – 2,94 против 1,67 (р < 0,001). Таким образом, изменения в общем анализе мочи при бактериологическом исследовании и, как следствие, клиническая манифестация цистита на втором этапе наблюдались значительно реже, что привело к увеличению количества ПА при неизменном гинекологическом статусе.
Выводы. Прием D-маннозы перед ПА статистически значимо уменьшает долю случаев бактериурии, лейкоцитурии и, как следствие, дизурии и количества эпизодов рецидива цистита.
Цель исследования: изучить эффективность предварительного приема D-маннозы для профилактики развития посткоитального цистита.
Материал и методы. В исследование включено 39 женщин (средний возраст 26,4 года), у которых не менее половины эпизодов цистита связаны с половым актом (ПА). На первом этапе (первые пять ПА) пациентки должны были следовать общим рекомендациям по гигиене. На втором этапе (последующие пять ПА) они дополнительно принимали D-маннозу (Цистэль, две капсулы) за 30 минут до коитуса. На обоих этапах после ПА пациентки делали общий анализ мочи (тест-полоски), при наличии отклонений в моче – посев мочи, брали общий гинекологический мазок, а также заполняли опросник симптомов острого цистита (acute cystitis symptom score – ACSS). При появлении симптомов ИМП пациентки досрочно завершали этап и проходили лечение согласно рекомендациям Российского общества урологов.
Результаты. Оценено состояние пациенток после 109 ПА на первом этапе и 182 ПА на втором этапе. Цистит чаще развивался на первом этапе – 33 случая против 12 (р = 0,0083). При сравнении данных первого и второго этапов обнаружены отклонения в уровне лейкоцитов (включая «следы» белка) – 90 случаев против 84 (р = 0,002), наличии нитритов – 62 против 68 (p = 0,049), степени бактериурии – 3,34 против 1,59 (р < 0,001), общем гинекологическом мазке – 59 случаев против 91 (р = 0,701). Кроме того, выявлены различия в общем балле по блоку Typical шкалы ACSS – 5,36 против 1,56 (р < 0,001) и блоку Quality of life – 2,94 против 1,67 (р < 0,001). Таким образом, изменения в общем анализе мочи при бактериологическом исследовании и, как следствие, клиническая манифестация цистита на втором этапе наблюдались значительно реже, что привело к увеличению количества ПА при неизменном гинекологическом статусе.
Выводы. Прием D-маннозы перед ПА статистически значимо уменьшает долю случаев бактериурии, лейкоцитурии и, как следствие, дизурии и количества эпизодов рецидива цистита.

Актуальность
Инфекцией мочевыводящих путей (ИМП) страдают женщины всех возрастов. Каждая третья к 24 годам имеет опыт клинически значимого эпизода ИМП, и более 50% женщин переносит хотя бы один такой эпизод в течение жизни [1]. В данной работе сделан акцент на инфекции нижних мочевыводящих путей (ИНМП) – цистите.
Актуальность проблемы обусловлена склонностью ИМП к частому рецидивированию [2–4]: в течение полугода после ИМП у 27% пациенток случается рецидив, а у 3% – два рецидива [1]. Такое течение заболевания становится возможным в силу двух вероятных причин: недостаточное лечебное воздействие (персистенция инфекта) или реинфекция. Зачастую бывает трудно разделить эти два фактора, особенно когда выделяется один и тот же микроорганизм.
ИМП чаще всего вызываются бактериями, обитающими во влагалище или толстой кишке [1, 3, 5].
Биологические и генетические факторы, повышающие вероятность возникновения эпизода ИМП, описаны достаточно давно и не вызывают сомнения [6, 7]. Можно выделить такие факторы вирулентности, как адгезины (P-фимбрии, манноз-резистентные адгезины I типа), гемолизин, K-капсула [8]. По мнению некоторых авторов, значимую роль в рецидивировании ИНМП играют анатомические и физиологические изменения. К примеру расстояние между уретрой и анусом обратно пропорционально риску развития эпизода цистита. При этом длина уретры и параметры мочеиспускания не влияют на факт возникновения нового эпизода [9, 10].
К числу наиболее обсуждаемых мер профилактики посткоитального острого цистита относится интимная гигиена [10, 11]. D. Scholes и соавт. в исследовании по типу «случай – контроль» с помощью мультивариационного анализа установили, что частота половой жизни у молодых женщин – сильный фактор риска ИМП [12]. В ходе проведенных исследований не удалось подтвердить статистически значимого влияния на риск развития ИМП пре- или посткоитального мочеиспускания, частоты мочеиспусканий, отложенного мочеиспускания, способа обработки промежности при гигиенических процедурах, приема душа, а также докоитальной интимной гигиены мужчины. Однако несмотря на то что эффективность описанных мер не доказана, отсутствие негативного эффекта от их применения привело к тому, что они регулярно упоминаются как рекомендуемые к использованию [9, 12].
Среди известных веществ, демонстрирующих положительный эффект при ИНМП, следует выделить D-маннозу – природный сахар (вариант гексоз). Рецепторы маннозы – компонент защитного мукополисахаридного слоя уротелия. Блокируя взаимодействие фимбрий бактериальной клетки с эндотелием, манноза препятствует адгезии бактерий к слизистой оболочке и их колонизации. Образованный комплекс «манноза – Escherichia coli» «смывается» током мочи [13, 14]. В рандомизированном плацебоконтролируемом неослепленном клиническом исследовании ежедневный прием 2 г D-маннозы с целью профилактики ИМП был эффективнее плацебо и сопоставим по результату с приемом 50 мг нитрофурантоина [15].
Цель исследования
Изучить эффективность предварительного приема D-маннозы для профилактики развития посткоитального цистита.
Материал и методы
В исследовании участвовало 39 женщин фертильного возраста (в среднем – 26,4 года).
Предварительно пациентки прошли обследование (общий анализ мочи, общий гинекологический мазок, посев мочи и отделяемого влагалища, обследование методом полимеразной цепной реакции на инфекции, передаваемые половым путем), осмотр гинекологом и проверку на соответствие критериям включения/исключения. В исследование включались пациентки с указанием на документированные эпизоды ИНМП в анамнезе, не менее половины которых были связаны с половым актом (ПА).
Критериями исключения были:
- несанированные очаги инфекции урологической и гинекологической сфер;
- недержание мочи;
- вагинализация уретры;
- хронические соматические заболевания, требующие контроля их течения;
- невозможность ведения регулярной половой жизни;
- смена полового партнера;
- инфекции, передаваемые половым путем.
На первом этапе исследования (первые пять ПА) женщины должны были следовать общим рекомендациям по гигиене. На втором этапе (последующие пять ПА) они дополнительно принимали D-маннозу (Цистэль, 2 капсулы по 550 мг) за 30 минут до ПА.
После каждого ПА на обоих этапах пациентки выполняли общий анализ мочи (тест-полоски) и при наличии отклонений в моче – посев мочи, а также брали общий гинекологический мазок. Кроме того, в течение 12 часов после каждого ПА участницы заполняли опросник симптомов острого цистита (acute cystitis symptom score – ACSS) [16].
При появлении симптомов ИНМП женщины досрочно завершали этап исследования и проходили лечение согласно рекомендациям Российского общества урологов [2].
Результаты
Оценено состояние пациенток в общей сложности после 109 ПА на первом этапе и 182 ПА на втором. Таким образом, на втором этапе шанс у женщин вести половую жизнь, не прерываемую эпизодами цистита, был выше (χ2 = 4,029, р = 0,045). Цистит развился на первом этапе у 33 пациенток, а на втором – только у 12 (χ2 = 6,401, р = 0,012).
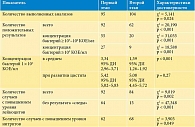
В связи с тем что механизм действия маннозы подразумевает блокирование фимбрий бактерий, особый интерес представляют результаты бактериологического исследования. Посев мочи выполняли специально по расширенным показаниям (при выявлении на общем анализе мочи нитритов или даже «следов» белка) вне зависимости от самочувствия пациентки и ее оценочного суждения о рецидиве цистита (табл. 1). Посев мочи чаще проводился на первом этапе – 87,2 против 57,1% случаев. Таким образом, можно констатировать, что воспалительная реакция нижних мочевыводящих путей после ПА на втором этапе была гораздо менее выраженной (χ2 = 5,141, р = 0,024). При этом интересно, что на первом этапе доля положительных результатов (обнаружение любой концентрации бактерий) составляла 96,8% от количества выполненных посевов и 84,4% от количества ПА, а на втором этапе – 59,6 и 34,1% соответственно (χ2 = 20,190, р < 0,001). Сравнение доли результатов с концентрацией микроорганизмов ≥ 103 и ≥ 105 КОЕ/мл – в обоих случаях также было в пользу второго этапа (р < 0,001). Средняя степень концентрации микроорганизмов в целом на втором этапе была значительно ниже – 1,59 против 3,34 (р < 0,001). В случае развития клинической картины цистита этот показатель статистически не различался – 5,08 против 5,42 (р = 0,27).
В исследовании также оценивались последствия бактериальной персистенции в уретре и мочевом пузыре после ПА. В целом, случаев с любой степенью отклонений по уровню лейкоцитов в моче на первом этапе было почти в два раза больше, чем на втором, – 84,4 против 46,2% (χ2 = 9,819, р = 0,002). Если не учитывать результат «следы», то разница на этапах будет еще более значительная – 60,4 против 8,2% (χ2 = 47,348, р < 0,001).
Важно отметить, что имевшие место различия в данных лабораторных исследований мочи наблюдались при неизменном состоянии половых путей по результатам общего гинекологического мазка после ПА. Отклонения в нем при микроскопии материала со слизистой влагалища и/или шейки матки встретились на первом этапе в 59 (54,1%) случаях, на втором – в 91 (50,0%) случае (χ2 = 0,148, р = 0,701). Еще более показательно, что лейкоцитарная реакция слизистого слоя уретры также выявлялась в сопоставимом количестве случаев на обоих этапах – 90 (82,6%) и 127 (69,8%) соответственно (χ2 = 0,842, р = 0,359).
Была также проанализирована степень выраженности симптомов и качества жизни в целом на каждом этапе и отдельно при развитии эпизода цистита после ПА по опроснику ACSS (табл. 2). Оценка по блоку Typical на этапах значительно отличалась. Так, на втором этапе пациентки чувствовали себя гораздо легче. Если средний балл на первом этапе составил 5,26, то на втором – всего 1,56 (р < 0,001). При оценке без учета нулевых результатов и случаев цистита – 2,79 против 1,52 балла (р < 0,001). Доля результатов «0 баллов» – 1,8 против 33,5% (р < 0,001). При развитии цистита различия были менее выражены – 11,30 против 9,17 балла, но носили характер статистически достоверных (р < 0,001).
По блоку Quality of life данные по этапам были также в пользу предварительного приема D-маннозы: 2,94 против 0,67 балла (р < 0,001), даже при возникновении цистита – 6,39 против 5,33 балла (результаты статистически значимы, р = 0,03).
Обсуждение результатов
Рецидивирующее течение ИНМП у женщин, в том числе фертильного возраста, представляет собой значимую медико-социальную проблему [1, 2, 6]. Тем более что она касается не только физического состояния женщины, но и сексуальной жизни пары, репродуктивного здоровья. Этот вариант течения ИНМП весьма распространен: каждая десятая женщина страдает рецидивирующим циститом. Высокая частота рецидивов, как и неэффективность профилактики и проводимой терапии, обусловлена недостаточной изученностью причин, условий, механизмов развития ИНМП, отсутствием единых однозначно действенных рекомендаций по предотвращению этого заболевания. Особенно это актуально для посткоитального цистита [3, 6, 10].
При выборе тех или иных мер профилактики ИНМП необходимо соблюсти баланс между установленной эффективностью, нежелательными явлениями, выполнимостью рекомендуемых мер и комплаентностью. Примечательно, что без лечения 25–42% неосложненных ИМП у женщин купируются спонтанно, но у 40% женщин с дизурией цистит переходит в хроническую форму [3, 17]. Развитие пиелонефрита происходит лишь у 2% женщин с нелечеными ИМП [1, 5]. На выбор того или иного метода профилактики влияют длительность и тяжесть симптомов заболевания.
Традиционно на начальном этапе профилактики пациенткам даются общие рекомендации: адекватное потребление жидкости, сексуальная гигиена, нормализация массы тела и стратегии снижения объема остаточной мочи. Перечень методов широко варьируется и нередко зависит от уровня беспокойства больных, частоты рецидивов и тяжести заболевания [2, 9–12]. Схожие рекомендации были даны и участницам исследования на первом (контрольном) этапе.
Целесообразно также принимать комбинации пробиотиков, препаратов для иммунопрофилактики, средств, в состав которых входят клюква и D-манноза [10, 15, 18]. Известен эффект взаимодействия бактериальной клетки с D-маннозой, основным стереоизомером маннозы, встречающимся в природе [19]. При колонизации уроэпителия бактерии с помощью фимбрий прикрепляются к «открытым» фрагментам полисахаридов, содержащих D-маннозу. Помещая в мочу дополнительно избыточное количество D-маннозы, можно добиться конкурентного прикрепления бактерии к D-маннозе, растворенной в моче, а не расположенной в мукополисахаридном слое слизистой мочевого пузыря [20].
Профилактика антибактериальными и уроантисептическими препаратами включает в себя длительный курсовой прием низких доз антимикробных препаратов (конкретный препарат выбирается в зависимости от чувствительности микроорганизма к антибиотикам, их переносимости и предпочтений врача) [5, 15, 18]. Женщинам с рецидивирующим течением ИМП, связанным с половым актом, в качестве альтернативы может быть предложена посткоитальная терапия. Считается, что такой режим позволяет свести к минимуму возможные нежелательные эффекты при постоянном применении противомикробных препаратов перед ПА, поскольку не каждый ПА сопровождается циститом [5, 10, 13].
В данной работе была избрана иная стратегия – прием препарата перед ПА. Важно отметить, что исследуемое действующее вещество D-манноза (моносахарид, компонент многих полисахаридов и смешанных биополимеров растительного, животного и бактериального происхождения) представляет собой естественный метаболит и лишен потенциальных нежелательных эффектов за исключением индивидуальной непереносимости [13–15, 18, 20].
Реализованный подход в рамках дизайна исследования позволил снизить:
- количество поводов к выполнению посева мочи в 1,5 раза;
- долю положительных результатов посевов в 1,5 раза при уменьшении в 2 раза степени концентрации микроорганизмов;
- долю случаев выявления лейкоцитурии в 4 раза (результаты 1+, 2+, 3+ при анализе тест-полосками).
Благодаря этому частота эпизодов посткоитального цистита снизилась в 3 раза, а количество осуществленных ПА повысилось на 67%. Даже в случае возникновения эпизода ИНМП пациентки оценивали качество жизни на втором этапе на 16,5% выше, чем на первом (по ACSS). Важно подчеркнуть, что приведенные результаты получены у одних и тех же больных при неизменном гинекологическом статусе.
В целом, рецидивирующие посткоитальные ИНМП относятся к трудно курабельным состояниям. Сложно дать единые рекомендации, поскольку в настоящее время существует огромный выбор действующих средств. Предлагаемый вариант прекоитального режима применения неантибактериального агента (D-маннозы) эффективно предупреждал развитие рецидивов цистита, связанного с ПА.
Выводы
Прием D-маннозы перед ПА статистически значимо уменьшает долю случаев бактериурии, лейкоцитурии и, как следствие, дизурии, а также количество эпизодов рецидива цистита.
A.Yu. Tsukanov, PhD, Prof., A.A. Mirzakadiyev
Omsk State Medical University
Contact person: Anton Yu. Tsukanov, autt@mail.ru
Relevance. Urinary tract infection (UTI) is a common disease in women that is prone to relapse. Postcoital cystitis accounts for up to 60% of cases of recurrent UTIS. The continuing high frequency of this variant of cystitis makes it necessary to search for new approaches to UTI prevention.
Purpose: to study the effectiveness of pre-administration of D-mannose for the prevention of postcoital cystitis.
Material and methods. The study included 39 women (average age 26.4 years), in which at least half of cystitis episodes are associated with sexual intercourse (SI). In the first stage (the first five steps), the patients had to follow general hygiene recommendations. In the second stage (the next five SI), they also additionally took D-mannose (Cystelle, two capsules) 30 minutes before coitus. At both stages, after SI, the patients performed a general urine analysis (test strips), if there were abnormalities in the urine, a urine culture, a general gynecological smear, and also filled out Acute Cystitis Symptom Score (ACSS). When UTI symptoms appeared, the patients completed the stage ahead of schedule and were treated according to the recommendations of the Russian Society of Urologists.
Results. The condition of patients after 109 SI at the first stage and 182 SI at the second stage was assessed. Cystitis more often developed at the first stage – 33 cases versus 12 (p = 0.0083). When comparing the data of the first and second stages, deviations were found in the level of white blood cells (including ‘traces’ of protein) – 90 cases versus 84 (p = 0.002), the presence of nitrites – 62 versus 68 (p = 0.049), the degree of bacteriuria – 3.34 versus 1.59 (p < 0.001), the general gynecological smear – 59 cases versus 91 (p = 0.701). In addition, differences were found in the total score for the Typical block of the ACSS – 5.36 versus 1.56 (p < 0.001) and the Quality of Life block – 2.94 versus 1.67 (p < 0.001). Thus, changes in the general analysis of urine during bacteriological research and, as a result, the clinical manifestation of cystitis at the second stage were observed much less frequently, which led to an increase in the number of SI while maintaining the gynecological status unchanged.
Conclusions. Taking D-mannose before SI statistically significantly reduces the proportion of cases of bacteriuria, leukocyturia and, as a result, dysuria and the number of episodes of cystitis recurrence.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.