Применение глюкокортикостероидов при боли в спине как фактор риска развития локальной и системной саркопении
- Аннотация
- Статья
- Ссылки
- English
При хронической боли в спине часто используются глюкокортикостероиды вследствие широкого спектра положительных физиологических эффектов, наиболее выраженным из которых признан противовоспалительный. Однако такая терапия нередко проводится с тактическими ошибками: с нарушением доз, длительности и схем применения, в частности одновременное назначение системных и локальных глюкокортикостероидов, что чревато развитием осложнений. Одним из упоминаемых в литературе осложнений является локальное и/или системное поражение мышц (миопатия и саркопения).
В статье представлены данные о связи между применением глюкокортикостероидов и развитием саркопении параспинальной мускулатуры у пациентов с болью в спине.
При хронической боли в спине часто используются глюкокортикостероиды вследствие широкого спектра положительных физиологических эффектов, наиболее выраженным из которых признан противовоспалительный. Однако такая терапия нередко проводится с тактическими ошибками: с нарушением доз, длительности и схем применения, в частности одновременное назначение системных и локальных глюкокортикостероидов, что чревато развитием осложнений. Одним из упоминаемых в литературе осложнений является локальное и/или системное поражение мышц (миопатия и саркопения).
В статье представлены данные о связи между применением глюкокортикостероидов и развитием саркопении параспинальной мускулатуры у пациентов с болью в спине.

Введение
В связи с увеличением продолжительности жизни населения, особенно в развитых странах, теоретическая и практическая медицина все чаще сталкивается с проблемами здоровья, которых ранее, казалось бы, не существовало. Кроме того, долгое время недооценивалась их роль в обеспечении активного долголетия и патогенезе возраст-ассоциированных заболеваний. Одной из таких медико-социальных проблем является саркопения, которая вплоть до 1989 г. не рассматривалась как важнейшая составляющая процесса биологического старения [1]. Термин «саркопения» (от греч. sarx (тело) и penia (потеря)) впервые был предложен в 1989 г. I.H. Rosenberg. Он использовался для описания возрастной потери массы и качества скелетной мускулатуры. С течением времени отношение к данной патологии кардинально менялось. Так, в конце 1990-х гг. эксперты Центров по контролю и профилактике заболеваний США признали саркопению одним из пяти основных факторов риска заболеваемости и смертности у лиц старше 65 лет [2]. В сентябре 2016 г. диагноз «саркопения» был включен в Международную классификацию болезней десятого пересмотра под кодом М 62.84 [3].
Официальное определение заболевания было дано в 2010 г. в рекомендациях Европейской рабочей группы по саркопении у пожилых людей (European Working Group on Sarcopenia in Older People – EWGSOP). Это способствовало существенному прогрессу в выявлении лиц с риском его развития и уходе за ними [4]. В начале 2018 г. в связи с появлением новых данных о саркопении и, следовательно, дополнительных трактовок состояния [5–7], а также данных о роли мышечной системы в организме в норме и при различных заболеваниях [8, 9] указанные рекомендации были обновлены. Помимо нового определения предложены переменные, которые позволяли бы выявлять саркопению и предсказывать исходы, а также инструменты для измерения каждой переменной, рекомендованы точки отсечения для измеряемых переменных, а также метод скрининга и оценки, приемлемый для использования в клинической практике [10].
Согласно рекомендациям EWGSOP 2018 г., под саркопенией следует понимать прогрессирующее и генерализованное заболевание скелетных мышц, которое связано с повышенной вероятностью неблагоприятных исходов, включая падения, переломы, инвалидизацию и смерть [10]. В отличие от рекомендаций 2010 г. в рекомендациях 2018 г. основным критерием саркопении признана низкая сила мышц, а не низкая мышечная масса, поскольку первая признана более надежным показателем мышечной функции и более достоверным показателем для прогнозирования неблагоприятных исходов.
Диагноз «саркопения» устанавливается по трем критериям [10]:
- мышечная сила;
- количество/качество мышц;
- физическая работоспособность (как показатель степени тяжести состояния).
В рекомендациях EWGSOP 2018 г. также выделено несколько стадий саркопении: пресаркопения, саркопения, тяжелая саркопения.
Пресаркопения характеризуется снижением мышечной массы без негативного влияния на мышечную силу или физические возможности. Эта стадия может быть выявлена только с помощью инструментальных исследований. Саркопения характеризуется снижением как мышечной массы, так и силы мышц или ухудшением физических возможностей. При тяжелой саркопении наблюдаются изменения всех трех критериев [10].
Согласно рекомендациям EWGSOP 2018 г., саркопению необходимо подразделять на острую и хроническую. Первая длится менее шести месяцев, вторая – шесть месяцев и более. Острая саркопения обычно связана с острым заболеванием или травмой, хроническая – с хроническими и прогрессирующими состояниями и увеличением риска смерти.
Кроме того, важно отличать саркопению от кахексии. Кахексия (от греч. kakòs (плохой) и héxis (условие)) – мультифакторный синдром тяжелой потери веса, жировой и мышечной массы на фоне усиленного катаболизма белков вследствие различных заболеваний. Наличие кахексии существенно повышает риск коморбидности и смерти. Контрибутивными факторами патологии являются анорексия и метаболические нарушения (усиление системного субклинического хронического воспаления и миопротеолиза, нарушение углеводного, липидного и белкового обменов и т.д.) [11].
В настоящее время в геронтологии появился термин «старческая астения» (дряхлость), который характеризует состояние здоровья пациента пожилого и старческого возраста, отражая потребность в постороннем уходе [12, 13]. Указанный клинический синдром включает пять показателей, в основе которых прямо или косвенно прослеживается возрастная саркопения:
- потеря веса;
- доказанное динамометрическое снижение силы кисти;
- выраженная слабость и повышенная утомляемость;
- снижение скорости передвижения;
- значительное снижение физической активности.
Старческая астения имеет место при наличии трех показателей и более. Наличие одного или двух из них свидетельствует о старческой преастении.
В мире распространенность старческой астении составляет 12,9%, старческой преастении – 52,3% [14, 15]. Установлено, что в отсутствие адекватных мер лечения и реабилитации преастения переходит в развернутую астению в течение четырех – пяти лет.
В России частота встречаемости старческой астении у лиц старше 65 лет достигает 80,5%, что отражает не только существенные проблемы со здоровьем в данной популяции, но и крайне низкую профилактическую и лечебную эффективность мероприятий государственной системы здравоохранения [16].
Старческую астению также следует дифференцировать от саркопении. Первая – гериатрический синдром, вторая – болезнь. Старческая астения ассоциируется с ухудшением состояния многих физиологических систем, поэтому ее влияние более глобально. Она воздействует и на физические, и на когнитивные, и на социальные возможности пациентов [17].
Саркопения как процесс старения
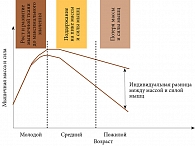
Установлено, что набор критического объема костно-мышечной массы в среднем происходит до 25–30 лет. В дальнейшем масса и сила мышц постепенно снижаются. После 60 лет отмечается прогрессивное ускорение процесса [18]. Так, частота встречаемости саркопении в возрасте 65–70 лет в среднем составляет 14–20%, 80 лет – практически 50% (рис. 1) [19].
Если в возрасте 25–30 лет объем мышечной массы составляет около 40% от общего объема тела, в возрасте 75–80 лет – примерно 25%. С 20 до 80 лет мышечная масса уменьшается на 30%, площадь поперечного сечения мышц – примерно на 20% [18]. Эта динамика обусловлена уменьшением размера и количества мышечных волокон, преимущественно быстрых волокон второго типа [20]. Установлено, что селективная атрофия волокон второго типа может быть связана со снижением высокоинтенсивной физической активности. Волокна первого типа отвечают за движения низкой интенсивности (повседневные, например при ходьбе).
Сокращение объема скелетных мышц приводит к уменьшению скорости основного обмена после 20 лет на 2–3%, после 50 лет на 4%. С 20 до 70 лет основной обмен снижается примерно на 30% [21].
В целом процесс старения связан с более выраженной потерей силы и массы мышц в нижней части тела, чем в верхней. При этом в большей степени уменьшается сила мышц-разгибателей [22].
Снижение мышечной силы с возрастом может объясняться не только укорочением мышечных пучков, но и снижением жесткости сухожилий. В совокупности это приводит к уменьшению удельной силы (сила пучка на физиологическую площадь поперечного сечения) [22].
С учетом данных о старении населения на сегодняшний день диагноз «саркопения» может быть поставлен более чем 50 млн, в течение следующих 40 лет – еще не менее чем 200 млн.
Влияние саркопении на качество и продолжительность жизни пациентов крайне негативно. Она ассоциируется с существенным повышением уровня коморбидности и смертности, нарушением всех видов адаптации, необходимостью больших материальных вложений системы здравоохранения [23–30].
Саркопения как полиэтиологический синдром
Долгое время саркопения ассоциировалась со старением и пожилым возрастом, на сегодняшний день общепризнано, что она может развиться и в более раннем возрасте [31].
Фенотип саркопении имеет множество сопутствующих причин, возраст является относительным фактором риска ее развития [32].
Саркопения считается первичной, если ее возникновение связано с возрастом, вторичной – если установлены этиологические факторы, отличные от старения или дополняющие его.
Среди причин вторичной саркопении указывают воспалительный процесс, злокачественные новообразования или органную недостаточность [33]. Отсутствие физической активности, состояние невесомости и длительная иммобилизация также способствуют возникновению саркопении. Кроме того, саркопения ассоциируется с анорексией, мальабсорбцией, ограниченным доступом к здоровой пище или ограниченной способностью принимать пищу. Не следует забывать и о потенциально негативных миотропных эффектах некоторых лекарственных препаратов, при длительном приеме индуцирующих так называемую медикаментозную саркопению [10].
Сказанное выше позволяет рассматривать саркопению как полиэтиологический синдром, а не как отдельное заболевание.
Патогенез
Ключевую роль в патогенезе саркопении играют [10, 34–36]:
- активация апоптоза клеток мышечной ткани – миоцитов, которые являются своеобразным депо белка в организме и могут быть использованы при развитии тяжелой патологии;
- снижение содержания миопротективных гормонов (половых стероидных гормонов, гормона роста, витамина D, надпочечниковых андрогенов, мелатонина) и/или повышение содержания миодеструктивных гормонов (кортизола, инсулина);
- дегенеративные процессы в нервно-мышечной системе, которые приводят к ухудшению иннервации мышечных волокон и деградации мышечной ткани;
- эндотелиальная дисфункция, которая способствует гипоксии, ишемии и фиброзу мышечной ткани;
- дефицит витаминов и микронутриентов (аминокислот, микроэлементов), участвующих в синтезе мышечных белков в миоцитах.
Особое значение в развитии саркопении отводится нарушению гормональной регуляции мышечной ткани (внутриклеточного синтеза мышечного белка) [37–39].
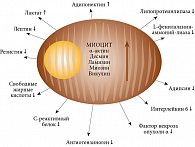
С одной стороны, мышечная ткань является гормонозависимым органом, поскольку в миоцитах имеется выраженная экспрессия ко многим гормонам, регулирующим как синтез энергии (негеномное влияние на митохондрии), так и рибосомальный синтез мышечных белков (геномное влияние на ядра миоцитов) [40–43]. Развивающиеся и усиливающиеся с возрастом инсулинорезистентность, окислительный стресс (гиперкортизолемия), системное цитокиновое хроническое субклиническое воспаление, эндотелиальная дисфункция, возрастной дефицит половых стероидных гормонов и надпочечниковых андрогенов способны ускорить деградацию мышечных белков, приближая саркопению [44, 45].
С другой стороны, мышечная ткань является гормонопродуцирующим органом. Она вырабатывает большое количество биологически активных веществ (миокинов), которые являются внутриклеточными регуляторами роста и распада мышечных волокон. Данные биологические вещества с помощью аутокринных и паракринных механизмов влияют на активность и биогенез митохондрий миоцитов и таким образом обеспечивают мышечные клетки необходимой для жизнедеятельности энергией с одновременной инактивацией свободных радикалов, способствующих деградации мышечных волокон (рис. 2) [46, 47].
Клинические маски
Установлено, что мышечная ткань, так же как нервная ткань, наиболее энергопотребна, поэтому чувствительна даже к минимальной гипоксии. В результате старение миоцитов, как и нейронов, начинается раньше старения клеток других органов и систем [48]. Еще одной закономерностью является одновременность старения мышц независимо от локализации и типа мышечной ткани [49].
Пациенты с признаками старения мышц часто встречаются в клинической практике. Однако саркопения у них диагностируется редко и еще реже корректируется.
Распространенность саркопении при хронических сердечно-сосудистых и бронхолегочных заболеваниях повышается в два раза, а при циррозе печени – в 18–50 раз [50]. Саркопения дыхательной мускулатуры часто сопутствует хронической обструктивной болезни легких и является одним из ключевых факторов тяжести ее течения и прогноза [51].
В урологической практике саркопения чаще всего имеет локальные проявления в виде мышечной недостаточности тазового дна. К признакам таковой относят гипермобильность уретры и стрессовое недержание мочи, ослабление функции опорожнения мочевого пузыря (гипо- и атоничный детрузор), детрузорно-сфинктерную диссинергию.
В гинекологии тазовая саркопения (особенно у возрастных пациенток) проявляется пролапсом и выпадением половых и мочевых тазовых органов, стрессовым недержанием мочи.
Опущение или выпадение прямой кишки, обусловленное тазовой саркопенией, встречается в практике колопроктологов.
В практике врачей-ортопедов нередки случаи вальгусной деформации большого пальца стопы (hallux valgus), которая возникает в результате того, что первая плюсневая кость не удерживается ослабленными боковыми мышцами стопы. Дистрофия мышц стопы ускоряет уплощение поперечного свода в вальгусную деформацию первого пальца и изменение плюснефалангового угла.
Оториноларингологам и сомнологам приходится сталкиваться с такой проблемой, как осиплость голоса и храп. При этом происходит нарастание жировой составляющей окологлоточного пространства и снижение тонуса (саркопения) мышц глотки, язычка и голосовых связок.
Нередко косметологи – первые специалисты с медицинским образованием для пациенток с саркопенией. Как правило, это женщины после 40 лет с опущением углов рта, нечеткостью контуров лица, опущением мышц лица в виде брылей и верхних век (блефароптоз).
Гравитационные птозы вследствие саркопении выявляются при проведении общего осмотра пациентов. В частности, на них указывают так называемые ламбрекены на спине (птоз мышц спины), отвисание крупных мышечных групп (трицепса, бицепса на руках, квадрицепса на ногах), тканей над надколенником или над локтем (птоз соответствующих мышц) [52].
Роль глюкокортикостероидов в развитии саркопении
С момента разработки глюкокортикостероиды (ГКС) заняли прочное место в терапии большинства воспалительных заболеваний, в том числе опорно-двигательного аппарата, что связано с механизмом их действия. ГКС регулируют транскрипцию генов, контролирующих синтез протеинов и ДНК. Воздействие ГКС на соответствующие глюкокортикоидные рецепторы приводит к комплексу изменений с участием специфической мессенджерной РНК, ядерной РНК и других промоторных субстанций. Итогом этого является активация или ингибирование транскрипции соответствующих генов.
Ключевым физиологическим эффектом ГКС считается противовоспалительный. Он обусловлен рядом механизмов, ведущим из которых является подавление активности фосфолипазы А2. ГКС увеличивают экспрессию генов, кодирующих синтез липокортинов (аннексинов), индуцируют продукцию этих белков, один из которых – липомодулин – ингибирует активность фосфолипазы А2. Угнетение этого фермента приводит к подавлению либерации арахидоновой кислоты и торможению образования медиаторов воспаления, таких как простагландины, лейкотриены, тромбоксаны, фактор активации тромбоцитов. ГКС уменьшают экспрессию гена, кодирующего синтез циклооксигеназы 2, дополнительно блокируя образование провоспалительных простагландинов. Кроме того, ГКС существенно модулируют микроциркуляцию крови в очаге воспаления, вызывая вазоконстрикцию капилляров, уменьшая экссудацию жидкости, а также стабилизацию клеточных мембран, в том числе мембран лизосом, предотвращая выход лизосомальных ферментов и снижая тем самым их концентрацию в месте воспаления [53, 54].
В настоящее время хорошо изучены и другие положительные эффекты ГКС. Речь, в частности, идет об их участии в обмене цитокинов, интерферонов, клеточном синтезе белка, регуляторных пептидов и белков, связанных с системой энзимов, которые в свою очередь контролируют клеточные функции, о воздействии на клеточный и гуморальный иммунитет, стимуляции адаптации за счет участия в стресс-опосредованных реакциях, влиянии на все виды обмена (жировой, белковый, углеводный, микроэлементарный), глюконеогенез [55].
По мнению ряда экспертов, локальное инъекционное введение (блокада) ГКС в очаг воспаления или дегенеративно-дистрофического процесса (эпидурально, фораминально, параартикулярно в фасеточные суставы, в миофасциальные триггерные точки и др.) является одним из наиболее эффективных консервативных методов терапии скелетно-мышечной боли в спине на всех этапах [56]. Несмотря на то что результаты доступных систематических обзоров и метаанализов по данной проблеме неоднозначны [57–59], в Кокрановском обзоре 2008 г. указано, что достаточных доказательств в пользу применения инъекций при подострых и хронических болях в спине не получено. Однако не исключается, что некоторые группы пациентов могут положительно отвечать на определенный вид инъекционной терапии [57].
В рутинной клинической практике локальное введение ГКС при боли в спине по-прежнему широко применяется. Кроме того, нередко сочетают системное введение препарата (например, курсы дексаметазона в дозе до 4–8 мг до 10 капельниц) с локальным (часто в необоснованно высоких дозах).
Такую медикаментозную перегрузку нельзя рассматривать как адекватную и безопасную. Несмотря на большой спектр положительных эффектов, ГКС характеризуются рядом побочных эффектов, зависящих как от дозы препарата, так и длительности его применения.
Установлено, что при длительном использовании высоких доз ГКС развивается стероидный остеопороз – 95% случаев [60].
Впервые связь между снижением минеральной плотности кости и приемом ГКС была отмечена в 1932 г. У шести из восьми больных, умерших от «неясного полигландулярного синдрома», который в дальнейшем получил название «синдром Кушинга», при проведении аутопсии была обнаружена остеопения в позвоночнике [61].
При этом наиболее выраженные изменения наблюдаются в костях с трабекулярным строением, прежде всего в трабекулярной ткани позвонков [62–64].
Ключевым звеном в развитии стероидного остеопороза является подавляющее воздействие ГКС на остеобласты, что приводит к уменьшению костеобразования. ГКС также снижают абсорбцию кальция в кишечнике и реабсорбцию кальция в почечных канальцах. Как следствие, отрицательный баланс кальция в организме и транзиторная гипокальциемия. Это в свою очередь стимулирует секрецию паратиреоидного гормона, усиливает резорбцию костной ткани и увеличивает риск падений и переломов [65].
Известно также об отрицательном влиянии ГКС на силу и трофику мышц [66].
Для обозначения эффекта экзогенных ГКС на формирование костной ткани и истощение периферических мышц в литературе используется термин «миопатия». Стероидная миопатия – один из частых факторов нарушения ходьбы у пожилых [67]. В некоторых случаях она становится причиной миопатии критических состояний [67].
Клинический случай
Пациент М., 36 лет, в течение года страдал болями в правой ноге и спине. С декабря 2018 г. по февраль 2019 г. получил три курса консервативного лечения в разных медицинских учреждениях (неврологическое отделение муниципального стационара и два частных стационара). Каждый курс предполагал использование ГКС по следующей схеме: системное внутривенное введение № 20 и паравертебральные локальные инъекции до трех раз. За период терапии наблюдалась незначительная положительная тенденция в отношении снижения болевого синдрома. Однако динамика по результатам магнитно-резонансной томографии отсутствовала.
В марте 2019 г. данные магнитно-резонансной томографии свидетельствовали об ухудшении состояния параспинальной мускулатуры – переходе умеренной жировой мышечной дистрофии в выраженную (рис. 3). Это потребовало хирургического вмешательства с последующим подбором мероприятий индивидуальной реабилитации, включая лечебную гимнастику.
Заключение
Приведенный клинический случай демонстрирует, что терапия высокими дозами ГКС может приводить к развитию не только системной, но и локальной саркопении в местах инъекций, что со временем или при повторных курсах будет способствовать ослаблению мышечного каркаса позвоночного столба и повышению функциональной нагрузки на него.
По мнению авторов, данный факт имеет гораздо большее клиническое значение, чем предполагаемое положительное противовоспалительное действие ГКС.
В связи со сказанным ранее наличие признаков спинальной саркопении у пациентов с болью в спине должно рассматриваться как противопоказание для назначения локальных ГКС.
С осторожностью такое лечение следует назначать женщинам в период постменопаузы, больным сахарным диабетом и лицам, которым в ближайшем будущем показано хирургическое лечение [68].
Данная проблема требует дальнейшего изучения.
A.V. Epifanov, Yu.A. Tishova, PhD, I.A. Tyuzikov, PhD, Prof., A.M. Tkachev, I.E. Gordeeva, PhD
Tkachyev – Yepifanova’s Clinic, Moscow
Yepifanov Vertebrology Center, Samara
Multidisciplinary Clinic ‘K-Medicine’, Moscow
‘Tandem Plus’, Medical Center Yaroslavl
Tkachyev Clinic, Volgograd
Volgograd State Medical University
Contact person: Igor A. Tyuzikov, phoenix-67@list.ru
Currently, chronic back pain is an urgent medical and social problem due to its high prevalence in the population and the difficulty of achieving long-term remission, especially complete recovery.
In chronic back pain, glucocorticosteroids are often used due to wide range of positive physiological effects, the most pronounced of which is recognized to be the anti-inflammatory effect. However, such therapy is often carried out with tactical errors: with a violation of the doses, duration and schemes of use, in particular, the simultaneous administration of systemic and local glucocorticosteroids, which can become the cause of complications development. In particular, one of the complications mentioned in the literature is local and/or systemic muscle damage (myopathy and sarcopenia).
The article presents data on the relationship between the use of glucocorticosteroids and the development of sarcopenia of the paraspinal muscles in patients with back pain.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.