Основы гормонально-метаболической терапии мочекаменной болезни
- Аннотация
- Статья
- Ссылки
- English
Среди основных задач консервативного лечения, а также первичной и вторичной профилактики МКБ – борьба с нарушенной кислотностью мочи, нарушениями пуринового обмена (гиперурикемией и гиперурикозурией), поддержание положительного кальциевого баланса в организме, а также компенсация дефицита микроэлементов (в первую очередь магния). Коррекция дефицита тестостерона и витамина D у пациентов с МКБ не только улучшает антропометрические показатели и лежит в основе борьбы с саркопенией и ассоциированной с ней инсулинорезистентностью, но и может стать ключом к решению проблемы МКБ, учитывая тесную этиопатогенетическую взаимосвязь этих состояний.
Среди основных задач консервативного лечения, а также первичной и вторичной профилактики МКБ – борьба с нарушенной кислотностью мочи, нарушениями пуринового обмена (гиперурикемией и гиперурикозурией), поддержание положительного кальциевого баланса в организме, а также компенсация дефицита микроэлементов (в первую очередь магния). Коррекция дефицита тестостерона и витамина D у пациентов с МКБ не только улучшает антропометрические показатели и лежит в основе борьбы с саркопенией и ассоциированной с ней инсулинорезистентностью, но и может стать ключом к решению проблемы МКБ, учитывая тесную этиопатогенетическую взаимосвязь этих состояний.

Мочекаменная болезнь (МКБ) в настоящее время – одна из наиболее актуальных проблем современной урологии и медицины в целом. Это связано в первую очередь с высокой распространенностью МКБ, которая, по данным нескольких популяционных исследований, составляет от 3,5 до 9,6% [1]. При этом отмечается неуклонный рост заболеваемости [2]. По данным официальной статистики Министерства здравоохранения РФ, за период с 2002 по 2014 г. прирост числа пациентов с МКБ в нашей стране составил 34,5% [3]. Примерно в 50% случаев заболевание носит рецидивирующий характер [4], что может свидетельствовать о неэффективности лечебных и профилактических мероприятий, проводимых в стационаре и амбулаторно.
Проблема МКБ в нашей стране и мире заключается в доминировании традиционного хирургического подхода, который определял развитие техники оперативных вмешательств и разработку новых технологий удаления камня, что к настоящему времени позволило практически полностью отказаться от открытых оперативных вмешательств на почке по поводу этого заболевания. Появление новых оперативных методов лечения камней почек и мочеточников значительно ослабило интерес к изучению этиологии, патогенеза и консервативного лечения МКБ. Необходимость существования и совершенствования малоинвазивных эндоскопических методов избавления от камня не подвергается сомнению, однако это не избавляет пациента от образования новых конкрементов, поскольку причины, как правило, не устраняются. Только на основании знания этиопатогенеза возможна разработка оптимальных методов консервативного лечения и профилактики МКБ.
Согласно определению, МКБ – это болезнь обмена веществ, вызванная различными эндогенными и/или экзогенными причинами, характеризующаяся наличием камня в мочевыводящей системе [5]. Очевидно, что камень в мочевых путях – только клиническое проявление заболевания, которое не заканчивается с удалением камня, а продолжает прогрессировать, если не были устранены вызвавшие его причины.
Наиболее распространены кальциевые камни, на долю которых приходится не менее 80%. При этом большая часть кальциевых камней, примерно 85–90%, – оксалаты кальция, 1–10% – фосфаты кальция [1]. В последнее время во всем мире прослеживается тенденция к уменьшению в общей структуре доли фосфатных камней. Вероятнее всего, такая ситуация – результат снижения количества инфицированных камней из-за распространения малоинвазивной хирургии МКБ и применения современной антибактериальной терапии. Таким образом, метаболические нарушения выходят на первый план и начинают играть в патогенезе МКБ ключевую роль. Все чаще стали встречаться мочекислые камни (до 10% всех мочевых камней), в состав которых входят мочевая кислота и ее соли, а также смешанные камни (до 5% всех кальциевых камней), имеющие в составе соли кальция в сочетании с мочевой кислотой и/или ее солями [1].
Учитывая вышеизложенное, в основе метаболической терапии МКБ должно лежать воздействие на факторы риска, способствующие формированию кальций-оксалатных и мочекислых камней, так как именно эти два типа мочевых конкрементов лидируют по частоте в мировой популяции. Рассмотрим эти факторы риска.
Согласно рекомендациям Европейской ассоциации урологов (2015), наиболее распространенными метаболическими факторами, ассоциированными с МКБ у взрослых, считаются повышенная кислотность мочи (pH ≤ 5,8), гиперурикемия, гиперурикозурия, гиперкальциурия, гипероксалурия, гипомагниурия, гипоцитратурия, а также низкий объем мочи вследствие недостаточного количества выпиваемой жидкости [6].
Высокая кислотность мочи (pH ≤ 5,8) – наиболее важный патогенетический фактор формирования мочекислых конкрементов, а также камней смешанного состава (кальций + мочевая кислота). В резко кислой среде растворимость мочевой кислоты падает. Слаборастворимая мочевая кислота кристаллизуется в мочевых путях и преобразуется в мочевые камни [7]. При лечении мочекислого уролитиаза целевыми значениями pH принято считать 6,0–7,0, поскольку именно в этом диапазоне удается повысить растворимость мочевой кислоты и ее солей и снизить кристаллизацию. Кристаллы мочевой кислоты, которыми перенасыщена кислая моча, могут также служить центрами нуклеации для эпитаксиального роста кристаллов кальция оксалата [8].
В качестве патогенетической основы нарушенного кислотно-основного равновесия мочи в сторону закисления выступает инсулинорезистентность, которая в свою очередь является ключевым звеном в патогенезе метаболического синдрома [9, 10]. Накоплено достаточно данных, в том числе полученных в известных эпидемиологических исследованиях серии NHANES III, которые указывают на связь МКБ с метаболическим синдромом [11, 12]. Отдельные компоненты метаболического синдрома, такие как абдоминальное ожирение, артериальная гипертония, гипергликемия и сахарный диабет второго типа, независимо коррелируют с повышенным риском уролитиаза, а наличие одновременно четырех и более компонентов метаболического синдрома увеличивает риск развития МКБ примерно в два раза [11].
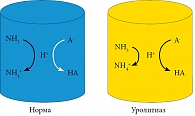
Описываются две причины, способствующие повышенной ацидификации мочи у пациентов с метаболическим синдромом: нарушение экскреции иона аммония (NH4+) и избыточная экскреция кислот [10, 13]. В норме кислотно-щелочной баланс мочи поддерживается высокопроизводительной аммониевой буферной системой. При избытке кислот аммиак (NH3), выделяемый клетками почечных канальцев, соединяется с ионами водорода (Н+) в почечных канальцах, образуя ион аммония (NH4+) (рис. 1) [14]. Впервые связь между инсулинорезистентностью, pH мочи и аммониогенезом была обнаружена при помощи гиперинсулинемического эугликемического клэмп-теста у пациентов с мочекислым уролитиазом [15]. Эти исследования продемонстрировали потенциальную роль инсулинорезистентности в нарушении экскреции иона аммония (NH4+) и, таким образом, снижении pH мочи.
Инсулиновые рецепторы представлены в различных частях нефрона [16, 17]. В экспериментах на животной модели (крысы, собаки) инсулин показал себя как стимулятор почечного аммониогенеза [18, 19]. Соответственно, при инсулинорезистентном состоянии нарушается стимулирующий эффект инсулина в отношении синтеза и экскреции NH4+.
Помимо нарушения работы аммониевого буфера есть еще один механизм, способствующий повышению кислотности мочи, – избыточная экскреция кислот. По данным N.M. Maalouf и соавт., у пациентов с метаболическим синдромом отмечалась достоверно более высокая экскреция кислот по сравнению с контрольной группой [10].
Избыточная экскреция кислот может быть следствием как чрезмерного употребления продуктов с кислым pH и низкого употребления щелочных продуктов, так и эндогенной гиперпродукции кислот. Так, экскреция кислот была достоверно выше у пациентов с мочекислым уролитиазом по сравнению с контрольной группой (без уролитиаза) [20]. Все пациенты получали одинаковое по кислотности питание, что позволило исключить влияние употребляемой пищи на экскрецию кислот и предположить их эндогенную гиперэкскрецию у пациентов с уратными камнями. Сочетание гиперэкскреции мочевой кислоты с повышенной кислотностью мочи повышает вероятность кристаллизации мочевой кислоты и ее солей. Именно поэтому устранение гиперурикемии и гиперурикозурии наряду с подщелачиванием мочи – одна из основных целей метаболической терапии МКБ [13].
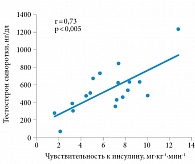
Гиперинсулинемии как компенсаторному состоянию на фоне инсулинорезистентности отводится основная роль в развитии гиперурикемии при метаболическом синдроме, а повышенный уровень мочевой кислоты в крови может служить косвенным признаком гиперинсулинемии и инсулинорезистентности. К такому выводу мы пришли после статистической обработки результатов собственного исследования, где изучали метаболические факторы риска МКБ у пациентов с метаболическим синдромом [21]. Были получены статистически достоверные положительные корреляции между концентрацией мочевой кислоты в крови и уровнем инсулина и С-пептида (рис. 2).
Гиперурикемия – результат нарушения пуринового обмена. Она часто сочетается с ожирением и сахарным диабетом второго типа (проявлениями метаболического синдрома). Одна из причин нарушения пуринового обмена помимо наследственных ферментных дефектов и повышенного потребления продуктов, богатых пуринами, – повышенный метаболизм мышечной ткани с преобладанием катаболических процессов над анаболическими, в итоге приводящий к саркопении (дефициту количества и качества скелетных мышц).
Тестостерон – основной андроген, представленный в мышечной ткани, в которой активность 5-альфа-редуктазы крайне низкая. Тестостерон оказывает прямое анаболическое действие как на гладкую, так и на скелетную мускулатуру, приводя к увеличению мышечной массы и гипертрофии мышечных волокон. Анаболический эффект тестостерона заключается также в стимуляции синтеза органоспецифических белков в почках, печени и других тканях. Уменьшение концентрации тестостерона неизбежно ведет к мышечной гипотрофии и снижению синтетических процессов в организме и может быть причиной повышенного высвобождения пуриновых оснований и соответственно гиперпродукции мочевой кислоты [21].
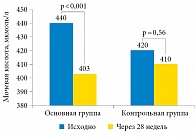
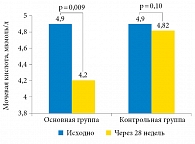
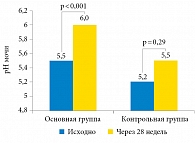
Низкий уровень половых гормонов достоверно связан с ожирением и инсулинорезистентностью также посредством механизмов саркопении, поскольку утилизация глюкозы происходит в основном в мышечной ткани. Доказано, что стимуляция эндогенной секреции тестостерона хорионическим гонадотропином человека улучшает чувствительность к инсулину уже в течение 48 часов (рис. 3) [22]. Таким образом, дефицит тестостерона у мужчин в любом возрасте – важнейший гормональный фактор, повышающий риск развития саркопении и всех ее неблагоприятных последствий, к которым смело можно отнести инсулинорезистентность и, как итог, сахарный диабет второго типа, ожирение и нарушение липидного обмена, а также гиперурикемию – важнейший метаболический фактор риска МКБ. Коррекция гипогонадизма у мужчин позволяет увеличить количество и улучшить качество мышечной массы при одновременном уменьшении жировой массы, что подтверждают результаты многочисленных недавних исследований с высокой степенью доказательности [23–25]. Помимо улучшения композиционного состава тела заместительная андрогенотерапия может быть патогенетическим компонентом лечения гиперурикемии и ассоциированной с ней гиперэкскреции мочевой кислоты (рис. 4 и 5) [21]. В нашем исследовании также было отмечено достоверное повышение pH мочи с 5,5 (5,0; 5,5) до 6,0 (5,8; 6,4) (p < 0,001) в основной группе пациентов на фоне андрогенотерапии, тогда как в группе контроля, не получавшей терапию, этого не наблюдалось (рис. 6) [21]. Данные изменения, несомненно, ассоциированы с компенсацией гиперинсулинемии и инсулинорезистентности в основной группе пациентов, получавших лечение препаратом тестостерона, и сочетались с уменьшением выраженности ожирения (снижение индекса массы тела и окружности талии), нормализацией систолического артериального давления, улучшением показателей липидного и углеводного обмена [21].
Говоря о гормональных механизмах саркопении, связанной с ней инсулинорезистентности и характерных нарушениях обмена веществ, приводящих к МКБ, нельзя не упомянуть еще один важный, но незаслуженно забытый мощный анаболический гормон с антиоксидантными свойствами и уникальными системными метаболическими эффектами – витамин (гормон) D. В настоящее время хорошо известно, что дефицит витамина (гормона) D (признанный неинфекционной эпидемией XXI в.) непосредственно связан и с уровнем тестостерона, и с развитием саркопении [26]. С одной стороны, имеют место сезонные колебания уровня витамина D с высоким уровнем летом и осенью и низким уровнем зимой и весной (по аналогии с годичными циклами тестостерона) [27]. С другой стороны, регуляция экспрессии генов метаболизма гормона D изменяется в соответствии с уровнем андрогенов. Соответственно, дефицит андрогенов усиливает неблагоприятные для здоровья последствия дефицита витамина D [28]. Таким образом, между тестостероном и гормоном D в организме наблюдаются достоверные эффекты физиологического синергизма в отношении влияния на саркопению и инсулинорезистентность, углеводный, липидный и пуриновый обмен.
Учитывая огромную палитру биологических эффектов витамина D, его участие в углеводном, жировом, пуриновом обмене, анаболическое, антипролиферативное, иммуномодулирующее действие, необходимость восполнения его дефицита не может подвергаться сомнению. В то же время безопасность применения препаратов витамина D у пациентов с МКБ до сих пор дискутируется в урологическом сообществе. Причина – предположительная роль витамина D в формировании кальциевых камней. Среди патофизиологических механизмов формирования кальциевых (в первую очередь кальций-оксалатных) камней самый распространенный – гиперкальциурия, она выявляется у 30–60% взрослых с данным видом уролитиаза [6]. Витамин (гормон) D совершенно необоснованно «обвиняется» некоторыми урологами в развитии и прогрессировании гиперкальциурии.
С возрастом уровень промежуточного метаболита витамина D (25(OH)D) снижается как у мужчин, так и у женщин [29], что обусловлено уменьшением количества времени, проводимого на солнце (вследствие чего замедляется синтез витамина D в коже), недостаточным потреблением витамина D с пищей, а также снижением функции почек, что ведет к уменьшению образования активной формы гормона D. Если, согласно теории витамин D-зависимой гиперкальциурии, считать гормон D (активный метаболит витамина D) одним из ключевых компонентов патогенеза кальциевого уролитиаза, то возрастное снижение его синтеза должно приводить к снижению заболеваемости МКБ. Однако, согласно статистическим данным, в повседневной практике этого не происходит. Более того, высокая распространенность дефицита витамина D и недостаточная его коррекция, по данным эпидемиологических исследований, проведенных как в странах Запада, США, так и в России [29, 30], сочетаются с ростом заболеваемости МКБ по всему миру [3].
В поддержку теории витамин D-независимой гиперкальциурии выполнено достаточное количество убедительных экспериментальных исследований, показывающих влияние генетического фактора на формирование кишечной гиперабсорбции кальция и развитие гиперкальциурии. Несколько исследований на специальной популяции крыс с МКБ и гиперкальциурией продемонстрировали нормальные концентрации кальция и активного метаболита витамина D (1,25(ОН)2D), повышение его кишечной абсорбции с кальциевыми камнями в мочевых путях [31, 32], повышенную резорбцию костной ткани и снижение реабсорбции кальция почками [31, 33]. При изучении концентрации и метаболизма витамина D у пациентов с кальциевым уролитиазом не было установлено патофизиологической роли витамина D и его метаболитов в формировании кальциевых конкрементов [34, 35]. Более того, у многих пациентов с МКБ имелась недостаточность или даже дефицит витамина D и снижение костной плотности [36, 37].
В настоящее время практически отсутствуют какие-либо сомнения в безопасности применения витамина D в качестве профилактики или лечения его недостаточности и дефицита. Длительный ежедневный прием высоких доз витамина D здоровыми взрослыми людьми не приводил ни к гиперкальциемии, ни к увеличению экскреции кальция с мочой [38, 39]. Более того, у пациентов с недостаточностью или дефицитом витамина D намного чаще встречались повышенная экскреция камнеобразующих веществ (кальция, мочевой кислоты, оксалатов), сниженная экскреция цитрата калия (основного солюбилизатора мочи), а также недостаточный объем выделяемой мочи, который считается фактором риска уролитиаза [37].
Похожие данные в отношении метаболических факторов риска МКБ были получены при изучении влияния инсулинорезистентности на фоне метаболического синдрома на экскрецию камнеобразующих веществ у пациентов с кальциевыми камнями. Как установили A. Cupisti и соавт., уровень инсулинорезистентности (определенный при помощи индекса HOMA) обратно коррелировал с экскрецией цитрата (основного солюбилизатора мочи, препятствующего формированию кальций-оксалатных камней) [40]. Интересны результаты, которые приводят R.A. DeFronzo и соавт. При обследовании здоровых молодых добровольцев и используя эугликемический гиперинсулинемический клэмп-тест, ученые показали, что гиперинсулинемия увеличивает экскрецию кальция с мочой примерно на 60% без всяких изменений его концентрации в плазме или скорости клубочковой фильтрации [41]. Есть сообщения о положительной корреляции между ожирением и экскрецией кальция и оксалатов и отрицательной – между ожирением и экскрецией цитрата [38, 42, 43].
В настоящее время можно смело утверждать, что метаболическая терапия, включающая в себя коррекцию гормональных и метаболических (биохимических) нарушений, выходит на первый план в лечении МКБ. В век профилактической медицины основная цель – не столько купировать острое состояние и не допустить рецидива заболевания, сколько предотвратить развитие болезни путем первичной профилактики. Среди основных задач консервативного лечения, а также первичной и вторичной профилактики МКБ – борьба с нарушенной кислотностью мочи, нарушениями пуринового обмена (гиперурикемией и гиперурикозурией), поддержание положительного кальциевого баланса в организме, что может быть достигнуто повышением всасывания кальция из кишечника, снижением его экскреции и уменьшением избыточной резорбции костной ткани, а также компенсацией дефицита микроэлементов (в первую очередь магния).
Повышенная кислотность мочи (pH ≤ 5,8) в нескольких порциях мочи – повод для серьезного беспокойства. Может возникнуть необходимость проведения ощелачивающей терапии с использованием цитратных смесей. Наиболее изученный и эффективный препарат цитратной смеси, зарегистрированный в России, – Блемарен. Дозировка цитратной смеси подбирается индивидуально, согласно корректировке колебаний pH мочи в течение суток. Терапия цитратными смесями – способ быстрой и безопасной коррекции повышенной кислотности мочи, позволяющий добиться хорошего ощелачивающего эффекта, что крайне необходимо таким пациентам в рамках комплексной метаболической терапии. При этом врачу и пациенту важно понимать, что в основе нормализации pH лежит коррекция инсулинорезистентности, которая достигается изменением образа жизни и характера питания, назначением специфической терапии препаратом метформина и, самое главное, ликвидацией дефицита гормонов (в первую очередь тестостерона и витамина D). Коррекция дефицита тестостерона и витамина D у пациентов с МКБ не только улучшает антропометрические показатели и лежит в основе борьбы с саркопенией и ассоциированной с ней инсулинорезистентностью, но и может быть ключом к решению проблемы МКБ у таких пациентов, учитывая тесную этиопатогенетическую взаимосвязь этих состояний.
D.A. Gusakova, S.Yu. Kalinchenko, I.A. Tyuzikov
N.A. Lopatkin Scientific Research Institute of Urology and Interventional Radiology – Branch of National Medical Research Radiological Center of the Ministry of Healthcare of the Russian Federation, Moscow
Clinic of Professor Kalinchenko, Moscow
Peoples’ Friendship University of Russia, Moscow
Contact person: Darya Aleksandrovna Gusakova, dariagusakova@gmail.com
Urolithiasis is a very pressing problem of modern urology. Approximately in 50% of cases the disease is of recurrent in nature, which may indicate failure of treatment and prevention, taking place in the urology hospitals and through outpatient care to patients with urolithiasis. This fact indicates the necessity to develop preventive measures, taking into account the pathogenesis of this disease. We can say that metabolic therapy including correction of hormonal and metabolic (biochemical) disorders, comes to the fore in the treatment of urolithiasis. Among the main aims of conservative treatment as well as in primary and secondary prevention urolithiasis are the struggle with abnormal acidity of urine, disorders of purine metabolism (hyperuricemia and hyperuricosuria), maintaining positive calcium balance in the body, and the compensation of micronutrient deficiency (especially magnesium). Correction of testosterone deficiency and vitamin D in patients with urolithiasis not only improves anthropometric indices and appears to be the basis of combating sarcopenia and associated with it insulin resistance, but also can become the key to the solution of the problems of urolithiasis in such patients, taking into account the close etiopathogenic relationships of these conditions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.