Применение ривароксабана в ортопедии (по результатам исследований RECORD)
- Аннотация
- Статья
- Ссылки
Тромбоз глубоких вен развивается, как правило, в венах голени. В 10–20% случаев тромбы нарастают по направлению к проксимальным отделам, и в 1–5% возникает летальная тромбоэмболия легочной артерии (ТЭЛА) [16]. По данным клиники травматологии, ортопедии и ВПХ РГМУ, ТЭЛА явилась непосредственной причиной смерти каждого четвертого умершего больного с повреждением опорно-двигательного аппарата [1].
Своевременно проведенная тромбопрофилактика позволяет снизить риск тромботических осложнений в несколько раз. Среди препаратов для тромбопрофилактики в согласованных руководствах рекомендуются низкие дозы нефракционированного гепарина (НФГ), низкомолекулярные гепарины (НМГ), фондапаринукс и антагонисты витамина К [9, 14, 18]. Каждый из этих препаратов имеет ограничения в использовании. Так, гепарины и фондапаринукс, которые эффективно сокращают количество случаев тромбоэмболии, вводятся подкожно, и стоимость лечения окупается, только если сами пациенты или ухаживающие за ними лица могут делать инъекции на дому.
Антагонисты витамина K (например, варфарин) могут взаимодействовать с различными продуктами питания и лекарственными препаратами. Их применение требует постоянного наблюдения, мониторинга коагулограммы и потому отличается большой сложностью [22, 19].
С другой стороны, продолжительная профилактика тромбоэмболии после эндопротезирования снижает частоту развития ВТЭ, однако она нечасто проводится вне стационара. Так, по данным большого регистра, менее чем у 50% пациентов профилактика проводилась в течение 28 дней [21].
Клиническая значимость длительной профилактики нередко воспринимается врачами скептически, их в большей степени беспокоит потенциальный риск побочных эффектов, в частности, кровотечений [17].
В этой связи для того чтобы оптимизировать тромбопрофилактику в ортопедии, необходимо решить такие проблемы, как выбор эффективного и безопасного антикоагулянта с возможностью применять его достаточное количество времени, в том числе и после выписки пациента из стационара.
Такой «идеальный» антикоагулянтный препарат должен обладать следующими характеристиками: это пероральная форма применения, отсутствие значимых лекарственных и пищевых взаимодействий, широкое терапевтическое окно, низкий риск кровотечений и отсутствие необходимости в постоянном контроле показателей крови, преимущественное воздействие на один фактор свертываемости крови [5].
В настоящее время разрабатываются несколько антикоагулянтов, направленных на подавление отдельных факторов свертывания, включая тромбин и активированный фактор Х (фактор Ха).
Ривароксабан (Ксарелто, Bayer HealthCare) – первый в группе прямой ингибитор фактора Ха для приема внутрь. В исследованиях in vitro установлено, что он является мощным конкурентным ингибитором фактора Ха с Ki 0,4 нмоль/л. Препарат высокоселективен к фактору Ха и обладает ингибирующим эффектом, более чем в 10 000 раз превосходящим таковой у соответствующих сериновых протеаз. По данным исследований in vivo, у животных с установленной ВТЭ ривароксабан ингибирует активность фактора Ха при его применении в дозах, которые не увеличивают время кровотечения в значительной мере [15]. Препарат не влияет на агрегацию тромбоцитов и тромбоцитарный гемостаз.
В исследованиях II фазы установлены потенциальная безопасность и эффективность широкого диапазона доз ривароксабана для тромбопрофилактики после больших ортопедических операций [20, 3]. Эффективность и безопасность общих суточных доз ривароксабана от 5 до 20 мг после эндопротезирования тазобедренного или коленного сустава соответствовали аналогичным показателям эноксапарина. Последующее исследование показало, что ривароксабан достаточно эффективен и безопасен в дозе 10 мг 1 раз в сутки, поэтому такая доза и стала применяться в дальнейших исследованиях эффективности тромбопрофилактики [7].
Биодоступность ривароксабана при приеме внутрь составляет около 80%, а пик его концентрации в плазме достигается через 2,5–4 ч. В фармакокинетических исследованиях отмечена прямая линейная зависимость «доза – концентрация – эффект», также он не имеет значительной вариабельности в фармакокинетике в зависимости от пола, возраста и этнической принадлежности. Препарат не накапливается при приеме повторных доз, его можно применять независимо от приема пищи. Ривароксабан минимально взаимодействует с другими лекарственными средствами при их одновременном назначении. Он сохраняет эффективность при крайних значениях массы тела. Треть препарата выводится почками в неизмененном виде, 2/3 метаболизируется в печени с образованием неактивных метаболитов, которые в равных частях выводятся с желчью и почками.
Ривароксабан был изучен в исследованиях II фазы (серия исследований ODIXa) и послуживших основой для регистрации препарата исследованиях III фазы (серия исследований RECORD). В 4 международных многоцентровых рандомизированных контролируемых клинических исследованиях RECORD (Regulation of Coagulation in Orthopaedic Surgery to Prevent Deep Vein Thrombosis and Pulmonary Embolism) была изучена эффективность ривароксабана в сравнении с эноксапарином, вводимым подкожно с целью тромбопрофилактики, у 12 500 пациентов после планового эндопротезирования тазобедренного или коленного сустава. Все исследования имели сходный дизайн (международные многоцентровые рандомизированные двойные слепые исследования), компаратор, критерии эффективности и безопасности [6].
Эноксапарин был выбран как «золотой стандарт» тромбопрофилактики, в том числе и в ортопедии. В исследованиях RECORD 1–3 эноксапарин применялся в «европейской» дозе 40 мг один раз в день (такая же дозировка зарегистрирована для применения в России). В исследовании RECORD 4 доза эноксапарина составляла 30 мг два раза в день в соответствии с американскими рекомендациями.
В качестве первичного критерия эффективности во всех исследованиях RECORD была выбрана венозная тромбоэмболия (сочетание бессимптомного тромбоза глубоких вен, подтвержденного данными венографии, нелетального симптомного ТГВ, нелетальной тромбоэмболии легочной артерии (ТЭЛА) и смерти вследствие всех причин); вторичным критерием эффективности являлась тяжелая ВТЭ (комбинация проксимального ТГВ, ТЭЛА и смерти вследствие ВТЭ). Первичная точка безопасности была представлена как частота больших кровотечений, дополнительная – частота любых кровотечений.
В качестве обследования пациентам проводилась обязательная двусторонняя венография, а для верификации ТЭЛА проводились спиральная компьютерная томография, вентиляционно-перфузионная сцинтиграфия или ангиография легких.
Все исследования были проведены в соответствии с этическими положениями, изложенными в Хельсинкской декларации, и местным законодательством. Протоколы были одобрены экспертными советами каждого центра, от всех пациентов перед рандомизацией было получено письменное информированное согласие. Разработку дизайна исследований и его контроль осуществлял специальный комитет.
Исследование RECORD 1
В исследование были включены взрослые пациенты обоего пола, которым предстояло плановое эндопротезирование тазобедренного сустава. Не включались пациенты с последовательным двусторонним эндопротезированием суставов, беременные и кормящие грудью, с активным кровотечением или высоким риском кровотечения, с противопоказаниями к назначению эноксапарина или состояниями, требовавшими коррекции дозы эноксапарина. К критериям исключения относились также состояния, препятствующие проведению двусторонней венографии, выраженные заболевания печени, тяжелая почечная недостаточность (клиренс креатинина менее 30 мл/мин), сопутствующее применение ингибиторов протеаз для лечения ВИЧ, планируемая периодическая пневматическая компрессия или необходимость проведения антикоагулянтной терапии [8].
До хирургического вмешательства пациенты были разделены на две группы при помощи электронной блочной рандомизации. В одной группе был назначен ежедневный однократный прием ривароксабана в таблетках по 10 мг. Прием ривароксабана был начат через 6–8 ч после закрытия операционной раны. В другой группе эноксапарин натрия вводился однократно в день подкожно в дозе 40 мг (Клексан/Ловенокс, Sanofi Aventis). Введение эноксапарина начинали за 12 ч до операции и вновь возобновляли через 6–8 ч после завершения хирургического вмешательства. В дальнейшем исследуемые препараты вводились каждые 24 ч (диапазон 22–26 ч) по вечерам в течение 35 дней (диапазон 31–39 дней) после операции (день операции определялся как день 1). Пациенты также получали плацебо в виде таблеток или инъекций.
Обязательная двусторонняя венография по методу Рабинова и Полина (Rabinov and Paulin technique) проводилась у всех пациентов на следующий день после приема последней дозы исследуемого препарата, то есть на 36-й день (диапазон 30–42 дня). После венографии пациенты не получали препараты в рамках исследования, однако дальнейшая профилактика тромбоэмболии могла быть продолжена по усмотрению исследователя. Контрольный осмотр пациентов проводился с 30-го по 35-й день с момента получения последней дозы исследуемого препарата.
При подозрении на ТЭЛА проводились спиральная компьютерная томография, вентиляционно-перфузионная сцинтиграфия или ангиография легких; полученные снимки отправляли на рассмотрение в центральный оценочный комитет. В случае смерти пациента обязательным условием было проведение аутопсии.
Оценка всех показателей исследования была проведена центральным оценочным комитетом, члены которого не имели информации о распределении пациентов по группам.
Основным показателем для оценки безопасности была частота серьезных кровотечений, начиная с момента приема первой дозы исследуемого препарата и до 2 суток после последней (период применения). Серьезным считалось кровотечение, приводящее к летальному исходу, кровоизлияние в жизненно важный орган, кровотечение, ведущее к повторной операции, кровотечение, требующее отмены терапии, клинически явное кровотечение, которое вызывало снижение уровня гемоглобина минимум на 2 г/дл, или кровотечение, требующее переливания двух или более единиц крови либо эритроцитарной массы.
Другие показатели безопасности включали случаи любых кровотечений в период лечения, случаи малых кровотечений в период лечения, геморрагические раневые осложнения (совокупный показатель обширной раневой гематомы и кровотечения из операционной раны), любое кровотечение, начавшееся после приема первой пероральной дозы ривароксабана или плацебо и завершившееся не позднее 2 дней после приема последней дозы, побочные эффекты и случаи летального исхода.
В ходе исследования и последующего наблюдения определялись лабораторные параметры, включая активность ферментов печени, и сердечно-сосудистые осложнения. Сердечно-сосудистые осложнения, развившиеся не позднее 1 дня после прекращения приема исследуемого препарата, квалифицировались как случаи, произошедшие в период лечения.
В анализ безопасности были включены данные всех пациентов, получивших хотя бы одну дозу исследуемого препарата. Пациентов включали в оценку случаев тяжелого ТГВ, если состояние проксимальных вен могло быть оценено при венографии, независимо от того, были ли доступны оценке дистальные вены. Основной анализ эффективности по принципу «не уступает» был проведен в популяции «по протоколу»; анализ по принципу «превосходит» – в модифицированной популяции в зависимости от назначенного лечения. Разница по частоте показателей в группах ривароксабана и эноксапарина была вычислена с использованием стратификации по странам, с помощью критерия Мантеля – Хэнзеля с доверительным интервалом (95%-ный ДИ). При оценке по принципу «не уступает» и по принципу «превосходит» был использован 95%-ный ДИ.
За период с февраля 2006 г. по март 2007 г. в исследование был набран 4591 пациент в 27 странах мира. Из них 3029 пациентов составили популяцию «по протоколу» и 3153 были включены в модифицированную популяцию в зависимости от назначенного лечения. Причины исключения из различных анализов были сопоставимыми в обеих группах. Демографические и хирургические характеристики также были сравнимы в обеих группах. Средняя продолжительность профилактики составила 33,4 дня в группе ривароксабана и 33,7 дня в группе эноксапарина (группа оценки безопасности).
В исследовании RECORD 1 проводилась начальная оценка по принципу «не хуже», которая продемонстрировала, что эффективность ривароксабана не уступает таковой эноксапарина (р < 0,001) в популяции пациентов «по протоколу», затем уже проводилась оценка по принципу «превосходит» в модифицированной в зависимости от назначенного лечения популяции пациентов (то есть пациентам, которым произведено плановое вмешательство и получавшим лечение в рамках исследования, проведено адекватное обследование на предмет выявления ВТЭ).
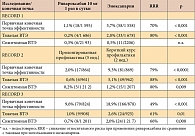
При анализе частоты достижения первичной конечной точки эффективности установлено, что применение ривароксабана способствовало снижению относительного риска возникновения ВТЭ на 70% (р < 0,001) по сравнению с таковым при использовании эноксапарина (табл. 1). Еще большее снижение относительного риска отмечено при анализе вторичной конечной точки эффективности в отношении тяжелой ВТЭ – на 88% (р < 0,001).
Вторичная конечная точка в исследованиях RECORD предусматривала оценку снижения частоты развития симптомной ВТЭ. Наблюдаемая частота симптомной ВТЭ была схожей в группе ривароксабана и в группе эноксапарина (0,3% и 0,5% соответственно) (табл. 1).
Таким образом, данные исследования RECORD 1 демонстрируют более высокую эффективность терапии 10 мг ривароксабана внутрь в сравнении с 40 мг эноксапарином подкожно в снижении риска общей ВТЭ и тяжелой ВТЭ у взрослых пациентов, подвергающихся плановому эндопротезированию тазобедренного сустава.
При использовании ривароксабана и эноксапарина наблюдалось сопоставимое число побочных эффектов.
Более высокая эффективность ривароксабана не сопровождалась значимым увеличением частоты серьезных и других видов кровотечений. Случаи серьезных кровотечений наблюдались у 6 (0,3%) из 2209 пациентов в группе ривароксабана и у 2 (0,1%) из 2224 – в группе эноксапарина.
Частота повышения активности ферментов печени была сопоставимой в двух группах на протяжении 5-недельного периода применения препаратов.
Исследование RECORD 2
Целью исследования было оценить продленную тромбопрофилактику ривароксабаном в течение 31–39 дней в сравнении с краткосрочной профилактикой эноксапарином (10–14 дней) с последующим приемом плацебо у пациентов после эндопротезирования тазобедренного сустава [11, 10].
Набор пациентов в данное международное рандомизированное двойное слепое плацебоконтролируемое исследование осуществлялся в период с февраля 2006 г. по апрель 2007 г. в 123 центрах в 21 стране мира. В исследование включали пациентов в возрасте от 18 лет и старше, которым было назначено плановое эндопротезирование тазобедренного сустава. Критерии исключения были аналогичны используемым в исследовании RECORD 1.
До операции пациенты были случайным образом распределены в исследуемые группы путем блочной рандомизации. С помощью двойного слепого метода пациентам был назначен ежедневный однократный прием таблеток ривароксабана 10 мг внутрь или 40 мг эноксапарина натрия подкожно. Прием ривароксабана был начат через 6–8 ч после закрытия операционной раны и продолжался в течение 31–39 дней; пациенты также получали инъекции плацебо в течение 10–14 дней, начиная за 12 ч до операции. Введение эноксапарина было начато за 12 ч до операции и вновь возобновлялось через 6–8 ч после завершения вмешательства, период лечения составил 10–14 дней; пациенты также получали таблетки плацебо в течение 31–39 дней, начало приема – через 6–8 ч после закрытия операционной раны.
День операции определялся как день 1. Обязательная двусторонняя венография проводилась у всех пациентов на следующий день после приема последней дозы исследуемого препарата, то есть на 32–40-й день. После венографии они не получали исследуемых препаратов, дальнейшая тромбопрофилактика проводилась по усмотрению врача-исследователя. Пациенты находились под наблюдением в течение 30–35 дней с момента приема последней дозы исследуемого препарата.
Статистический анализ проводился по тем же принципам, что и в исследовании RECORD 1.
Исследование RECORD 2 показало, что более длительная схема тромбопрофилактики с использованием ривароксабана 10 мг внутрь оказалась значительно эффективнее короткого курса тромбопрофилактики с применением эноксапарина 40 мг подкожно и обеспечила снижение относительного риска возникновения ВТЭ на 79% – при анализе первичной конечной точки эффективности (р < 0,001). Еще большее снижение относительного риска ВТЭ наблюдалось при анализе вторичной конечной точки эффективности частоты тяжелой ВТЭ – 88% (р < 0,001).
Использование более длительной схемы профилактики на основе ривароксабана оказалось существенно эффективнее короткой схемы на основе эноксапарина в предотвращении симптомных осложнений (снижение относительного риска на 80%, р = 0,009). Результаты исследования свидетельствуют, что длительное применение антикоагулянтов может обеспечить клинически значимое снижение частоты возникновения симптомной ВТЭ у взрослых пациентов, подвергшихся плановому протезированию тазобедренного сустава.
Серьезное кровотечение было зарегистрировано у одного пациента из каждой группы. Геморрагические раневые осложнения, включавшие обширную раневую гематому и кровотечения из операционной раны, наблюдались у сходного числа пациентов в обеих группах.
Во время лечения послеоперационная частота повышения активности аланинаминотрансферазы в плазме более чем в 3 раза относительно верхней границы нормы была низкой в обеих группах, показатели нормализовались к концу лечения. Данное повышение не было вызвано применяемыми антикоагулянтами, а обусловлено причинами, связанными с операцией (анестезия, антибактериальная терапия, сама операция и др.). Частота сердечно-сосудистых осложнений была низкой.
Исследование RECORD 3
Целью исследования было оценить эффективность ривароксабана по сравнению с эноксапарином для профилактики венозного тромбоза после эндопротезирования коленных суставов [12, 13].
В исследовании участвовали взрослые пациенты обоего пола, которым планировалось выполнить эндопротезирование коленного сустава.
До операции пациенты были рандомизированы на группы, в одной из которых больные получали ривароксабан внутрь в дозе 10 мг 1 раз в сутки, в другой – эноксапарин натрий подкожно в дозе 40 мг 1 раз в сутки. Лечение эноксапарином начинали за 12 ч до операции, следующую дозу препарата вводили через 6–8 ч после закрытия раны. Прием ривароксабана начинали через 6–8 ч после операции. Впоследствии исследуемый препарат больным давали каждые 24 ч.
День операции считался 1-м днем исследования. Прием исследуемых препаратов продолжали минимум до 10-го и максимум до 14-го дня. Между 11-м и 15-м днем больным обязательно выполняли двустороннюю венографию. После венографии лечение исследуемыми препаратами прекращали. После приема последней дозы препарата пациентов наблюдали в течение 30–35 дней.
За период с февраля 2006 г. по ноябрь 2006 г. в 147 центрах в 19 странах для участия в исследовании были набраны 2556 больных. Причины исключения пациентов в группах лечения ривароксабаном и эноксапарином были одинаковы. Группы были хорошо сбалансированы по исходным характеристикам, за исключением небольшого преобладания женщин в группе ривароксабана (р = 0,03). Средняя продолжительность лечения ривароксабаном составила 11,9 дня, эноксапарином – 12,5 дня.
Применение ривароксабана обеспечило снижение относительного риска возникновения ВТЭ, по данным анализа первичной конечной точки, по сравнению с таковым при использовании эноксапарина на 49% (р < 0,001), при анализе вторичной конечной точки эффективности в отношении частоты тяжелой ВТЭ снижение относительного риска составило 61% (р = 0,01).
Снижение относительного риска возникновения симптомной ВТЭ в исследовании RECORD 3 при применении ривароксабана по сравнению с эноксапарином составило 66% (р = 0,008). Частота выявления симптомной ВТЭ в период наблюдения была несколько больше при назначении ривароксабана, чем эноксапарина (соответственно 0,4 и 0,2%), хотя эти различия недостоверны (р = 0,44). В исследовании было впервые показано, что применение антикоагулянтов способствовало клинически значимому уменьшению частоты симптомной ВТЭ у взрослых пациентов, подвергшихся плановому протезированию коленного сустава.
Характеристики нежелательных явлений в процессе лечения ривароксабаном и эноксапарином были сопоставимыми. Между двумя группами не установлено клинически значимых различий по частоте кровотечений или другим показателям безопасности.
В 2011 г. был проведен систематический обзор эффективности ривароксабана по сравнению с эноксапарином для предупреждения венозной тромбоэмболии после эндопротезирования коленного или тазобедренного сустава. Был произведен поиск отчетов по рандомизированным контролируемым исследованиям по сравнению ривароксабана и эноксапарина для профилактики тромбоэмболии после эндопротезирования коленного или тазобедренного сустава в библиотеках Cochrane, Embase, PubMed, базе данных Ovid, китайских базах данных, в том числе VIP, CNKI, и CBM. Было проанализировано восемь рандомизированных контролируемых исследований, в которых приняли участие 15246 пациентов. Было показано, что пероральный прием 10 мг ривароксабана был более эффективен, чем подкожное введение эноксапарина в дозе 40 мг 1 раз в день или 30 мг 2 раза в день, назначенного после эндопротезирования по предотвращению венозной тромбоэмболии (p < 0,0001, RR = 0,38 и р = 0,05, RR = 0,77 соответственно). Существенных различий между ривароксабаном и эноксапарином в количестве больших послеоперационных кровотечений не наблюдалось (p = 0,45, RR = 1,31 и р = 0,34, RR = 1,61 соответственно). В отношении других исходов ривароксабан был сопоставим с эноксапарином. Дополнительно было показано: пролонгированная профилактика ривароксабаном (более 30 дней) является более эффективной в предотвращении венозной тромбоэмболии, чем краткосрочная терапия эноксапарином (15 дней) (1,36% против 10,13%).
Таким образом, ривароксабан показал превосходящую эффективность по сравнению с эноксапарином в крупных рандомизированных международных исследованиях при сопоставимом количестве кровотечений. Ривароксабан (Ксарелто) зарегистрирован в 100 странах, в России – в 2009 г. и уже начал с успехом применяться во многих российских клиниках. Дальнейшие изучение и применение препарата позволят предотвратить опасные тромботические осложнения у ортопедических пациентов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.