Применение таргетной терапии в лечении больных гепатоцеллюлярным раком
- Аннотация
- Статья
- Ссылки
В 2007 г. в мире было вновь зарегистрировано более 700 000 больных первичным раком печени (ПРП). Заболеваемость первичным раком составляет 5,7% и занимает 6-е место среди всех регистрируемых случаев рака (5-е место у мужчин (7,6%) и 8-е место у женщин (3,6%)). Наибольшая заболеваемость отмечается в Юго-Восточной Азии – Китае (55% от всех заболевших в мире), Японии, а также в странах Африки (в Мозамбике ПРП составляет 65% от всех опухолей у мужчин и 31% у женщин).
Заболеваемость ПРП практически равна смертности, соотношение числа умерших больных от ПРП ко вновь регистрируемым пациентам в мире равно 0,95. В 2007 г. в мире умерли почти 680 000 больных. В структуре онкологических смертей ПРП находится на 3-м месте (10,9% у мужчин и 6,2% у женщин). Россия по показателям смертности от ПРП занимает 9-е место в Европе и 31-е место в мире. На долю ПРП в структуре смертности в России приходится 2,9% у мужчин и 2,8% – у женщин [1, 2]. В России число ежегодно умирающих от ПРП превышает количество вновь регистрируемых пациентов. Объяснением этого может служить включение в когорту умерших от ПРП всех больных с билиарными опухолями [3].
90% случаев ПРП составляет гепатоцеллюлярный рак (ГЦР), он занимает ведущее место среди злокачественных опухолей печени у взрослых. ГЦР – это болезнь генов. Микроаррей-технология позволила охарактеризовать молекулярные изменения в клетках печени при ПРП. Многочисленные хромосомные аберрации, обнаруженные в них, являются доказательствами геномной нестабильности и генной деградации. Амплификация была обнаружена в 57% случаев в 1q, в 46,6% случаев – в 8q, в 22% – в 6р и в 22,2% – в 17q. Делеция зарегистрирована в 38% случаев в 8р, в 5,9% – в 16q, в 33% – в 4q, в 32,1% – в 17р и в 13,2% – в 13q. Делеции в основном связаны с вирусным гепатитом В (ВГВ). Хромосомные аберрации возникают чаще в месте экспрессии генов MYC и RB1.
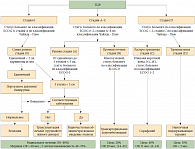
Вирус гепатита C влияет на сигнальный путь гена MAPK, изменяя темпы пролиферации клеток. При вирусном гепатите С (ВГС) часто мутированы гены P53 и PIK3A [4–6]. В процессе гепатоканцерогенеза участвуют такие факторы роста, как IGF-1, IGF-2, TGF-альфа и TGF-бета, EGFR и VEGF. Повышенно экспрессируемые при ГЦР, они усиливают клеточную пролиферацию и предотвращают апоптоз. Различают особенно злокачественный фенотип ГЦР при экспрессии стволовыми опухолевыми клетками (прогениторами ГЦР) цитокератинов 7-го и 19-го типов. Эти больные имеют наихудший прогноз, у них наблюдаются высокий уровень альфа-фетопротеина (АФП) в крови и частое рецидивирование болезни [7]. Пациенты с неоперабельным и распространенным опухолевым процессом (промежуточная стадия) подвергаются паллиативной локорегионарной и/или системной терапии. Медиана выживаемости этих больных колеблется в диапазоне 6–26 мес. (рис.) [8].
Химиотерапия ГЦР
Гепатоцеллюлярный рак малочувствителен к химиотерапии, это объясняют гиперэкспрессией гена множественной лекарственной устойчивости в гепатоцитах. Проблема использования химиотерапии при ГЦР также связана с сосуществованием по сути двух заболеваний – рака и цирроза печени. Цирроз печени может нарушать метаболизм химиотерапевтических препаратов и повышать их токсичность. Кроме того, некоторые осложнения химиотерапии, такие как системные инфекции, протекают в особенно тяжелой форме у пациентов с ГЦР. Было показано, что химиотерапевтические агенты обладают скромным противоопухолевым эффектом [9–12]. Доксорубицин был оценен более чем у 1000 пациентов в клинических исследованиях – с объективным ответом около 10%. В исследовании на 446 больных были изучены нолатрексед, ингибитор тимидилат-синтазы, и доксорубицин. Получены отрицательные результаты применения этих препаратов: медиана выживаемости 5 и 7,5 мес. соответственно, а эффективность доксорубицина составила лишь 4%.
Другие химиотерапевтические препараты, такие как гемцитабин, оксалиплатин, цисплатин и капецитабин, используются в качестве монотерапии или в комбинациях. Их действие изучено при проведении неконтролируемых исследований – с уровнем объективных ответов от 0% до 18% [10]. В большом рандомизированном клиническом исследовании сравнили режим PIAF и монотерапию доксорубицином. Уровень объективного ответа составил 20,9% и 10,5% соответственно, а медиана выживаемости – 8,67 и 6,83 мес. соответственно, без достоверных статистических различий между группами [12]. При этом следует отметить высокую смертность пациентов, ассоциированную с комбинированным лечением, – 9% в результате реактивации вируса гепатита и печеночной недостаточности.
В азиатском исследовании сравнивали эффективность режима FOLFOX и терапии доксорубицином. В исследование был включен 371 пациент с ГЦР на стадии А/В по классификации Чайлда – Пью и промежуточной стадии. Отмечена незначительная тенденция в пользу группы FOLFOX (медиана выживаемости 6,4 мес. по сравнению с 4,9 мес., р = 0,07) [13]. Таким образом, с учетом имеющихся данных, системная химиотерапия не рекомендуется для лечения пациентов с гепатоцеллюлярной карциномой. В настоящее время продолжаются исследования III фазы, в рамках которых изучается эффективность комбинации химиотерапии с сорафенибом.
Современные подходы к терапии ГЦР
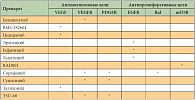
Из вышесказанного очевидно, что проблема системного лечения распространенного ГЦР требует активного изучения. Основные надежды в этой области связаны с применением целевой терапии, оказывающей влияние на генные мишени. В последние годы в арсенал онкологов вошли около 20 препаратов молекулярной целевой терапии, предназначенные для лечения больных раком молочной железы, раком толстой кишки, немелкоклеточным раком легкого, раком почки и ГЦР [14, 15]. Мультикиназный ингибитор сорафениб показал преимущество в выживаемости у пациентов с ГЦР [16], что явилось настоящим прорывом в лечении этого сложного заболевания и доказало, что молекулярная терапия может быть эффективной при ГЦР (табл. 1).
Следует отметить, что понимание молекулярного механизма гепатоканцерогенеза имеет решающее значение для определения новых целей таргетной терапии [4, 17, 18]. В гепатоканцерогенезе не существует патогномоничного молекулярного механизма или одного доминирующего пути, и это объясняет, почему один целевой агент не будет приводить к достижению устойчивого ответа при ГЦР. Следовательно, можно предположить, что для прерывания стимулирующих сигналов необходимо воздействие на разных уровнях основного сигнального пути и/или подавление двух или трех различных сигнальных путей одновременно.
Гепатоканцерогенез представляет собой сложный многоступенчатый процесс, где меняются несколько сигнальных каскадов, создающих гетерогенный биологический портрет заболевания [4, 17, 18]. Для любого подкласса ГЦР было определено несколько сигнальных путей, ответственных за опухолевую прогрессию и диссеминацию.
Сосудистый фактор роста (VEGF) является краеугольным камнем ангиогенеза при ГЦР [19, 20]. На прерывание этого сигнального пути направлены либо моноклональные антитела (бевацизумаб – на VEGFR), либо ингибиторы внутриклеточного тирозинкиназного каскада – малые молекулы, такие как сорафениб, сунитиниб, бриваниб, линифаниб, ваталаниб, цедираниб и др. Другими активаторами ангиогенных сигнальных путей являются Ang2 и FGF. При ГЦР отмечается гиперэкспрессия эпидермального фактора роста (EGFR) [21]. На блок EGFR-зависимого сигнального пути могут быть направлены моноклональные антитела – цетуксимаб – или малые молекулы, подавляющие внутриклеточные тирозинкиназы, – эрлотиниб, гефитиниб или лапатиниб.
Сигнальный путь Ras-МАРК может быть активирован у половины больных при раннем ГЦР и практически у всех больных при распространенном [4, 22]. Активация этого пути зависит от гиперэкспрессии лигандов и гиперметилирования промоутеров опухолевых супрессоров, вызывающих транскрипцию генов семейства AP-1, например, с-Fos и с-Jun, участвующих в пролиферации и дифференцировке [23]. Мутации KRAS при ГЦК редки, их частота составляет менее 5%. В настоящее время нет одобренных избирательных ингибиторов пути Ras/ERK/MAPK, но сорафениб и регорафениб демонстрируют частичную блокаду этого каскада [24].
PI3K/PTEN/Akt/mTOR-путь контролирует клеточную пролиферацию, клеточный цикл, апоптоз и активацию различных RTKs, таких как EGFR или IGFR, и инактивацию опухолевых супрессоров PTEN. Он активируется у 40–50% больных ГЦР [25, 26]. Несколько ингибиторов mTOR (рапамицин, темсиролимус и эверолимус) изучаются в исследованиях II и III фазы. Большой интерес исследователей вызывает путь HGF/с-MET. Нарушение регуляции рецептора с-MET и его лиганда HGF имеет решающее значение для регенерации гепатоцитов после поражения печени и расценивается как обычное явление при ГЦР [27]. Тем не менее их роль в целевой терапии требует дальнейшего изучения.
Существенную роль играет рецептор инсулиноподобного фактора роста (IGFR). При ГЦР увеличивается экспрессия IGF-1R и IGF-II, в то время как IGFR-II снижается в некоторых подгруппах ГЦР [28, 29]. Несколько IGF-1R-ингибиторов в настоящее время изучаются в ранних клинических исследованиях при ГЦР. Путь Wnt/бета-катенин имеет решающее значение для гепатоканцерогенеза [4, 17, 18, 30–32]. У трети больных ГЦР отмечается активация Wnt-сигнального пути (особенно в случаях ГЦР, обусловленных вирусом гепатита С), в результате активации мутаций в транскрипционном факторе бета-катенина [19, 30, 31], гиперэкспрессии рецепторов Frizzled или инактивации E-кадгерина или деградации комплекса (GSK3B, AXIN, adenomatosis polyposis coli (APC)) [32]. Новые соединения, блокирующие эти так называемые не поддающиеся лекарственному воздействию (англ. undrugable) пути, находятся на ранней стадии клинических исследований.
В определении роли целевой терапии необходимо также учесть такие внутриклеточные сигнальные пути, как вне- и внутримитохондриальные пути апоптоза, путь Hedgehog, сигнальный путь JAK/STAT, TGF-бета и NFk-b опосредованный путь, путь Notch, убиквитин-протеасомный путь, а также значение микроокружения опухоли. Потенциальная роль недавно описанных сигнальных путей в качестве возможных молекулярных мишеней должна быть подтверждена клиническими исследованиями [33, 34].
Молекулярная целевая терапия
Гепатоцеллюлярный рак признан одним из самых устойчивых к химиотерапии типов опухолей. До 2007 г. ни один системный препарат не был рекомендован для лечения пациентов с поздними стадиями ГЦР. Первым эффективным агентом системной терапии ГЦР после 30 лет исследований стал сорафениб, который в настоящее время признан стандартом медицинской помощи для пациентов с поздними стадиями ГЦР [16]. После этого исследования около 56 молекулярных агентов в комбинации с сорафенибом проходят тестирование во II и III фазах клинических испытаний (табл. 2) [35]. Окончательные результаты этих исследований могли бы привести к изменению рекомендаций по современному лечению ГЦР. Экспертная группа по лечению ГЦР рекомендует, чтобы разработка новых молекул при ГЦР основывалась на онкогенных биомаркерах, для персонализации терапии.
Сорафениб (Нексавар) – новый мультикиназный ингибитор, обладающий активностью против нескольких тирозинкиназ (VEGFR-2, PDGFR, c-Kit) и серин-треонинкиназ (b-Raf, p38). Этот препарат направлен на два главных патологических пути, участвующих в гепатоканцерогенезе. Сорафениб блокирует ангиогенез (VEGFR-2 и PDGFR) и клеточную пролиферацию, за счет ингибирования Raf/MEK/ERK-пути происходит усиление апоптоза в опухоли, снижение пролиферативной активности [36].
В 2006 г. опубликованы результаты II фазы исследования применения сорафениба при лечении 137 больных диссеминированным ГЦР. По данным независимой экспертной оценки, в результате применения сорафениба в дозе 800 мг в сутки (суточная доза препарата была разбита на два приема по 400 мг) частичная регрессия была достигнута у 2,2% пациентов, еще у 35% – стабилизация болезни более 4 мес., время до прогрессирования составило 5,5 мес., медиана выживаемости – 9,2 мес. [37].
Опубликованные в 2007 г. результаты двойного слепого плацебоконтролируемого рандомизированного исследования SHARP подтвердили полученные ранее данные. В исследование SHARP включались больные с запущенным ГЦР, статусом ECOG PS 0–2, стадией А по классификации Чайлда – Пью, не получавшие системной терапии. В ходе исследования 299 больных получали сорафениб 400 мг дважды в день, 303 пациента – плацебо. Главной целью проведения исследования было повышение выживаемости (провести оценку и добиться статистически значимого увеличения медианы выживаемости на 3 мес. при использовании сорафениба в сравнении с плацебо) и увеличение времени до симптоматического прогрессирования. Второстепенной задачей было оценить время до прогрессирования.
У больных, получающих сорафениб, медиана времени до прогрессирования составила 5,5 против 2,8 мес. в группе плацебо, то есть время до прогрессирования увеличилось на 73% (ОР 0,58; p = 0,000007). В результате лечения у 2,3% и 0,7% больных соответственно получен объективный эффект, стабилизация заболевания отмечена у 71 и 67% пациентов соответственно [38]. В 2008 г. опубликованы предварительные данные по эффективности комбинации сорафениба с доксорубицином в сравнении с монотерапией доксорубицином. Время до прогрессирования для комбинации «сорафениб + доксорубицин» составило 8,6 мес., при монотерапии – 4,8 мес. [39].
Мы видим, что во всех исследованиях использования сорафениба при ГЦР, выполненных в мире, отмечается удлинение сроков жизни в сравнении с контрольными группами, несмотря на низкий объективный эффект. Именно на показатели выживаемости должны ориентироваться практикующие онкологи, используя этот таргетный препарат. Лечение следует продолжать до регистрации прогрессирования, оцененного с помощью критериев mRECIST.
Важным практическим аспектом является контроль над токсическими явлениями, вызываемыми сорафенибом. Частота побочных эффектов варьирует от менее 1 до 72% случаев. Побочные эффекты 3–4-й степени отмечаются реже – от 1% до 13% случаев. В исследованиях II–III фазы чаще чем в 1–2% случаев встречались только диарея (8%), слабость (4%), дерматологическая токсичность (ладонно-подошвенный синдром) (8%) 3–4-й степеней тяжести. Токсичности сорафениба не стоит бояться. Очень важно проводить профилактику, своевременное распознавание и лечение побочных эффектов при применении этих препаратов, что позволяет избежать необоснованного уменьшения дозы, грозящего снижением эффективности лечения.
Если изначальная доза сорафениба составляла 400 мг 2 раза в сутки, ее рекомендуется снижать до 200 мг 2 раза в сутки или даже до 200 мг 1 раз в сутки. Кроме того, возможен альтернативный режим дозирования 400/200 мг. Повышение дозы сорафениба до 600 мг 2 раза в сутки и до 800 мг 2 раза в сутки оказалось перспективным у пациентов с прогрессированием заболевания, регулярно получавших этот препарат в дозе 400 мг 2 раза в сутки [40].
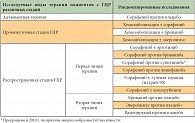
Сорафениб рекомендован Европейской группой по лечению ГЦР в качестве стандарта терапии больных с хорошей функцией печени (стадия А по классификации Чайлда – Пью) и с запущенными опухолями (BCLC C), а также для лечения больных, прогрессирующих на локорегионарной терапии. Кроме того, препарат может назначаться пациентам, стоящим в листе ожидания на трансплантацию печени, а также в комбинации с локорегионарным лечением для предотвращения диссеминации. В случае лечения больных с нарушенной функцией печени (стадия В по классификации Чайлда – Пью) однозначных рекомендаций нет, хотя в клинических исследованиях эта когорта больных (стадия В по классификации Чайлда – Пью) продемонстрировала аналогичный профиль безопасности сорафениба по сравнению с больными без нарушения функции печени (стадия А по классификации Чайлда – Пью) [41, 42]. Терапию сорафенибом следует продолжить по меньшей мере до прогрессирования, в качестве второй линии лечения можно рекомендовать терапию в рамках клинических исследований.
В настоящее время сорафениб изучают в клинических испытаниях при ранних стадиях ГЦР в качестве адъювантной терапии после резекции или радикального локального воздействия, а также у детей. Продолжаются исследования по комбинации сорафениба с хемоэмболизацией и таргетными препаратами [43]. В современной практике продолжают изучаться другие молекулярные целевые агенты, способные подавлять различные сигнальные пути. Ингибиторы mTOR, рапамицин (сиролимус) и его аналоги (темсиролимус и эверолимус) – агенты, блокирующие сигнальный каскад mTOR, – были протестированы в доклинических и ранних клинических исследованиях [44]. Эверолимус проходит испытания III фазы для второй линии лечения ГЦР.
Для лечения ГЦР были протестированы пять ингибиторов EGFR: эрлотиниб, гефитиниб, цетуксимаб, лапатиниб и вандетаниб. Эрлотиниб проявил активность в исследовании II фазы при ГЦР – медиана выживаемости составила 13 мес. [45] – и в настоящее время проходит испытания в сочетании с сорафенибом в III фазе клинических исследований. Другие препараты этого ряда либо не показали значимых результатов во второй фазе, как, например, гефитиниб и лапатиниб [46], или все еще находятся на ранних стадиях исследований.
Антиангиогенные препараты
Сунитиниб является мультитирозинкиназным ингибитором, одобренным для лечения почечно-клеточного рака, гастроинтестинальных стромальных опухолей (GIST) и нейроэндокринных опухолей. Три исследования второй фазы продемонстрировали потенциальную активность препарата при ГЦР, но выраженность нежелательных явлений и связанная с лечением смертность от тяжелой дисфункции печени у 5–10% пациентов не позволили продолжить исследования [47–49].
Бриваниб, оральный ингибитор FGFR, VEGFR и тирозинкиназ, был оценен в двух исследованиях II фазы в первой и второй линии у пациентов с запущенными опухолями. Медиана общей выживаемости составила 10 мес. в первой линии и 9,8 мес. во второй линии терапии [50]. Бриваниб в настоящее время изучается в трех исследованиях III фазы у больных ГЦР: в первой линии в сравнении с сорафенибом, во второй линии в сравнении с плацебо и в сочетании с хемоэмболизацией.
Бевацизумаб стал важным терапевтическим средством в лечении некоторых злокачественных новообразований и был одобрен для терапии колоректального рака, немелкоклеточного рака легких и молочной железы. Бевацизумаб был оценен в монотерапии [51] и в комбинации с эрлотинибом [52] или химиотерапией [53] у больных ГЦР. В монотерапии он показал объективный ответ у 10% больных с медианой времени до прогрессирования 6,5 мес. [51]. Комбинация бевацизумаба с эрлотинибом позволила добиться медианы выживаемости 15 мес. для разнородной группы больных ГЦР [52]. Комбинация бевацизумаба с химиотерапией (комбинация гемцитабина с оксалиплатином или капецитабином) позволяет получить объективный ответ у 10–20% пациентов при медиане выживаемости 9–10 мес. [53].
Линифаниб, оральный ингибитор тирозинкиназ, VEGF и PDGF, и рамуцирумаб (ramucirumab), моноклональное антитело к VEGFR2 [54], в настоящее время проходят испытания III фазы в первой и второй линиях терапии. Другие новые антиангиогенные агенты, такие как ваталаниб, аксиниб и цедираниб, находятся на очень ранней стадии изучения. Другие молекулы, такие как С-MET-ингибиторы, МЕК-ингибиторы, TGF-бета- и JAK2-ингибиторы, проходят ранние клинические исследования [35].
В заключение можно сказать, что согласно рекомендациям EASL–EORTC 2012 г. сорафениб является стандартной системной терапией ГЦР. Он предназначен для пациентов с хорошо сохранившейся функцией печени (стадия А по классификации Чайлда – Пью) и с запущенными опухолями (BCLC C) или при прогрессировании опухоли на локорегионарной терапии. При этом нет никаких клинических или молекулярных биомаркеров, позволяющих прогнозировать ответ на сорафениб. Системная химиотерапия, тамоксифен, иммунотерапия, антиандрогены и травяные препараты не рекомендуются для клинического ведения пациентов с ГЦР. В настоящее время не существует препарата для второй линии лечения пациентов с ГЦР, не отвечающих на сорафениб. В такой ситуации рекомендуется лучшая поддерживающая терапия или включение пациентов в клинические испытания. В определенных обстоятельствах может быть использована лучевая терапия для облегчения боли у пациентов с костными метастазами. Пациенты со стадией BCLC D должны получать паллиативную помощь, включающую обезболивание, питание и психологическую поддержку.
