Таргетные препараты в терапии рака толстой кишки
- Аннотация
- Статья
- Ссылки


Ингибиторы ангиогенеза
Одним из основных условий опухолевого роста и метастазирования при раке толстой кишки является наличие ангиогенеза. В экспериментальных работах показана зависимость частоты развития рецидивов рака толстой кишки от сосудистой плотности в первичной опухоли [1]. Один из основных участников процесса ангиогенеза – фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF). Фактор роста эндотелия сосудов индуцирует пролиферацию и миграцию эндотелиальных клеток сосудов, приводит к формированию новых капилляров, увеличивает проницаемость сосудистой стенки, тем самым создавая необходимые предпосылки для лучшего проникновения кислорода и питательных веществ к опухолевым клеткам [2]. VEGF активирует соответствующие рецепторы (VEGFR-1, -2 и -3), сигнал от которых проходит через различные сигнальные пути, включая Akt (протеинкиназа В) и ERK (extracellular regulated kinase – внеклеточно регулируемая киназа) [3]. Таким образом, сигнальный путь VEGF не только способствует ангиогенезу, но и играет важную роль в таких клеточных процессах, как размножение, миграция, инвазия опухолевых клеток и ингибирование апоптоза [4].
В ряде исследований, проведенных в 1990-е гг., было показано, что уровень VEGF в сыворотке крови и в опухолевой ткани больных раком толстой кишки имеет прогностическое значение. Чем выше уровень экспрессии VEGF, тем хуже прогноз [5, 6]. В настоящее время в Российской Федерации одобрены к применению три таргетных препарата, воздействующих на ангиогенез: бевацизумаб, сунитиниб и сорафениб.
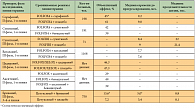
Бевацизумаб
Блокируя VEGF A, бевацизумаб приводит к быстрому снижению плотности микрососудистого русла; нормализует структурно и функционально измененные сосуды, что улучшает проникновение химиотерапевтических препаратов в опухоль; ингибирует механизмы ее неоваскуляризации [2, 7, 8]. Значение бевацизумаба в первой линии химиотерапии метастатического колоректального рака было показано в четырех ключевых рандомизированных исследованиях (табл. 1). В первом из них бевацизумаб был добавлен к химиотерапии иринотеканом и 5-фторурацилом/лейковорином в струйном режиме введения (режим IFL). Добавление бевацизумаба к IFL достоверно повысило частоту объективного эффекта и время до прогрессирования заболевания (ВДП), а также позволило увеличить медиану продолжительности жизни с 15,6 до 20,3 мес. [9].
В исследовании NO16966 больные получали комбинации FOLFOX (оксалиплатин + 5-фторурацил (5-ФУ) + фолинат кальция (лейковорин)) или XELOX (капецитабин + оксалиплатин) с добавлением или без добавления бевацизумаба. Комбинация с бевацизумабом привела к достоверному увеличению ВДП [10]. Анализ в подгруппах показал, что достоверный выигрыш наблюдался только от добавления бевацизумаба к режиму XELOX, тогда как у пациентов, получавших FOLFOX, различия во времени до прогрессирования не достигли статистической достоверности. В данном исследовании отмечено, что у половины больных приходилось завершать терапию по причинам, не связанным с прогрессированием болезни. В группе больных, которым удалось провести лечение до прогрессирования, добавление бевацизумаба привело к увеличению медианы времени до прогрессирования, независимо от режима терапии [11].
Следующим этапом были инициированы исследования по изучению эффективности бевацизумаба в адъювантной терапии рака толстой кишки. В исследование NSABP (National Surgical Adjuvant Breast and Bowel Project) С-08 было включено более 2600 больных раком толстой кишки II–III стадии. Сравнивали режимы «FOLFOX ± бевацизумаб». При медиане наблюдения 36 мес. не было показано достоверного улучшения выживаемости без признаков болезни (75,5% в группе без бевацизумаба против 77,4% в группе с бевацизумабом; р = 0,15; отношение рисков (ОР) = 0,85) [12]. В другом исследовании со схожим дизайном (AVANT (Randomized, three-arm multinational phase III study to investigate bevacizumab with either XELOX or FOLFOX4 versus FOLFOX4 alone as adjuvant treatment for colon cancer)) получены аналогичные результаты [13]. В настоящее время проводится исследование QUASAR-2 (Quick and Simple and Reliable 2) – изучение добавления бевацизумаба к капецитабину в адъювантном режиме.
Афлиберцепт
В отличие от бевацизумаба, новый препарат афлиберцепт служит «ловушкой» для нескольких ростовых факторов – всех изоформ VEGF (А и В), а также плацентарного фактора роста (placenta growth factor, PIGF). В 2011 г. были представлены результаты рандомизированного плацебоконтролируемого исследования III фазы для оценки эффективности применения афлиберцепта 4 мг/м2 во второй линии терапии больных метастатическим раком толстой кишки в комбинации с FOLFIRI (иринотекан + фторурацил + лейковорин). Было показано, что добавление антиангиогенного препарата улучшает медиану продолжительности жизни (13,50 мес. против 12,06 мес.; ОР = 0,817; р = 0,0032), медиану времени до прогрессирования (6,90 мес. против 4,67 мес.; ОР = 0,758; р = 0,00007) и увеличивает частоту достижения объективного эффекта (19,8% против 11,1%; р = 0,0001) в сравнении с комбинацией «FOLFIRI + плацебо». Из нежелательных явлений, обусловленных лечением, чаще всего отмечались диарея, астения, стоматит, артериальная гипертония, протеинурия, нейтропения.
При анализе в подгруппах обнаружено, что наибольший выигрыш в общей выживаемости отмечался у пациентов со статусом 0 по шкале ECOG (Eastern Cooperative Oncology Group – Восточная объединенная онкологическая группа) (ОР = 0,768), у больных моложе 65 лет (ОР = 0,796), с наличием в анамнезе артериальной гипертензии (ОР = 0,714) и при изолированном поражении печени (ОР = 0,649) [15]. Интересно, что препарат эффективен у пациентов независимо от того, принимали они или нет бевацизумаб в первой линии химиотерапии. Медиана продолжительности жизни в группе больных, получавших бевацизумаб ранее, составила 12,5 мес. при терапии афлиберцептом против 11,7 мес. при терапии плацебо (ОР = 0,862) [16]. Таким образом, остается определить в рандомизированном исследовании оптимальную тактику для этой категории больных – продолжение терапии бевацизумабом после прогрессирования или переход на афлиберцепт, регистрация которого, как ожидается, произойдет в ближайшее время.
Регорафениб
Препарат связывает и ингибирует тирозинкиназы VEGFR 2-го и 3-го типа, c-kit, PDGFR и Raf-киназу, что приводит к угнетению ангиогенеза в опухоли и прекращению пролиферации опухолевых клеток. В феврале 2012 г. были представлены результаты III фазы сравнительного исследования регорафениба и плацебо у 760 больных с метастатическим раком толстой кишки, рефрактерных к стандартной терапии. Регорафениб показал статистически значимое увеличение медианы продолжительности жизни в сравнении с плацебо: 6,4 мес. против 5,0 мес. (расчетное ОР = 0,773; 95% ДИ 0,635–0,941; p = 0,0051). Медиана времени до прогрессирования в группе регорафениба составила 1,9 мес., а в группе плацебо – 1,7 мес. (расчетное ОР = 0,493; 95% ДИ 0,418–0,581; p < 0,000001). Объективный эффект составил 1,6% и 0,4% соответственно. Контроль болезни достигался в 44% случаев приема регорафениба и 15% случаев применения плацебо (p < 0,000001). При применении регорафениба чаще наблюдались такие осложнения, как ладонно-подошвенный синдром (17%), астения (15%), диарея (15%), гипербилирубинемия (8%) и артериальная гипертония (7%) [17].
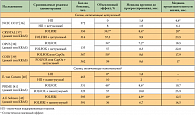
Применение других ингибиторов тирозинкиназ рецепторов к сосудистому эндотелиальному фактору роста не привело к увеличению продолжительности жизни пациентов (табл. 2). Так, добавление бриваниба (ингибитор тирозинкиназ VEGFR и рецептора к плацентарному фактору роста) к цетуксимабу у больных с метастатическим рефрактерным раком толстой кишки с диким типом гена KRAS привело к увеличению медианы времени до прогрессирования и объективного эффекта, но не повысило продолжительность жизни в сравнении с плацебо [18]. Добавление сорафениба, как и сунитиниба, к оксалиплатин-содержащим схемам в качестве первой линии терапии метастатического рака толстой кишки также не привело к повышению эффективности химиотерапии [19–21]. Такие препараты, как ваталаниб, цедираниб и акситиниб, оказались неэффективны в терапии распространенного рака толстой кишки [22–26].
В настоящее время проходит исследование антиангиогенных препаратов рамуцирумаба и IMC-18F1. Рамуцирумаб является человеческим моноклональным антителом к VEGFR-2. В отличие от афлиберцепта и бевацизумаба, рамуцирумаб предотвращает взаимодействие VEGF с рецептором, связывая VEGFR-2, а не VEGF [27, 28]. В настоящее время не завершены исследования II фазы с режимом FOLFOX и III фазы с режимом FOLFIRI у больных с метастатическим раком толстой кишки. Кроме того, несмотря на негативные результаты совместного применения ингибиторов ангиогенеза и анти-EGFR (epidermal growth factor receptor – рецептор эпидермального фактора роста) препаратов, инициировано исследование II фазы комбинации цетуксимаба и рамуцирумаба [19]. IMC-18F1 – моноклональное антитело, избирательно блокирующее VEGFR-1. Считается, что VEGF непосредственно связывается с VEGFR-2, тогда как VEGFR-1 играет важную роль в регулировании активности VEGFR-2 [29].
В настоящее время проводится исследование II фазы с препаратом IMC-18F1 у больных с метастатическим раком толстой кишки. Даже если его результат окажется негативным, оценка клинической эффективности таких препаратов, как афлиберцепт, рамуцирумаб и IMC-18F1, очень важна. Поскольку их клинический эффект, вероятно, будет различаться, это поможет понять роль различных компонентов системы VEGF в патогенезе рака толстой кишки. Таким образом, у больных с метастатическим раком толстой кишки наиболее эффективны для блокирования ангиогенеза антитела к сосудистому эндотелиальному фактору роста, тогда как ингибиторы тирозинкиназ рецепторов к сосудистому эндотелиальному фактору роста оказались неэффективными. Исключением являются обнадеживающие результаты исследования по применению регорафениба.
Ингибиторы сигнального пути от рецептора эпидермального фактора роста (EGFR)
В 60–92% случаев рака толстой кишки отмечается гиперэкспрессия EGFR. После стимуляции рецептора сигнал от эпидермального фактора роста (epidermal growth factor, EGF) передается через ряд внутриклеточных белковых молекул, включая RAS-RAF-MEK-ERK и PI3K-Akt-mTOR, на геном клетки и оказывает влияние на такие клеточные процессы, как дифференцировка, пролиферация, миграция, ангиогенез и апоптоз [30, 31]. Заблокировать работу данного рецептора можно с помощью моноклональных антител, два из которых – цетуксимаб и панитумумаб – уже используются в клинической практике. Однако при наличии мутации в гене белка KRAS нарушается работа данного пути и применение моноклональных антител к EGFR становится неэффективным, поэтому эффект ингибиторов EGFR наблюдается только у больных, не имеющих такой мутации. Частота мутаций гена KRAS составляет 40% [32–34].
Цетуксимаб – химерическое моноклональное антитело к наружному домену EGFR. В отличие от него, панитумумаб представляет собой полностью человеческий иммуноглобулин. Ингибирование рецепторов к EGF не только в опухоли, но и в нормальных тканях организма определяет развитие ряда специфических побочных эффектов при терапии ингибиторами EGFR – кожной токсичности, диареи и гипомагниемии. Выявлена четкая зависимость степени выраженности кожной токсичности с эффективностью терапии анти-EGFR-антителами. В случае развития кожной токсичности 3–4-й степени при применении панитумумаба больные имели более высокие показатели времени до прогрессирования в сравнении с пациентами с кожной токсичностью 1–2-й степени и пациентами, которым проводилась только химиотерапия (11,3, 6,1 и 8,7 мес. соответственно) [35]. Данные ключевых рандомизированных исследований применения обоих препаратов суммированы в таблице 3.
В исследовании CRYSTAL (Cetuximab Combined with Irinotecan in First-Line Therapy for Metastatic Colorectal Cancer – Цетуксимаб в комбинации с иринотеканом в качестве терапии первой линии метастического колоректального рака) при отсутствии мутации KRAS применение цетуксимаба увеличивало время до прогрессирования на 1,5 мес., общую выживаемость – на 3,5 мес., а частоту достижения объективного эффекта – почти в 1,5 раза [37]. В исследовании OPUS (Oxali-platin and Cetuximab in First-Line Treatment of mCRC – Оксалиплатин и цетуксимаб в терапии первой линии метастатического колоректального рака) в группе пациентов с диким типом гена белка KRAS также увеличилось время до прогрессирования при добавлении цетуксимаба к режиму FOLFOX, но не продолжительность жизни [38]. При проведении метаанализа данных исследований CRYSTAL и OPUS (845 больных с диким фенотипом KRAS) выявлено, что при добавлении цетуксимаба вероятность достижения объективного ответа увеличивалась более чем вдвое по сравнению с пациентами, получавшими только химиотерапию (p < 0,0001) [43].
По данным исследования Совета по медицинским исследованиям (Medical Research Council, MRС) COIN (COntinuous or INtermittent), в противоположность результатам предыдущих исследований, применение комбинации цетуксимаба с оксалиплатин-содержащими схемами химиотерапии не привело к увеличению выживаемости без прогрессирования и общей выживаемости, хотя и сопровождалось достоверно более высоким объективным эффектом (64% против 57%, р = 0,049) [39]. Негативные данные COIN послужили основой для появления гипотезы о том, что режимы на основе оксалиплатина – не оптимальные кандидаты для совместного применения с цетуксимабом. Последующий анализ этого исследования показал, что отсутствие выигрыша от цетуксимаба наблюдалось лишь в группе XELOX. Это объяснялось более высокой токсичностью, что приводило к большей редукции доз химиопрепаратов и, как следствие, снижению эффективности режима.
В группе «FOLFOX + цетуксимаб» такой обратной зависимости отмечено не было. Дополнительную интригу внесли результаты скандинавского рандомизированного исследования NORDIC VII (Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in first-line treatment of metastatic colorectal cancer), в котором цетуксимаб изучался в комбинации со струйным режимом 5-фторурацила в первой линии терапии [44]. Добавление цетуксимаба не привело к улучшению показателей выживаемости, хотя и не сопровождалось повышением токсичности.
В другом рандомизированном исследовании PRIME (Panitumumab Randomized Trial in Combination With Chemotherapy for Metastatic Colorectal Cancer to Determine Efficacy) сравнивалась комбинация «FOLFOX + панитумумаб» c режимом FOLFOX в качестве первой линии терапии больных метастатическим раком толстой кишки. У больных, не имевших мутации KRAS, добавление панитумумаба позволило достоверно увеличить медиану времени до прогрессирования с 8,0 до 9,6 мес. (р = 0,02) и частоту объективного ответа с 48% до 57% (р = 0,02) [45]. Также была отмечена тенденция к увеличению продолжительности жизни с 19,7 до 23,9 мес. (р = 0,07). Основываясь на результатах этих исследований с цетуксимабом и панитумумабом, оптимальными химиотерапевтическими «партнерами» для них являются режимы с включением иринотекана или FOLFOX, но не XELOX или Nordic FLOX (5-фторурацил + фолинат + оксалиплатин (Элоксатин®)).
Анти-EGFR-антитела в адъювантной терапии
Проведен ряд работ по изучению добавления анти-EGFR-препаратов к адъювантной химиотерапии. В 2010 г. на конгрессе Американского общества клинической онкологии (American Society of Clinical Oncology, ASCO) были доложены результаты исследования, в котором проводилось сравнение адъювантного лечения режимами «FOLFOX ± цетуксимаб» у больных с III стадией рака толстой кишки с диким типом гена KRAS в опухоли. При промежуточном анализе результатов терапии 1624 больных без мутации KRAS различий в показателях 3-летней выживаемости без признаков болезни получено не было (ОР = 1,18; p = 0,33) [46]. Более того, в группе больных старше 70 лет добавление цетуксимаба даже ухудшало 3-летнюю общую выживаемость (83,9% против 75,4%), в связи с чем исследование было досрочно прекращено. Наиболее вероятной причиной негативных результатов была более выраженная токсичность при применении цетуксимаба (диарея), что приводило к уменьшению числа курсов адъювантной химиотерапии. Недавно завершено исследование PETACC-8 (Adjuvant treatment of fully resected stage III colon cancer with FOLFOX-4 versus FOLFOX-4 plus cetuximab) с аналогичным дизайном.
Учитывая, что, по-видимому, цетуксимаб более эффективен в комбинации с иринотеканом, было начато исследование N0147. Первоначально в исследовании планировалось сравнить режимы FOLFIRI и «FOLFIRI + цетуксимаб», но после сообщений о неэффективности схем с иринотеканом в адъювантном режиме набор в исследование был прекращен. Всего в исследование успели включить 156 больных с III стадией болезни, из них с диким типом гена KRAS – 99 человек. Добавление цетуксимаба привело к недостоверному улучшению показателей выживаемости, как общей, так и без признаков болезни во всей группе больных, и особенно у больных с диким типом гена KRAS [47]. Однако данные показатели были ниже тех, которые наблюдаются при назначении схем с оксалиплатином. Таким образом, несмотря на положительный опыт применения моноклональных антител при метастатическом колоректальном раке, в качестве адъювантной терапии они оказались неэффективны.
Ген KRAS не является единственным, позволяющим индивидуализировать назначение анти-EGFR-антител. В ретроспективном анализе исследования CRYSTAL было показано, что мутация гена BRAF, имеющая место у ~10% больных с диким типом KRAS, определяет неэффективность анти-EGFR-антител и является прогностически неблагоприятным фактором. Тем не менее необходимо подтвердить эти данные в проспективных исследованиях, прежде чем начинать определять мутацию BRAF в рутинной практике. Применение ингибитора BRAF (вемурафениба) у больных раком толстой кишки имеет ограниченный терапевтический потенциал. Это связано с быстрым повышением экспрессии EGFR при блокировании BRAF в клетках рака толстой кишки, что поддерживает пролиферацию опухолевых клеток [48]. По-видимому, для достижения эффекта необходимо одновременное ингибирование BRAF и EGFR.
Другой важной составляющей EGFR сигнального пути является альтернативная пути RAS-MEK-ERK передача сигнала по PI3K-Akt-mTOR-пути. Также исследуются препараты, блокирующие рецептор к инсулиноподобному фактору роста, сигнал с которого проходит по сигнальному пути PI3K. Таким образом, одновременная блокада EGFR и рецептора инсулиноподобного фактора роста (insulin growth factor receptor, GFR) предполагает большую эффективность, однако и потенциально более выраженную токсичность терапии, чем монотерапия анти-EGFR-препаратами. В 2011 г. были представлены результаты сравнительного исследования I/II фазы комбинации панитумумаба с AMG102 (рилотумумаб) или AMG479 (ганитумумаб) против панитумумаба в монорежиме во второй линии терапии у пациентов с метастатическим раком толстой кишки с диким фенотипом гена KRAS. Рилотумумаб – моноклональное антитело к фактору роста гепатоцитов. Ганитумумаб – моноклональное антитело к рецептору 1-го типа инсулиноподобного фактора роста (IGF-R1). Предварительные данные показали преимущество комбинации панитумумаба с антителом к фактору роста гепатоцитов в отношении частоты объективных эффектов, частоты достижения контроля болезни и длительности объективного эффекта. Комбинация с антителом к IGF-R1 оказалась неэффективной [49].
Обнадеживающие данные во II фазе исследования в сочетании с капецитабином показал препарат перифозин. По молекулярной структуре это алкилфосфолипид, который ингибирует несколько ключевых сигнальных путей, включая Akt, MAPK, JNK и NF-kB. Выключение последнего приводит к восстановлению чувствительности опухолевых клеток к фторпиримидинам [50, 51]. Кроме того, в экспериментальных работах было показано, что концентрация этого препарата выше в опухоли, чем в нормальных тканях. В рандомизированное плацебоконтролируемое исследование комбинации капецитабина и перифозина было включено 35 больных с метастатическим раком толстой кишки, которые ранее получили от 1 до 5 линий химиотерапии (медиана количества линий предшествующей химиотерапии равна 2). Комбинация перифозина с капецитабином применялась у 20 пациентов. Частота объективных эффектов в группе перифозина составила 20%, а группе, получавшей капецитабин + плацебо, – 7%. Контроль болезни в группе перифозина достигнут у 75% больных, а в группе, получавшей капецитабин + плацебо, – у 40%.
Медиана времени до прогрессирования в группе пациентов, получавших перифозин, была в 2 раза выше, чем в группе плацебо (28 недель против 11 недель, р = 0,048), так же как и медиана продолжительности жизни (24,3 мес. против 11,7 мес., р = 0,03). В группе больных, получавших перифозин, чаще наблюдались диарея, тошнота, астения, анемия, ладонно-подошвенный синдром [52, 19]. На основании полученных данных инициировано исследование III фазы по применению перифозина у больных с метастатическим раком толстой кишки.
Совместное ингибирование VEGFR- и EGFR-путей
Cочетание блокады нескольких ключевых рецепторов (совместное применение бевацизумаба и цетуксимаба/панитумумаба) не привело к успеху. В двух рандомизированных исследованиях III фазы сочетание двух таргетных препаратов статистически значимо снизило медиану времени до прогрессирования (табл. 4). Среди больных с диким типом гена KRAS медианы времени до прогрессирования и продолжительности жизни не различались. Таким образом, известно о негативном влиянии сочетания ингибиторов EGFR и бевацизумаба, механизм данного явления пока не ясен [53, 54].
Заключение
За последние годы достигнуты значительные успехи молекулярной онкологии в расшифровке сигнальных путей в опухолевых клетках. В настоящее время уже зарегистрированы и широко применяются три таргетных препарата. В ближайшее время ожидается регистрация еще двух новых препаратов – афлиберцепта и регорафениба. Пока остается нерешенной проблема отсутствия молекулярных факторов, позволяющих предсказать эффективность антиангиогенной таргетной терапии при метастатическом колоректальном раке. Не ясна прогностическая роль и других генов, вовлеченных в сигнальные пути EGF.
Возрастает и роль хирургических методов в лечении больных с метастатическим раком толстой кишки. Предстоит выяснить оптимальное применение таргетных препаратов в комплексе лечения больных с резектабельными и потенциально резектабельными метастазами рака толстой кишки в печень или легкие: количество курсов терапии до операции, необходимость послеоперационной терапии. Одним из путей разрешения кризиса в исследованиях, по-видимому, является пересмотр дизайна и концепции проведения клинических исследований, где на первое место должен выходить поиск молекулярных маркеров, предсказывающих ответ на лечение, так как применение таргетных препаратов в общей популяции больных не приводит к значительному выигрышу в выживаемости.
