Прогнозирование и профилактика онкотрансформации шейки матки с учетом метилирования генов-супрессоров опухолевого роста
- Аннотация
- Статья
- Ссылки
Кольпоскопическое исследование является базовым методом, определяющим диагностику, а затем тактику лечения заболевания и ведения пациентов с патологическими процессами шейки матки [10]. Однако, несмотря на высокую чувствительность (80–83%) и специфичность метода (64–87%) [18], кольпоскопия не заменяет цитологическое и гистологическое исследования, а лишь дополняет их.
Основной метод скрининга – цитологическая диагностика, но его информативность недостаточно высока [8, 9, 15, 20, 23]. В клинической практике все большее применение находит жидкостная цитология (ThinPrep-тест). По сравнению с традиционным цитологическим исследованием, ThinPrep-тест является более чувствительным (при идентичной специфичности), но экономически не оправдан [20, 21, 24].
Метод качественной диагностики ДНК папилломавирусной инфекции (ВПЧ) является высокочувствительным и информативным, но не позволяет прогнозировать течение инфекции, которая в некоторых случаях элиминируется без лечения и не коррелирует с цервикальной неоплазией [6, 17]. Кроме того, в связи с возможной амплификацией слишком малых количеств вирусной ДНК отмечается большое количество ложнопозитивных результатов [22].
Наибольшей прогностической значимостью обладает количественный метод определения вирусной нагрузки – метод полимеразной цепной реакции в реальном времени (ПЦР-РВ) и метод Digene Hibrid Captur System II («двойной генной ловушки»), позволяющий прогнозировать элиминацию ВПЧ или прогрессирование инфекции до развития дисплазии [12, 19].
Необходимо отметить, что кольпоскопический, цитологический и гистологические методы исследования позволяют диагностировать уже существующие патологические изменения шейки матки, в связи с чем необходим дальнейший поиск прогностических маркеров, позволяющих определить вероятность злокачественной трансформации на максимально раннем этапе канцерогенеза, еще до фенотипических проявлений [4].
Одним из важных событий, необходимых для развития опухолевого роста, являются эпигенетические нарушения – инактивация генов-супрессоров опухолевого роста [14]. С помощью анализа статуса метилирования промоутеров генов можно облегчить раннюю диагностику рака, предсказать динамику развития заболевания и дать прогноз относительно лечения [2, 17].
Комплексная оценка клинических особенностей патологических процессов шейки матки в совокупности с выявлением метилирования генов-супрессоров опухолевого роста позволит прогнозировать возникновение онкопатологии шейки матки и выработать наиболее оптимальный способ профилактики и лечения.
Все это определило актуальность и цель нашего исследования, которое проводилось на клинических базах кафедры акушерства и гинекологии Первого МГМУ им. И.М. Сеченова с 2007 по 2010 г.
Материалы и методы
Нами обследовано 127 пациенток репродуктивного возраста с различной цервикальной патологией. В зависимости от морфологической верификации женщины были разделены на 4 группы: I группа – фоновые процессы (42), II группа – легкая степень дисплазии CIN I (33), III группа – умеренная степень CIN II (27) и IV группа – тяжелая степень CIN III (25). Средний возраст составил 32,7 ± 0,7 лет, без достоверных различий по группам.
На первом этапе проводилась расширенная кольпоскопия, цитологическое исследование мазков. При выявлении ВПЧ высокого онкогенного риска методом ПЦР определялась вирусная нагрузка методом гибридного захвата (Digene-тест). Если показатель вирусной нагрузки находился в пределах клинически значимых величин (> 105 геномов/мл), независимо от кольпоскопической картины проводилось морфологическое исследование биопсийного материала. Геномную ДНК выделяли методом фенолхлороформной экстракции, определение метилирования генов-супрессоров опухолевого роста MLH1, HIC1, MGMT проводили методом метилчувствительной ПЦР (МЧ-ПЦР) [3].
Полученные результаты были обработаны методом вариационной статистики. Статистически значимыми считались отличия при р < 0,05 (95-процентный уровень значимости) и при р < 0,01 (99-процентный уровень значимости). Связь между изучаемыми показателями оценивалась по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r) или Спирмена (R) и последующим установлением его значимости по критерию t. Используя метод бинарной логистической регрессии, мы получили сводное регрессионное уравнение, позволяющее рассчитать риск развития CIN III p = 1 / (1 + e-z), где z = b1X1 + b2Х2 + ...+ bnXn + a (X – значения независимых переменных, b – коэффициенты, расчет которых является задачей бинарной логистической регрессии, а – некоторая константа).
На основании выявленных прогностических факторов определялась тактика ведения пациенток. Если при решении сводного регрессионного уравнения получали значение p < 0,5, тактика ведения больных при фоновых заболеваниях и CIN I была консервативно-выжидательной. Если значение p > 0,5, тактика ведения была более активной – проводилась радиоволновая эксцизия или конизация шейки матки в комплексе с противовирусной терапией. Лечение производилось амбулаторно, под местной интрацервикальной анестезией 10-процентным лидокаином. Пациентки с CIN II и CIN III были направлены в стационар.
Результаты и их обсуждение
Клиническая картина фоновых и диспластических процессов шейки матки варьирует от визуальных изменений до отсутствия проявлений патологического процесса.
При проведении расширенной кольпоскопии выявлена взаимосвязь между тяжестью дисплазии и выраженностью кольпоскопических изменений. При легкой и тяжелой степени дисплазии имеется достоверное отличие между частотой выявления малых (73 и 10% соответственно) и больших (27 и 90%) кольпоскопических изменений.
При сопоставлении результатов цитологического и гистологического исследований выявлена обратная связь между числом ложноотрицательных результатов и степенью тяжести дисплазии. Наибольшее число ложноотрицательных ответов получено при CIN I (42,4%), в то же время при CIN III были даны позитивные заключения в 96% (p < 0,05).
С увеличением вирусной нагрузки наблюдается прогрессия заболевания. В третьей (33,3 и 37,0%) и четвертой (40 и 48%) группах отмечается преобладание высокой вирусной нагрузки 107–108 геном/мл, тогда как в первой группе (7,1%) и во второй (15,2%) в большинстве случаев выявлена вирусная нагрузка 106 геном/мл.
При сравнении методов Hybrid Capture II (Digene-тест) и ПЦР выявлено, что Digene-тест обладает большей чувствительностью (96%) и специфичностью (90%) по сравнению с методом ПЦР – чувствительность 95% и специфичность 79%.
Метилирование генов MLH1, HIC1, MGMT и в биопсийных образцах при фоновых и диспластических процессах характеризуется повышением частоты патологии шейки матки (HIC1 – 7,1%, MGMT – 2,4%, MLH1 – 2,4%) до CIN III (HIC1 – 84%, MLH1 – 52%, MGMT – 8%). В образцах морфологически неизмененной ткани, смежной с CIN III, уровень метилирования приближается к частотам дипластических образцов: HIC1 – 76%, MLH1 – 36%, MGMT – 4%, что позволяет сделать вывод о вовлечении этих тканей в процесс опухолевой трансформации клеток еще до фенотипического проявления заболевания.
Вирус папилломы человека высокого онкогенного риска сопряжен с метилированием генов-супрессоров опухолевого роста, что подтверждается данными корреляционного анализа. Сильная прямая зависимость метилирования генов-супрессоров опухолевого роста с наличием ВПЧ высокого риска была выявлена для генов HIC1 (r = 0,715, p < 0,001), MLH1 (r = 0,487, p < 0,001) и слабая зависимость – для гена MGMT (r = 0,18, p < 0,05).
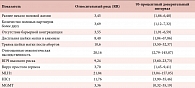
При анализе результатов клинико-генетических исследований нами были выделены прогностические факторы риска развития CIN III: раннее начало половой жизни, достоверно большее число половых партнеров, отсутствие методов барьерной контрацепции, травмы шейки матки, дисплазия шейки матки в анамнезе, отягощенная онкологическая наследственность, наличие инфекции, передаваемой половым путем, метилирование генов-супрессоров опухолевого роста. Данные представлены в таблице 1.
Выявленные клинико-генетические факторы риска развития CIN III явились основой для создания математической модели прогнозирования на основании многофакторного математического анализа показателей с использованием метода бинарной логистической регрессии и вычисления коэффициентов для сводного регрессионного уравнения прогноза CIN III, с помощью которого можно предсказать вероятность наступления неблагоприятного исхода (при p > 0,5).
Итак, при обследовании женщин с патологическими процессами шейки матки необходимо использовать молекулярно-биологические, цитологические, кольпоскопические, морфологические и генетические методы исследования.
Комплексная оценка клиническо-генетических особенностей патологических процессов шейки матки позволяет разработать принципы прогнозирования риска возникновения онкопатологии шейки матки и выбрать наиболее оптимальный способ лечения.
Кроме того, полученные результаты исследования свидетельствуют, что аномальное метилирование генов-супрессоров опухолевого роста является мишенью для направленной терапии препаратами, осуществляющими деметилирование. В ряде исследований, проведенных в последние годы, показано, что флавоноид эпигаллокатехин-3-галлат (EGCG) является эффективным ингибитором фермента ДНК-метилтрансферазы [4]. На различных линиях опухолевых клеток человека было продемонстрировано, что EGCG (5–50 мкМ) дозозависимым образом эффективно подавлял активность ДНК-метилтрансферазы, в результате чего происходило деметилирование CpG-динуклеотидов и реактивация метилированных «молчащих» (транскрипционно неактивных) генов, вовлеченных в процессы канцерогенеза, а именно: гена-супрессора опухолевого роста р16, гена ретиноидных рецепторов (RAR), гена метилгуанин-метилтрансферазы (MGMT) и гена hMLH1, ответственного за репарацию ДНК. В связи с этим особое внимание заслуживает препарат Промисан, содержащий индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG), которые способствуют ингибированию ДНК-метилтрансферазы. Промисан разработан отечественной фармацевтической компанией «МираксБиоФарма».
Таким образом, гиперметилирование генов, вовлеченных в канцерогенез, происходит на ранних стадиях опухолеобразования и часто обнаруживается в предраковых состояниях. Гиперметилирование генов-супрессоров опухолевого роста может служить молекулярным маркером ранней диагностики, мониторинга и клинического прогноза патологических процессов шейки матки и представляет собой мишень для патогенетически обоснованной таргетной терапии и профилактики рака шейки матки.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.