Производные сульфонилмочевины: микронизированная форма глибенкламида – «золотой стандарт» второй линии терапии СД
- Аннотация
- Статья
- Ссылки

По данным Международной федерации диабета [1], в настоящее время в мире насчитывается 285 млн больных сахарным диабетом (СД) в возрасте 20–79 лет, из которых 85–95% составляют пациенты с СД 2 типа. Предполагается, что к 2030 г. общее число больных СД увеличится до 438 млн человек. В Российской Федерации численность больных СД составляет около 9 млн, и только за последние 10 лет она возросла в 2 раза [2]. Анализируя данные Минздравсоцразвития России (расчет Росстата), можно констатировать: в 2000 г. СД страдали 162 тыс. человек, а в 2009 г. этот показатель увеличился до 308,6 тыс. человек [3]. В России к 2030 г., по прогнозам ВОЗ, будет 13,8 млн больных СД, однако, по оценкам заведующего кафедрой эндокринологии и диабетологии МГМСУ профессора А.М. Мкртумяна, уже сейчас число больных СД в стране приближается к этому показателю [4].
Необходимо отметить, что число больных СД 2 типа превышает число больных СД 1 типа, кроме того, наметилась тенденция значительного омоложения СД 2 типа – участились случаи диагностики данного заболевания у детей и подростков. По сведениям разных авторов, в ближайшее время пациенты с СД 2 типа будут составлять от 92 до 97% общего количества больных диабетом [5]. Уменьшение возраста манифестации заболевания приводит к увеличению доли лиц трудоспособного возраста среди данных пациентов. Немаловажным является вопрос о материальных затратах для лечения и поддержания работоспособности этих пациентов.
В основе патогенеза СД 2 типа рассматриваются несколько «стимулирующих» друг друга процессов. Во-первых, это инсулинорезистентность, которая предшествует развитию СД 2 типа. Было проведено 5-летнее исследование по оценке естественного развития СД у 114 человек. В результате анализа полученных данных выявлено, что прогрессирование нарушений гликемии достоверно коррелирует с уровнем инсулиновой секреции: нарастает снижение инсулиновой секреции до 27% при нарушении толерантности к глюкозе и до 78% при манифестации СД 2 типа. Действие инсулина также снижается в широком диапазоне – от 7% до 31%. В результате проведенного сравнительного анализа двух групп пациентов авторы сделали достоверный вывод о нарастании гликемии и снижении плазменного уровня инсулина при прогрессировании заболевания [6].
Необходимо обратить внимание и на то, что происходит нарастание как уровня гликемии натощак, так и постпрандиальной гипергликемии с момента выявления нарушения тощаковой гликемии до момента установления диагноза СД. Инсулинорезистетность сохраняется на стабильно высоком уровне, недостаточность бета-клеток прогрессивно увеличивается, и в среднем через 10 лет от начала заболевания (но не установления диагноза) у больных СД 2 типа развивается относительный дефицит инсулина, диктующий необходимость либо постоянной стимуляции его секреции, либо заместительной инсулинотерапии [7].
Во-вторых, постепенно развивается дисфункция бета-клеток. В норме регуляция секреции инсулина осуществляется несколькими путями. Метаболический путь: секреция инсулина стимулируется глюкозой, аминокислотами, ингибируется триглицеридами, свободными жирными кислотами и кетоновыми кислотами и др. Гормональный путь: секреция инсулина стимулируется холецистокинином, глюкозозависимым инсулинотропным полипептидом (GIP), глюкагоноподобным пептидом (GLP-1), ингибируется адреналином, АКТГ, ТТГ, гормоном роста, пролактином, вазопрессином, кортизолом, тироксином и др.
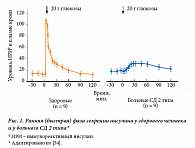
Нейротрансмитерный путь: секреция инсулина стимулируется ацетилхолином, а ингибируется норадреналином. Секреция инсулина в течение суток происходит неравномерно, существует базальная и стимулированная – в ответ на углеводную нагрузку – секреция инсулина. В норме ранняя (быстрая) фаза секреции инсулина у здорового человека длится 3–5 минут, а при СД 2 типа она изменена или отсутствует (рис. 1). При этом происходит нарушение превращения проинсулина в инсулин, что приводит к повышению секреции проинсулина и исчезновению раннего пика секреции инсулина. Таким образом, дисфункция бета-клеток выражается в утрате ранней фазы секреции инсулина, что в свою очередь приводит к избыточной продукции инсулина в более позднее время, ухудшению контроля постпрандиальной гликемии, непродуктивной гиперинсулинемии и увеличению массы тела.
Дальнейшее развитие заболевания приводит к прогрессивному снижению секреторных запасов продуцирующих инсулин клеток (примерно 5–6% в год) и усугублению количественного и качественного действия инсулина. Формируется стойкая постпрандиальная гипергликемия, которая является тем самым третьим фактором формирования патогенеза СД. Именно глюкозотоксичности отводится ведущая роль в формировании диабетических осложнений. Одной из особенностей СД 2 типа является достаточно длительное бессимптомное течение. Это приводит к низкой обращаемости пациентов в медицинские учреждения на ранних стадиях заболевания. Однако уже в этот период времени гипергликемия способствует развитию выраженных нарушений секреции инсулина, быстрому прогрессированию атеросклероза, поражению нервной системы. Все это приводит к тому, что на момент появления явных клинических симптомов СД 2 типа у пациентов уже присутствуют осложнения заболевания в виде нарушения зрения (ретинопатия), почек (микро-, макропротеинурия), поражения сосудов сердца, мозга, нижних конечностей, что впоследствии приводит к инвалидизации.
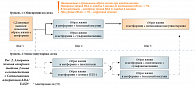
Учитывая патогенез заболевания и формирования осложнений, на основании клинических исследований [8–12] доказано: нормализация гликемии способствует значительному уменьшению риска возникновения микроваскулярных осложнений и нейропатии, что подтверждено клиническими исследованиями и эпидемиологическими данными [13, 14]. Однако у исследователей нет единого понимания, каким должен быть так называемый целевой уровень HbA1c. Американская диабетическая ассоциация (ADA) рекомендует добиваться уровня HbA1c < 7% [15]. Международная диабетическая федерация (IDF) предлагает добиваться уровня HbA1c < 6,5%. Национальная программа стандартизации Glycohemoglobin (NGSP) считает верхний предел нормального показателя HbA1c равным 6,1% [16]. В России компенсация СД считается достигнутой при показателе HbA1c, равном 7,0% [17]. Согласно рекомендациям ADA/EASD – «Консенсус (Согласованный алгоритм) по ведению гипергликемии при СД 2 типа (начальная и дополнительная терапия)», уровень HbA1c ≥ 7% должен служить сигналом к началу терапии или изменению тактики лечения СД. Для этого был разработан алгоритм лечения СД (рис. 2).
Формирование СД 2 типа чаще всего происходит на фоне избыточного веса/ожирения и гиподинамии. Всем пациентам мы рекомендуем соблюдение рационального питания и оптимальные физические нагрузки. Речь идет не о диете, как о временном сокращении употребления тех или иных продуктов питания, пониженном калораже, а именно о рациональном питании на всю жизнь. Соблюдение правил питания и активные физические нагрузки оказывают положительный эффект в отношении контроля гликемии при установленном диабете 2 типа [18]. Значимое снижение веса (20 кг и более) может приводить к нивелированию СД 2 типа [19–21]. Однако у большинства пациентов снижение массы тела имеет кратковременный положительный эффект, поэтому они нуждаются в дополнительном медикаментозном лечении.
Сахарный диабет 2 типа – это прогрессирующее заболевание с тенденцией к увеличению гликемии с течением времени. Именно поэтому добавление медикаментозной терапии – правило без исключений, разумеется, если преследовать цель постоянного поддержания нормогликемии. Как следует из Согласованного алгоритма ADA/EASD, уже на первом этапе может понадобиться включение в схему лечения препарата метформина. Это единственный препарат из группы бигуанидов, разрешенный к применению в настоящее время. Основные эффекты метформина: снижение продукции глюкозы печенью и уменьшение уровня гликемии натощак. Негликемический эффект метформина – стабилизация или умеренное снижении веса. При проведении монотерапии метформином уровень HbA1c снижается приблизительно на 1,5% [21–23] без риска развития гипогликемических состояний. Именно это определяет возможность его применения у больных с предиабетической гипергликемией [24]. Противопоказанием к применению препарата является хроническая почечная недостаточность, но в недавно проведенном исследовании показано, что если клубочковая фильтрация снижается до уровня < 30 мл/мин, то назначение метформина является безопасным [25].
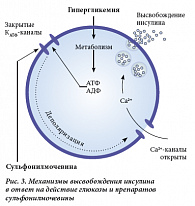
На втором этапе лечения применяются препараты, усиливающие секрецию инсулина, или непосредственно инсулин (с учетом индивидуальных особенностей пациента, клинико-лабораторных показателей). Самой изученной группой сахароснижающих препаратов, относящихся к секретагогам, являются препараты сульфонилмочевины, применяемые с конца 1950-х гг. Их действие основано на способности стимулировать секрецию инсулина через специфические рецепторы плазматической мембраны бета-клетки поджелудочной железы. Препараты первой генерации помимо основного эффекта имели достаточно большое количество недостатков: негативно влияли на липидный обмен, массу тела, имели слабую селективность действия, высокий риск гипогликемии. Создание производных сульфонилмочевины второй генерации позволило максимально усилить основной сахароснижающий эффект, минимизировать круг возможных побочных реакций. Все препараты сульфонилмочевины осуществляют инсулин-стимулирующий эффект через АТФ-зависимые калиевые каналы (рис. 3).
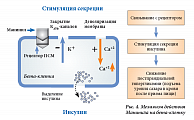
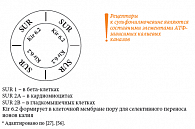
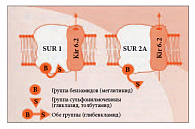
Рецепторы к сульфонилмочевине (SUR) являются неотъемлемым компонентом АТФ-зависимых калиевых каналов [26]. Каждый канал состоит из четырех белков Kir 6.2, формирующих центральную пору, и четырех регуляторных субъединиц SUR (регуляторные рецепторы) (рис. 5). Именно SUR-рецепторы имеют видовые отличия в разных тканях. Так, SUR 1 наблюдаются в бета-клетке, SUR 2A – в кардиомиоците, SUR 2B – в гладкомышечных клетках [27, 28]. Селективность действия различных препаратов из группы сульфонилмочевины определяется именно аффинностью к данным рецепторам (рис. 6). Чем выше сродство препарата к рецептору, тем дольше его ингибирующее влияние на АТФ-зависимый калиевый канал и тем сильнее стимуляция секреции инсулина за счет поступления в бета-клетки ионов Са2+. Производные сульфонилмочевины связываются с рецепторами АТФ-зависимых калиевых каналов по-разному, это зависит от наличия или отсутствия в химической структуре сульфамидных и бензамидных групп. Глибенкламид содержит обе группы, поэтому наиболее быстро и мощно способствует закрытию АТФ-зависимых калиевых каналов, стимулируя деполяризацию мембраны, повышение внутриклеточного Са2+ и секрецию инсулина. Кроме того, глибенкламид стимулирует секрецию инсулина в соответствии с уровнем глюкозы благодаря повышению чувствительности бета-клеток к глюкозозависимому инсулинотропному полипептиду (GIP) [29, 30], а также повышает чувствительность тканей к инсулину за счет увеличения числа инсулиновых рецепторов и их сродства к гормону даже в условиях гиперинсулинемии [31, 32] (рис. 4).
Как упоминалось выше, препараты сульфонилмочевины снижают уровень глюкозы и HbA1c приблизительно на 1,5% [33, 34]. Немикронизированная форма глибенкламида 5 мг давно применяется как эффективное сахароснижающее средство и хорошо известна. Но данная форма препарата имеет ряд недостатков: биодоступность составляет 24–69%, время наступления эффекта – от 40 до 60 минут, максимальная концентрация в крови достигается через 4–6 ч после приема препарата внутрь, период полувыведения составляет от 10 до 12 ч. Соответственно, препарат приходилось принимать минимум за 30 минут до еды. «Отсроченный» пик концентрации приводил к формированию гипогликемических состояний между приемами пищи. На этом фоне у пациента развивались «замаскированные» гипогликемические состояния: учащение приступов стенокардии, гипертонических кризов и т.д., которые сменялись «рикошетной» гипергликемией. Часто врачи интерпретировали данные состояния как недостаточность дозы препарата или неэффективность его действия. Увеличение дозы принимаемого препарата приводило к усилению инсулинорезистентности и, как следствие, к набору веса. Имеющиеся недостатки «классической» эталонной формы глибенкламида 5 мг удалось преодолеть с помощью создания микронизированных форм препарата.
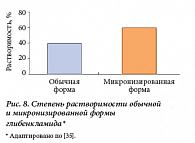
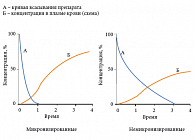
Микронизация – это процесс сверхтонкого измельчения частиц, после которого их размер колеблется от 0,5 до 10 микрон (рис. 7). Такая форма позволяет повлиять на свойства препарата. Сверхмалые частицы обеспечивают наилучшую способность к проникновению, более полное растворение, это приводит к возрастанию концентрации препарата в крови и существенно ускоряет время наступления эффекта (рис. 8, 9) [35]. Добавление метилгидроксиэтилцеллюлозы – индифферентной для организма добавки – позволило увеличить дисперсную фазу препарата и расширить площадь всасывания глибенкламида [36]. Микронизированная форма препарата характеризуется следующими параметрами:
- полное высвобождение действующего вещества происходит в течение 5 минут после растворения таблетки;
- биодоступность составляет 100%;
- время наступления эффекта – от 15 до 30 минут;
- максимальная концентрация в крови составляет 1,7 ч (для дозировки 1,75 мг) и 2,5 ч (для дозировки 3,5 мг) после приема препарата внутрь.
Полная биодоступность препарата позволяет снизить суточную потребность в глибенкламиде на 30–40%. Было проведено рандомизированное сравнительное исследование с применением двойного слепого контроля с участием 206 больных СД 2 типа по сравнительной оценке между «классической» и микронизированной формами глибенкламида [37]. В результате было установлено: меньшая дозировка в модифицированном препарате дает такой же пик, как и большая в обычном препарате, степень компенсации не отличалась (уровень HbA1c составил 7,5%, а модифицированного – 7,4%).
Гипогликемия – одна из самых часто встречающихся побочных реакций при терапии пероральными сахароснижающими препаратами. В мультицентровом сравнительном исследовании, которое проводилось в течение 12 месяцев среди 425 пациентов с СД 2 типа, микронизированный глибенкламид продемонстрировал высокую безопасность [38]. В сравнении с «классическим» глибенкламидом число гипогликемий было меньше на 5–7%. При сравнении микронизированного глибенкламида с репаглинидом отмечено, что риск гипогликемий в группах был сопоставимым и составил 0,93 (95% ДИ: 0,39–2,24) и 0,97 (95% ДИ: 0,51–1,83) соответственно. Стремление достичь целевых значений гликемии, компенсации СД связано прежде всего со стремлением предотвратить и/или уменьшить риск развития поздних осложнений СД. Глибенкламид можно считать самым изученным ПСМ второго поколения, участвовавшим во всех крупных многоцентровых исследованиях, посвященных лечению и оценке отдаленных последствий среди пациентов СД 2 типа. UKPDS (United Kingdom Prospective Diabetes Study) – одно из самых крупных и длительных исследований – показало, что на фоне сахароснижающей терапии частота микро- и макрососудистых осложнений снижается прямо пропорционально уменьшению уровня гликозилированного гемоглобина. Риск развития всех диабетических осложнений снизился на 12%, микрососудистых – на 25% (в том числе ретинопатии на 21%, а нефропатии на 33%), инфаркта миокарда – на 16% [11].
Достаточно долго в медицинской литературе дискутировались вопросы кардиоваскулярного риска при применении препаратов сульфонилмочевины. Это не случайно, ведь сердечно-сосудистые заболевания составляют почти 60% среди причин смерти больных СД 2 типа. На момент диагностирования СД 2 типа частота сосудистых катастроф увеличивается в 2–5 раз по сравнению с общей популяцией [39]. Объяснить это обстоятельство можно наличием характерных для СД 2 типа гиперинсулинемии и инсулинорезистентности, которые ускоряют прогрессирование атеросклероза. Компенсация углеводного обмена способствует предотвращению прогрессирования сосудистых осложнений, в том числе макроангиопатии [40, 41]. Систематический анализ долгосрочных сердечно-сосудистых исходов у пациентов с СД 2 типа, проведенный в 2008 г., не выявил корреляции между приемом сахароснижающих препаратов и повышением частоты фатальных и нефатальных сердечно-сосудистых событий, а также общей смертности [42]. В 2010 г. проведен анализ различных исследований, данные которого свидетельствуют: при сравнении монотерапии глибенкламидом и другими секретагогами (хлорпропамид, репаглинид и глимепирид) не выявлено статистически значимых отличий между группами (относительный риск для глибенкламида по сравнению с хлорпропамидом, репаглинидом и глимепиридом составил 0,84; 95% ДИ: 0,56–1,26) [43]. Отсутствие отрицательного влияния ПСМ на сердце объясняется следующим. АТФ-зависимые К+-каналы присутствуют на плазматических мембранах многих тканей, в том числе и на кардиомиоците.
Выход ионов калия инициирует реполяризацию клеточной мембраны, укорачивает потенциал действия и амплитуду сокращений кардиомиоцита, что снижает потребность миокарда в кислороде, снижает сосудистую резистентность, повышает коронарный кровоток и снабжение миокарда кислородом [44]. Стоит отметить, что чувствительность АТФ-зависимых К+-каналов к глибенкламиду в миокардиоцитах значительно ниже, чем в бета-клетках поджелудочной железы [45]. Положительное влияние глибенкламида на АТФ-зависимые К+-каналы проявляется антиаритмическим эффектом. При закрытии АТФ-зависимых К+-каналов (блокада около 10% каналов) происходит снижение потери ионов К+ клетками миокарда при выраженной ишемии. Так, глимепирид практически не связывается с рецепторами к сульфонилмочевине в миокарде, а гликлазид обладает наиболее выраженным аритмогенным эффектом [46, 47]. В исследованиях отмечается, что при приеме пациентами с СД 2 типа глибенкламида на фоне развившейся ишемии снижается вероятность развития желудочковой аритмии и фибрилляции – частых причин смерти пациентов в остром периоде инфаркта миокарда (ИМ) [46].
При сравнении частоты возникновения аритмии у пациентов с СД 2 типа, как острого осложнения ИМ, выявлено, что фибрилляция желудочков достоверно реже возникала у пациентов, принимавших глибенкламид (1,9%), по сравнению с другими сахароснижающими препаратами (7,9%) и без терапии (9,9%) [48]. Тимоти Дэвис (Timothy M.E. Davis) провел ретроспективный анализ 5715 историй болезни пациентов с ИМ, 745 из которых были с СД 2 типа. При оценке частоты аритмий и смертности от ИМ выявлено, что частота развития фибрилляции желудочков, послужившая причиной смерти у пациентов, страдавших СД и получавших глибенкламид, была аналогична таковой у пациентов без СД (11,8 и 11,0% соответственно), однако она оказалась меньше, чем у пациентов, принимавших гликлазид (18%, p < 0,05) или инсулин (22,8%, p < 0,05) [49]. В опубликованных в 2003 г. результатах проспективного исследования LAMBDA (The LAngendreer Myocardial infarction and Blood glucose in Diabetic patients Assessment) показано, что предшествующий прием глибенкламида, как и других ПСМ, не оказывал отрицательного влияния на уровень выживаемости больных СД 2 типа после перенесенного ИМ [50]. При оценке смертности от ИМ среди пациентов СД 2 типа, находившихся на терапии препаратами сульфонилмочевины второго поколения и инсулином, отмечена более высокая летальность в группе на инсулинотерапии [51].
В последние годы стали обращать внимание на положительный эффект ПСМ у пациентов, перенесших инсульт головного мозга. Ретроспективный анализ Хагена Кунте (Hagen Kunte) и соавт. [52] показал: достоверно лучшие неврологические исходы инсульта имели пациенты, находившиеся на терапии ПСМ до и во время инсульта. Эти результаты требуют дальнейшего подтверждения из-за малого количества наблюдавшихся Х. Кунте и соавт. пациентов (33 человека). В лабораторных условиях на модели ишемического инсульта у грызунов инфузии глибенкламида действительно предотвращали расширение зоны инфаркта мозга и снижали смертность в 2 раза [53]. На основании данных вышеперечисленных исследований можно сделать вывод, что глибенкламид обладает не только активным гипогликемическим эффектом, но и кардиопротективным противоаритмическим, возможно, и противоишемическим эффектами. Микронизированная форма препарата, на фоне уменьшения доз, позволяет легко титровать дозу, принимать его за короткое время перед едой, уменьшить частоту гипогликемических состояний.
В 2010 г. препарату Манинил® (глибенкламид) была присуждена Премия лекарственных средств им. Г.Г. Крейтцфельдта. Данной премией награждается препарат, сыгравший важную роль в терапии того или иного заболевания, при этом особое внимание уделяется эффективности, безопасности и долгосрочным благоприятным эффектам, подтвержденным в результате многоцентровых исследований. Впервые данная премия была учреждена на 40 Конгрессе терапевтов Германии и названа в честь выдающегося ученого Ганса Герхарда Крейтцфельдта, немецкого нейроинфекциониста, который выявил и описал прионовые болезни. Препарат, «номинируемый» на премию Крейтцфельдта, оценивают по семи критериям:
- эффективность, подтвержденная долгосрочными исследованиями. Как указывалось выше, глибенкламид – один из самых первых сахароснижающих препаратов, клиническое применение которого началось в 1969 г. Действие препарата изучали во многих исследованиях, причем в качестве как моно-, так и комбинированной терапии. Сегодня глибенкламид считается «золотым стандартом» среди пероральных сахароснижающих препаратов. При монотерапии Манинил® (глибенкламид) приводит к снижению уровня HbA1c на 1,2–1,9%, в зависимости от его исходной концентрации;
- при оценке риска развития отсроченных осложнений выявлено, что снижение уровня HbA1c на 1% приводит к уменьшению относительного риска инфаркта миокарда на 14%, а микрососудистых осложнений на 37% [54];
- эффективность и безопасность, подтвержденная в долгосрочных испытаниях. В Германии глибенкламид оказался единственным производным сульфонилмочевины, который привел к значимому снижению частоты микрососудистых осложнений у пациентов с сахарным диабетом 2 типа [11];
- оценивается не только эффективность, но и возможность комбинировать лекарственные вещества. При комбинации глибенкламида с метформином доказано значительное улучшение метаболического контроля [12]. В случае недостаточной эффективности в качестве монотерапии глибенкламид может быть назначен и в комбинации с ингибиторами альфа-глюкозидаз и агонистами PPAR-гамма (при противопоказаниях или непереносимости метформина). Ряду пациентов может быть назначена и тройная терапия (глибенкламид + метформин + глитазон) [55–58];
- оценка возможности назначения препарата пожилым пациентам, с коморбидной патологией;
- наличие препарата в списке жизненно важных лекарственных средств ВОЗ. Глибенкламид входит в список жизненно важных лекарственных средств ВОЗ (16-я редакция списка (март 2010));
- доступная цена препарата. Глибенкламид имеет значимо более низкую стоимость по сравнению с другими производными сульфонилмочевины, не говоря уже о новых классах сахароснижающих препаратов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.