количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Техника инъекций инсулина, или как правильно подобрать иглу
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" Спецвыпуск №1
- Аннотация
- Статья
- Ссылки
На основании данных новых исследований авторы разбирают технику проведения подкожных инъекций и рассказывают, как уменьшить количество ошибок при введении инсулина и соответственно снизить частоту гипогликемических реакций.
Инсулинотерапия является единственным методом лечения больных сахарным диабетом 1 типа. Почти четверть пациентов с сахарным диабетом 2 типа в России получают инсулинотерапию. Оптимального лечения этих пациентов можно добиться только в случае соблюдения правил выполнения инъекций, подбора игл, их оптимальной длины.
На основании данных новых исследований авторы разбирают технику проведения подкожных инъекций и рассказывают, как уменьшить количество ошибок при введении инсулина и соответственно снизить частоту гипогликемических реакций.
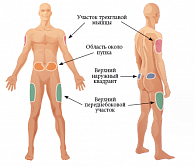
Рис. 1. Места введения инсулина
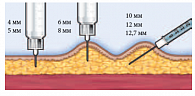
Рис. 2. Техника введения инсулина у взрослых в зависимости от длины иглы
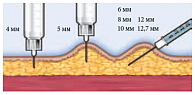
Рис. 3. Техника введения инсулина у детей и подростков в зависимости от длины иглы
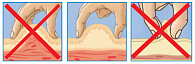
Рис. 4. Формирование кожной складки
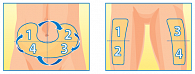
Рис. 5. Чередование квадрантов на животе и бедрах

Рис. 6. Игла под увеличением в 370 раз до и после инъекции

Рис. 7. Шприц-ручки
В 1921 г. канадские врачи Фредерик Грант Бантинг (Frederick Grant Banting) и Чарльз Герберт Бест (Charles Herbert Best) первыми получили экстракт из поджелудочной железы собак, который устранил гипергликемию и глюкозурию у больных сахарным диабетом. Через год были приготовлены первые коммерческие препараты инсулина из очищенного экстракта поджелудочной железы, а в 1923 г. за открытие инсулина Бантингу и Бесту была вручена Нобелевская премия.
Для введения инсулина понадобились специальные шприцы, позволявшие четко дозировать препарат и обеспечивавшие его введение в подкожно-жировую клетчатку. В 1924 г. компания «Бектон Дикинсон» выпускает первый в мире шприц для введения инсулина. Сегодня применяются несколько способов введения инсулина: с использованием одноразовых шприцев, шприц-ручек (в 1985 г. была разработана многоразовая шприц-ручка для инсулина, в 1989 г. – одноразовая предварительно заполненная шприц-ручка) и инсулиновых дозаторов (помп).
Единственным патогномоничным препаратом для лечения сахарного диабета (СД) 1 типа является постоянная заместительная инсулинотерапия, так как ведущий механизм развития СД 1 типа – это аутоиммунное поражение бета-клеток с последующей их деструкцией и развитием абсолютного дефицита инсулина. Длительное время в лечении СД 2 типа в основном применялись таблетированные сахароснижающие препараты. Это обстоятельство объясняется патогенезом формирования СД 2 типа: снижением чувствительности периферических инсулинзависимых тканей к действию инсулина или инсулинорезистентностью (ИР) и недостаточной (неадекватной) секрецией инсулина.
В последние годы доказано, что ИР чаще всего является генетически детерминированным процессом, который усугубляется по мере прогрессирования ожирения. Постепенно развивается неспособность инсулярного аппарата поджелудочной железы к адекватной продукции инсулина для преодоления ИР. По данным лабораторных исследований, у таких пациентов формируется сначала недостаточность, а позже – отсутствие 1-й фазы секреции инсулина, физиологическая роль которой состоит в регуляции посталиментарной гликемии и тем самым – в предотвращении гипергликемических пиков.
Формируется так называемый порочный круг: снижение чувствительности периферических тканей к инсулину, с одной стороны, стимулирует его секрецию, а с другой стороны, за счет нарастания постпрандиальной гипергликемии появляется феномен глюкозотоксичности, приводящий к апоптозу бета-клеток и снижению их секреторных возможностей. Показано, что при установлении СД 2 типа в среднем секреция инсулина снижается на 50%, продолжая снижаться на 4–6% ежегодно [1]. Гиперинсулинизм, направленный на преодоление гипергликемии, приводит к повышению аппетита, следовательно, к нарастанию массы тела, что усугубляет ИР и повышает потребность в секреции инсулина.
В последнее время все чаще для достижения компенсации углеводного обмена, уменьшения осложнений сахарного диабета в лечении пациентов с СД 2 типа применяют инсулинотерапию. Данный вид терапии при СД 2 типа в США составляет приблизительно 40%. В России еще 5 лет назад только 10% пациентов с СД 2 типа находились на инсулинотерапии, а в настоящее время уже более 20%.
Еще в 1902 г. Эрнест Генри Старлинг (Ernest Henry Starling) описал эффект секретина. Значительно позже, в 1932 г., для обозначения гормональной активности кишечника, которая приводит к повышению секреции инсулина, стали использовать термин «инкретин». У пациентов СД 2 типа выявляется недостаток инкретинов, и, как следствие, увеличивается постпрандиальная гликемия. Именно поэтому сегодня применяют препараты – агонисты глюкагоноподобного пептида-1 (ГПП-1), которые так же как и инсулин вводят подкожно с использованием шприц-ручек. Следует помнить, что сахарный диабет относится к числу наиболее распространенных заболеваний, приводящих к ранней инвалидизации и высокой смертности. По данным Международной федерации диабета (IDF) [2], в настоящее время в мире насчитывается 285 млн больных СД в возрасте 20–79 лет, из которых 85–95% составляют пациенты с СД 2 типа.
Предполагается, что к 2030 г. общее число больных СД увеличится до 438 млн человек. Таким образом, СД будет страдать каждый 19-й человек на Земле. В Российской Федерации численность больных СД составляет около 9 млн, и только за последние 10 лет она возросла в 2 раза [3]. Так, по данным Российского регистра, сахарным диабетом страдают около 3 млн 200 тысяч человек [4]. По прогнозам ВОЗ, к 2030 г. в России будет 13,8 млн больных СД, однако, по нашим оценкам, уже сейчас число больных СД в стране приближается к этому показателю [5]. Учитывая, что каждый третий пациент с СД использует инъекционные препараты, становится понятно, насколько актуальна проблема правильного подбора игл, места введения, техники инъекции. Использование парентерального пути введения препаратов предполагает выполнение четких и последовательных действий, направленных на соблюдение правил выполнения инъекций, подбора игл, оптимальной длины. От этого зависит как фармакодинамика, так и фармакокинетика, что является решающим фактором для оптимального лечения пациентов с СД [6].
Данная статья посвящена новым исследованиям в этой области. Впервые результаты длительных исследований по технике проведения инъекций были представлены [7], а затем и опубликованы в 2002 г. [8]. Прежде всего давайте разберемся, что необходимо учитывать для правильного проведения подкожной инъекции или что включает понятие «тактика подкожной инъекции»? Существует всего четыре основных правила: выбор места введения, длины иглы, угла введения иглы и приподнимание кожной складки. Места введения подкожных препаратов были определены еще в прошлом столетии. Чаще всего для подкожного введения рекомендуют использовать плечо (участок трехглавой мышцы), бедро (верхний переднебоковой участок), живот (область около пупка), ягодицы (верхний наружный квадрант) (рис. 1). Пациенты, страдающие сахарным диабетом, – это хронические больные, большинству из которых требуется проведение ежедневных инъекций, при СД 1 типа необходимы многократные ежедневные инъекции.
Обозначенные на рисунке 1 зоны определены для возможных самостоятельных инъекций. Имеются ли какие-либо различия в толщине кожи (ТК) и подкожно-жировой клетчатки (ПЖК) между этими местами? Ответ на этот вопрос попытались дать Майкл Гибни (Michael A. Gibney) и соавт. [9]. Проведя многомерный анализ, они выявили, что существенное влияние на ТК оказывают место инъекции (р < 0,001), пол пациента (р < 0,001), ИМТ (р < 0,001), тип диабета, прием инсулина (р = 0,008), раса/национальность (р = 0,009). Данные анализа показали, что возраст взрослых реципиентов не имел статистической важности (р = 0,369) – в отличие от детей, у которых отмечается увеличение ТК по мере взросления [10]. Среднее значение ТК различается в зависимости от места. Так, в области плеч толщина кожи составляет 2,2 мм, в области бедер – 1,9 мм, в районе живота – 2,2 мм и в области ягодиц – 2,4 мм. Соответственно наиболее тонкая кожа расположена в области бедер, наиболее толстая – в области ягодиц, различие составляет 0,57 мм; и ни в одной из областей средние показатели не превышали 3 мм. У мужчин кожа оказалась толще, чем у женщин, на 0,3 мм. Показатель индекса массы тела (ИМТ) оказывает некоторое влияние на ТК. Пациенты с ожирением имеют ТК больше, чем худощавые. Изменение ИМТ на 10 кг/м2 коррелирует с изменением ТК на менее 0,2 мм. Раса и тип диабета имеют незначительный эффект на значения ТК. Толщина ПЖК колебалась незначительно – в зависимости от места: бедро – 10,35 мм (минимальное значение), плечо – 10,77 мм, живот – 13,92 мм, ягодицы – 15,45 мм (максимальное значение).
Толщина подкожно-жировой клетчатки женщин на 5,1 мм больше, чем у мужчин. Увеличение ИМТ на 10 кг/м2 приводило к утолщению ПЖК на 4 мм. Выявлено влияние типа СД на ПЖК у пациентов. Так, для СД 2 типа характерно увеличение ПЖК на 5 мм в области живота и снижение на 2,3 мм в области ягодиц, по сравнению с пациентами с СД 1 типа. Это может быть обусловлено абдоминальным типом ожирения на фоне инсулинорезистентности при СД 1 типа. Возрастных отличий по параметру толщины ПЖК не обнаружено. Выявленные отличия необходимо учитывать при выборе длины иглы. Первые иглы для подкожных инъекций были длиной 16 мм, что часто приводило к введению препарата в мышцу и изменяло его характеристики (фармакодинамику/фармакокинетику). Создание более коротких игл (12,7 мм) уменьшило частоту гипогликемических состояний у взрослых с ожирением, но сохранило высокий риск таких состояний у пациентов с дефицитом массы и у детей [11, 12]. Приблизительно такие же результаты получены при применении игл длиной 8 мм [13]. Частое развитие гипогликемических реакций послужило поводом для создания более коротких игл – длиной 5 и 4 мм.
Напомним, что у взрослых пациентов толщина кожи варьирует на различных участках тела, но не бывает более 3 мм. Это позволяет практически исключить проведение внутрикожной вместо подкожной инъекции при введении препарата под углом 90°. Однако инъекция на глубину 6 мм делается на уровне мышечной фасции, а на глубину 8 мм производится в мышечную ткань. Именно поэтому ряд исследователей указывают на необходимость соблюдения еще двух правил: правильного угла введения и формирования кожной складки у ряда пациентов [13–15]. Тем не менее при использовании игл более 6 мм, особенно у детей и лиц с дефицитом массы тела, рекомендуется собирать кожную складку и выполнять инъекцию под углом 45° [16–18]. Наиболее удобной по применению является следующая классификация игл по длине:
- 4–5 мм – короткие иглы;
- 6–8 мм – иглы средней длины;
- 8 мм – длинные иглы.
Собирание кожной складки при помощи всей руки сопровождается риском захвата мышцы вместе с подкожными тканями и может привести к внутримышечной инъекции. Не следует сжимать кожу слишком сильно, то есть до ее побледнения или появления боли. Необходимо избегать сдавления или смещения кожи во время инъекции для предотвращения внутримышечного введения препарата. Собрать кожную складку на ногах или животе сравнительно легко (за исключением очень толстых тугих животов), но гораздо сложнее это сделать в области ягодиц (здесь редко возникает в этом необходимость) и практически невозможно (для пациентов, выполняющих инъекции самостоятельно) правильно проделать эту манипуляцию на руках. Если необходимо провести инъекцию с использованием кожной складки, следует помнить следующую последовательность действий: во-первых, сформируйте кожную складку; во-вторых, введите иглу под углом 45° или 90°, медленно введите инсулин; в-третьих, не спешите вынимать иглу, задержите ее в коже на 10 секунд (при использовании шприц-ручки) и только после этого извлеките иглу из кожи; и последнее – расправьте кожную складку и безопасно отсоедините использованную иглу.
Вне зависимости от длины иглы необходимо использовать разные места для введения препарата, чтобы избежать формирование зон липодистрофий/липогипертрофий [24–26]. Существуют несколько схем чередования зон, например, область для инъекций разделяется на четыре квадранта (или части, когда речь идет о бедрах или ягодицах), при этом каждую неделю используется только один квадрант, а затем – следующий, с чередованием по часовой стрелке (рис. 5) [27]. Кроме того, могут использоваться различные ротационные решетки для передней брюшной стенки и верхней наружной поверхности бедра, которые помогают определить место следующей инъекции. При этом расстояние между инъекциями должно быть минимум 1 см друг от друга. Не только длина иглы важна для проведения качественной инъекции. Современные иглы имеют несколько особенностей: у них увеличенный внутренний просвет (так называемая тонкостенная технология, позволяющая увеличить внутренний просвет иглы при сохранении стандартного внешнего диаметра), что позволяет уменьшить силу давления на поршень шприц-ручки, увеличивая скорость введения инсулина.
Тройная заточка острия иглы и уникальная геометрия позволяют уменьшить травматичность при проведении инъекции. Лазерная обработка хирургической стали обеспечивает гладкую и ровную поверхность иглы. Финальное электрополирование в гальванических ваннах удаляет все мелкие фрагменты с поверхности иглы. Патентованное силиконовое покрытие наружной и внутренней поверхности иглы делает инъекцию менее болезненной. Но как бы ни была высокотехнологична игла, при повторном использовании на ней происходят значимые изменения, что продемонстрировано на рисунке 6. При повторном использовании прежде всего происходит кристаллизация вводимого препарата, что может привести к закупорке просвета иглы и/или поломке механизма шприц-ручки, таким образом изменив количество вводимого препарата, и вызвать ложную необходимость проведения коррекции проводимой терапии. За счет деформации острия иглы и стирания силиконового покрытия происходят откалывание кончика иглы и травмирование тканей деформированным кончиком иглы, приводящие к развитию липодистрофий и возникновению чувства боли во время инъекции. Во избежание данных осложнений от инъекций рекомендуется регулярная смена игл (после каждого укола!).
Если оставлять накрученную на картридж иглу, то через нее могут происходить дополнительное выделение препарата, попадание воздуха и других элементов внутрь шприц-ручки, что увеличивает риск развития инфекции в местах проведения инъекции. Качество и длина иглы играют немаловажную роль в надежной доставке действующего вещества в подкожное пространство – без обратного вытекания инсулина. Важное требование к иглам – наличие универсальной резьбы, что обеспечивает совместимость игл со всеми шприц-ручками (рис. 7). Доказанная независимыми тестами совместимость обозначается как ISO «TYPE A» EN ISO 11608-2:2000 и указывает на то, что шприц-ручка и иглы «TYPE A» сочетаются между собой. Использование игл, несовместимых со шприц-ручкой, может стать причиной вытекания инсулина. Более раннее начало инсулинотерапии (при СД 2 типа), разработка и применение новых парентеральных препаратов для лечения диабета обусловили необходимость заново оценить особенности проведения подкожной терапии. Именно поэтому появились иглы более короткие и менее опасные. Модификация игл привела к уменьшению частоты ошибок при введении инсулина и, как следствие, к снижению частоты гипогликемических реакций. Учитывая высказывание Филиппа Крайера (Philip E. Cryer): «Если бы не разрушительные последствия гипогликемии, лечение сахарного диабета было бы очень легким», можно с полной уверенностью сказать, что появление в нашем арсенале новых игл облегчает лечение наших пациентов!
1. Shim W.S., Kim S.K, Kim H.J. Decrement of postprandial insulin secretion determines the progressive nature of type 2 diabetes // Eur. J. Endocrinol. Vol. 155. 2006. № 4. P. 615–622.
2. Diabetes Atlas. Fourth edition / International Diabetes Federation, 2009.
3. Дедов И.И., Шестакова М.В. Инкретины: новая веха в лечении сахарного диабета 2-го типа. Практическое руководство для врачей. М.: Дипак, 2010. 92 с.
4. Заболеваемость населения социально-значимыми болезнями (зарегистрировано больных с диагнозом, установленным впервые в жизни) (данные Минздравсоцразвития России, расчет Росстата) // www.gks.ru.
5. Мкртумян А.М. Саксаглиптин открывает новые возможности эффективного и безопасного контроля гликемии у больных сахарным диабетом типа 2 // Фарматека. 2010. № 16. С. 16–20.
6. De Meijer P.H.E.M., Lutterman J.A., van Lier H.J.J., van´t Laar A. The variability of the absorption of subcutaneously injected insulin; effect on injection technique and relation with brittleness // Diabet. Med. Vol. 7. 1990. № 6. P. 499–505.
7. Strauss K., De Gols H., Letondeur C., Matyjaszczyk M., Frid A. The second injection technique event (SITE), May 2000, Barcelona // Pract. Diab. Int. Vol. 19. 2002. № 1. P. 17–21.
8. Strauss K., De Gols H., Hannet I., Partanen T.M., Frid A. A pan-European epidemiologic study of insulin injection technique in patients with diabetes // Pract. Diab. Int. Vol. 19. 2002. № 3. P. 71–76.
9. Gibney M.A., Arce C.H., Byron K.J., Hirsch L.J. Skin and subcutaneous adipose layer thickness in adults with diabetes at sites used for insulin injections: implications for needle length recommendations // Curr. Med. Res. Opin. Vol. 26. 2010. № 6. P. 1519–1530.
10. Seidenari S., Giusti G., Bertoni L., Magnoni C., Pellacani G. Thickness and echogenicity of the skin in children as assessed by 20-MHz ultrasound // Dermatology. Vol. 201. 2000. № 3. P. 218–222.
11. Polak M., Beregszaszi M., Belarbi N., Benali K., Hassan M., Czernichow P., Tubiana-Rufi N. Subcutaneous or intramuscular injections of insulin in children. Are we injecting where we think we are? // Diabetes Care. Vol. 19. 1996. № 12. P. 1434–1436.
12. Vaag A., Handberg A., Lauritzen M., Henriksen J.E., Pedersen K.D., Beck-Nielsen H. Variation in absorption of NPH insulin due to intramuscular injection // Diabetes Care. Vol. 13. 1990. № 1. P. 74–76.
13. Tubiana-Rufi N., Belarbi N., Du Pasquier-Fediaevsky L., Polak M., Kakou B., Leridon L., Hassan M., Czernichow P. Short needles (8 mm) reduce the risk of intramuscular injections in children with type 1 diabetes // Diabetes Care. Vol. 22. 1999. № 10. P. 1621–1625.
14. Hofman P.L., Lawton S.A., Peart J.M., Holt J.A., Jefferies C.A., Robinson E., Cutfield W.S. An angled insertion technique using 6-mm needles markedly reduces the risk of intramuscular injections in children and adolescents // Diabet. Med. Vol. 24. 2007. № 12. P. 1400–1405.
15. Birkebaek N.H., Solvig J., Hansen B., Jorgensen C., Smedegaard J., Christiansen J.S. A 4-mm needle reduces the risk of intramuscular injections without increasing backflow to skin surface in lean diabetic children and adults // Diabetes Care. Vol. 31. 2008. № 9. P. 665–677.
16. Kreugel G., Beijer H.J.M., Kerstens M.N., ter Maaten J.C., Sluiter W.J., Boot B.S. Influence of needle size on metabolic control and patient acceptance // Eur. Diabetes Nurs. Vol. 4. 2007. № 2. P. 51–55.
17. Schwartz S., Hassman D., Shelmet J., Sievers R., Weinstein R., Liang J., Lyness W. A multicenter, open-label, randomized, two-period crossover trial comparing glycemic control, satisfaction, and preference achieved with a 31 gauge x 6mm needle versus a 29 gauge x 12.7mm needle in obese patients with diabetes mellitus // Clin. Ther. Vol. 26. 2004. № 10. P. 1663–1678.
18. Frid A., Linde´n B. Where do lean diabetics inject their insulin? A study using computed tomography // Br. Med. J. (Clin. Res. Ed.). Vol. 292. 1986. № 6536. P. 1638.
19. Jamal R., Ross S.A., Parkes J.L., Pardo S., Ginsberg B.H. Role of injection technique in use of insulin pens: prospective evaluation of a 31-gauge, 8mm insulin pen needle // Endocr. Pract. Vol. 5. 1999. № 5. P. 245–250.
20. Van Doorn L.G., Alberda A., Lytzen L. Insulin leakage and pain perception with NovoFine 6 mm and NovoFine 12 mm needle lengths in patients with type 1 or type 2 diabetes // Diabet. Med. Vol. 15. 1998. Suppl. 1. P. S50.
21. Clauson P.G., Linde B. Absorption of rapid-acting insulin in obese and nonobese NIIDM patients // Diabetes Care. Vol. 18. 1995. № 7. P. 986–991.
22. Kreugel G., Keers J.C., Jongbloed A., Verweij-Gjaltema A.H., Wolffenbuttel B.H.R. The influence of needle length on glycemic control and patient preference in obese diabetic patients // Diabetes. Vol. 58. 2009. Suppl. 1. Abstract 440-P.
23. Strauss K., Hannet I., McGonigle J., Parkes J.L., Ginsberg B., Jamal R., Frid A. Ultra-short (5 mm) insulin needles: trial results and clinical recommendations // Pract. Diab. Int. Vol. 16. 1999. № 7. P. 218–222.
24. Ahern J., Mazur M.L. Site rotation // Diabetes Forecast. Vol 54. 2001. № 4. P. 66–68.
25. Bantle J.P., Weber M.S., Rao S.M., Chattopadhyay M.K., Robertson R.P. Rotation of the anatomic regions used for insulin injections day-to-day variability of plasma glucose in type 1 diabetic subjects // JAMA. Vol 263. 1990. № 13. P. 1802–1806.
26. Davis E.D., Chesnaky P. Site rotation...taking insulin // Diabetes Forecast. Vol 45. 1992. № 3. P. 54–56.
27. Diagram courtesy of Lourdes Saez-de Ibarra and Ruth Gaspar, Diabetes Nurses and Specialist Educators of La Paz Hospital, Madrid, Spain.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.