Оптимизация медикаментозного лечения остеонекроза головки бедренной кости, развившегося после новой коронавирусной инфекции: результаты сравнительного наблюдательного проспективного исследования в условиях реальной клинической практики
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включены 67 пациентов c ОН головки бедренной кости, развившимся после COVID-19, которые обратились в клинику Национального медицинского исследовательского центра травматологии и ортопедии им. Р.Р. Вредена. Диагноз ОН устанавливался на основании классификации Ассоциации исследователей кровообращения в костной ткани (Association Research Circulation Osseous – ARCO). Были отобраны пациенты с первой – третьей стадиями ОН по классификации АRCO. У больных также отмечалась коморбидная патология: у 36 (53,7%) – гипертоническая болезнь, у 16 (23,8%) – сахарный диабет, у 15 (22,4%) – ревматоидный артрит, у десяти (14,9%) – хроническая болезнь почек, у девяти (13,4%) – хроническая обструктивная болезнь легких, у восьми (11,9%) – ишемическая болезнь сердца, у семи (10,4%) – острое нарушение мозгового кровообращения, у пяти (7,4%) – подагра.
В зависимости от тактики лечения участники исследования были распределены на три группы. В первой группе (n = 22) наблюдалась низкая комплаентность лечению. Пациенты снижали нагрузку на ТБС с помощью костылей и применяли НПВП для снятия болевого синдрома. Во второй группе (n = 21) проводилась разгрузка ТБС и комплексная медикаментозная терапия с использованием НПВП, антирезорбтивных препаратов, препаратов кальция, витамина D, антикоагулянтов, а также дополнительно в/м вводился Алфлутоп в дозе 2,0 мл через день № 10. В третьей группе (n = 24) получали такую же медикаментозную терапию, что и во второй группе, за исключением Алфлутопа.
Пациенты изучаемых групп были сопоставимы по полу, возрасту, стадиям ОН, объему поражения головки бедренной кости и коморбидным состояниям.
Исходно, через 7–10, 14–18 и 21–28 дней оценивались выраженность болевого синдрома по визуальной аналоговой шкале (ВАШ), показатели функции ТБС по Оксфордской шкале тазобедренного сустава (Oxford Hip Score – OHS), потребность в НПВП, а также степень хромоты. Статистический анализ проводился с использованием программы IBM SPSS Statistics 26. Различия признавались значимыми при p < 0,05.
Результаты. К концу исследования в первой группе отсутствовали статистически значимые изменения показателей по ВАШ, OHS, частоты приема НПВП и степени хромоты относительно исходных. Во второй группе, в которой проводилась разгрузка сустава и комплексная медикаментозная терапия с добавлением в/м введения Алфлутопа в дозе 2,0 мл через день № 10, уже через 14–18 дней наблюдалось снижение потребности в НПВП и более быстрое уменьшение степени хромоты. К 21–28-м суткам терапии в данной группе по сравнению с третьей группой на 30% увеличился прирост показателей, оцениваемых по OHS.
За период наблюдения ухудшения течения коморбидной патологии и развития нежелательных явлений у пациентов в изучаемых группах не зафиксировано.
Заключение. Алфлутоп оказывает симптоматический и структурно-модифицирующий эффекты при ОН головки бедренной кости, развившемся после COVID-19. Кроме того, потенциально он способствует снижению сердечно-сосудистого риска у коморбидных пациентов вследствие сокращения потребности в НПВП. Риск развития желудочно-кишечных кровотечений позволяет уменьшить антикоагулянтная терапия. Полученные данные обосновывают использование препарата в ревматологической, травматологической и ортопедической практике для оптимизации комплексной медикаментозной терапии пациентов с ОН головки бедренной кости.
Материал и методы. В исследование включены 67 пациентов c ОН головки бедренной кости, развившимся после COVID-19, которые обратились в клинику Национального медицинского исследовательского центра травматологии и ортопедии им. Р.Р. Вредена. Диагноз ОН устанавливался на основании классификации Ассоциации исследователей кровообращения в костной ткани (Association Research Circulation Osseous – ARCO). Были отобраны пациенты с первой – третьей стадиями ОН по классификации АRCO. У больных также отмечалась коморбидная патология: у 36 (53,7%) – гипертоническая болезнь, у 16 (23,8%) – сахарный диабет, у 15 (22,4%) – ревматоидный артрит, у десяти (14,9%) – хроническая болезнь почек, у девяти (13,4%) – хроническая обструктивная болезнь легких, у восьми (11,9%) – ишемическая болезнь сердца, у семи (10,4%) – острое нарушение мозгового кровообращения, у пяти (7,4%) – подагра.
В зависимости от тактики лечения участники исследования были распределены на три группы. В первой группе (n = 22) наблюдалась низкая комплаентность лечению. Пациенты снижали нагрузку на ТБС с помощью костылей и применяли НПВП для снятия болевого синдрома. Во второй группе (n = 21) проводилась разгрузка ТБС и комплексная медикаментозная терапия с использованием НПВП, антирезорбтивных препаратов, препаратов кальция, витамина D, антикоагулянтов, а также дополнительно в/м вводился Алфлутоп в дозе 2,0 мл через день № 10. В третьей группе (n = 24) получали такую же медикаментозную терапию, что и во второй группе, за исключением Алфлутопа.
Пациенты изучаемых групп были сопоставимы по полу, возрасту, стадиям ОН, объему поражения головки бедренной кости и коморбидным состояниям.
Исходно, через 7–10, 14–18 и 21–28 дней оценивались выраженность болевого синдрома по визуальной аналоговой шкале (ВАШ), показатели функции ТБС по Оксфордской шкале тазобедренного сустава (Oxford Hip Score – OHS), потребность в НПВП, а также степень хромоты. Статистический анализ проводился с использованием программы IBM SPSS Statistics 26. Различия признавались значимыми при p < 0,05.
Результаты. К концу исследования в первой группе отсутствовали статистически значимые изменения показателей по ВАШ, OHS, частоты приема НПВП и степени хромоты относительно исходных. Во второй группе, в которой проводилась разгрузка сустава и комплексная медикаментозная терапия с добавлением в/м введения Алфлутопа в дозе 2,0 мл через день № 10, уже через 14–18 дней наблюдалось снижение потребности в НПВП и более быстрое уменьшение степени хромоты. К 21–28-м суткам терапии в данной группе по сравнению с третьей группой на 30% увеличился прирост показателей, оцениваемых по OHS.
За период наблюдения ухудшения течения коморбидной патологии и развития нежелательных явлений у пациентов в изучаемых группах не зафиксировано.
Заключение. Алфлутоп оказывает симптоматический и структурно-модифицирующий эффекты при ОН головки бедренной кости, развившемся после COVID-19. Кроме того, потенциально он способствует снижению сердечно-сосудистого риска у коморбидных пациентов вследствие сокращения потребности в НПВП. Риск развития желудочно-кишечных кровотечений позволяет уменьшить антикоагулянтная терапия. Полученные данные обосновывают использование препарата в ревматологической, травматологической и ортопедической практике для оптимизации комплексной медикаментозной терапии пациентов с ОН головки бедренной кости.







Введение
Профилактика и лечение COVID-19 до сих пор являются актуальной медицинской проблемой, что связано с формированием широкого спектра осложнений [1]. Остеонекроз костей (ОН) как следствие перенесенного COVID-19 является причиной выраженного болевого синдрома в области крупных суставов и нарушения их функции [2]. Установлено, что ОН развивается у 5–58% пациентов при тяжелой форме COVID-19 [3]. Очаги ОН отмечены в мыщелках бедренной и большеберцовой костей, головке плечевой кости, таранной и пяточной костях и других областях скелета [4]. Исходом ОН чаще является тяжелый вторичный остеоартрит, который сопровождается прогрессирующим нарушением функции пораженного сустава [4, 5].
Известно, что SARS-CoV-2 проникает в клетки эндотелия сосудов через ангиотензинпревращающий фермент 2, который экспрессируется эндотелиальными клетками не только в легких, но и во многих других органах и тканях, что приводит к гиперкоагуляции и микротромбозу артерий, кровоснабжающих костную ткань, и, как следствие, к развитию ОН костей, расположенных дистальнее от места обструкции артерии [6]. В последнее десятилетие в патогенезе ОН установлена роль генетически обусловленных тромбофилий, коагулопатий и эндотелиальной дисфункции [7].
При инфицировании SARS-CoV-2 усугублению поражения эндотелия сосудов и костной ткани, а также общего воспаления способствует и цитокиновый шторм вследствие чрезмерной активации провоспалительных цитокинов, таких как интерферон γ, фактора некроза опухоли, интерлейкины (ИЛ) 1, 6, и хемотаксиса Т-лимфоцитов в очаге воспаления. В этой ситуации результатом микротромбоза и прямого повреждения сосудов вирусом может быть развитие асептического некроза [8].
Большее влияние на риск формирования ОН при COVID-19 оказывает прием глюкокортикоидов [9]. Данные препараты влияют на пролиферацию мезенхимальных стволовых клеток: блокируют специфический транскрипционный фактор, ответственный за дифференцировку остеобластов, RUNX2, препятствуют образованию преостеобластов и их переходу в остеобласты, что снижает количество зрелых остеобластов и приводит к повышенному формированию адипоцитов из мезенхимальных клеток [10, 11]. Глюкокортикоиды повышают апоптоз остеобластов и остеоцитов, а также активируют остеокласты за счет влияния на систему RANKL и DKK-1 сигнальных белков [12].
Неблагоприятное воздействие глюкокортикоидов на костную ткань реализуется и за счет их включения в липидный обмен. Накопление липопротеинов низкой плотности, образование жировых эмболов обусловливают нарушение кровоснабжения периферических кровеносных сосудов и, как следствие, развитие ишемического некроза костной ткани [13, 14]. Прямой апоптоз эндотелиальных клеток и подавление синтеза коллагена сосудов глюкокортикоидами препятствуют реваскуляризации и восстановлению костной ткани в зоне ОН [15].
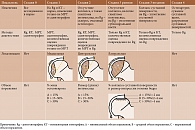
Диагностика ОН основана на оценке клинических проявлений, прежде всего боли. При ОН головки бедренной кости боль в паху не всегда имеет четкую локализацию. Она может иррадиировать в ягодичную область или в область коленного сустава [16]. Кроме того, показано проведение инструментальных методов исследования – рентгенографии и магнитно-резонансной томографии (МРТ) [17]. При постановке диагноза для выбора тактики лечения и прогноза рекомендуется использовать классификацию Ассоциации исследователей кровообращения в костной ткани (Association Research Circulation Osseous – ARCO) [1], выделяющую четыре основные стадии заболевания (табл. 1) [18].
При установлении диагноза на первой или второй стадии 92–97% пациентов не нуждаются в хирургическом вмешательстве, а консервативное лечение может завершиться выздоровлением [18]. Основными целями лечения ОН на ранних стадиях являются снижение выраженности болевого синдрома, замедление прогрессирования заболевания, предотвращение коллапса субхондральной кости и восстановление функции сустава [19].
На сегодняшний день стандартизированного протокола для лечения ранних стадий ОН, развившегося после перенесенного COVID-19, не существует. В клинической практике часто применяется комбинация медикаментозных методов и разгрузки сустава [20]. Разгрузка сустава показана в течение не менее трех месяцев. В случае локализации остеонекроза в головке бедренной кости она проводится с помощью костылей. При локализации в других частях скелета помимо костылей можно использовать трость и ортез [21]. Для уменьшения выраженности болевого синдрома применяются нестероидные противовоспалительные препараты (НПВП) [22].
Замедлить прогрессирование заболевания и снизить необходимость хирургического вмешательства способны антирезорбтивные препараты (бисфосфонаты, деносумаб). Их действие направлено на уменьшение интенсивности резорбции в зоне ОН и, как следствие, риска развития коллапса субхондральной кости [23]. Однако эта группа препаратов при ОН назначается off-label. Кроме того, при использовании антирезорбтивных препаратов одновременно требуются препараты кальция и колекальциферола. В качестве анаболической терапии при ОН рекомендуется терипаратид, стимулирующий костеобразование [24]. Для оказания ангиопротективного и антиагрегационного эффектов, улучшения коллатерального кровотока, торможения агрегации тромбоцитов с увеличением микроциркуляции и снижения риска артериального тромбоза назначают дипиридамол. В качестве ингибитора агрегации тромбоцитов, ангиопротективного и сосудорасширяющего средства для улучшения микроциркуляции в зоне ОН рекомендуется илопрост. При наличии у пациентов с ОН гиперкоагуляции или гипофибринолиза для предотвращения прогрессирования болезни в комплексную терапию целесообразно включать антикоагулянты [23].
У больных ОН также можно использовать импульсную электромагнитную терапию, гипербарическую оксигенацию, озонотерапию, экстракорпоральную ударно-волновую терапию.
На начальных стадиях заболевания для снижения болевого синдрома и улучшения кровоснабжения возможна туннелизация очага пораженного участка головки бедренной кости, которая проводится после ранее назначенной консервативной терапии. На третьей стадии ОН по классификации ARCO рекомендуется выполнить тотальное эндопротезирование сустава или использовать костный аутотрансплантат на сосудистой ножке (у молодых пациентов) [25]. При четвертой стадии ОН по классификации ARCO после коллапса субхондральной кости и при наличии боли рекомендуется эндопротезирование сустава [20].
Cерьезным осложнением ОН является развитие вторичного остеоартрита. Для профилактики его формирования и уменьшения выраженности болевого синдрома рассматривается возможность применения хондроитина и глюкозамина, однако этот подход требует дальнейших клинических подтверждений. В данной случае перспективным препаратом в комплексном патогенетическом лечении ОН может стать Алфлутоп.
Алфлутоп относится к фармакологической группе «репарации тканей стимулятор природного происхождения» или, с клинической точки зрения, препарат медленного действия для терапии остеоартрита (SYSADOA), не имеет МНН.
Активным компонентом препарата является биоактивный концентрат из мелких морских рыб. Концентрат содержит мукополисахариды (хондроитина сульфат), аминокислоты, пептиды, ионы натрия, калия, кальция, магния, железа, меди и цинка.
Многоплановая биологическая активность Алфлутопа объясняется стимулированием пролиферации хондроцитов, активации синтеза внеклеточного матрикса посредством модуляции трансформирующего фактора роста фибробластов, ингибированием гиалуронидазы, снижением окислительного стресса и экспрессии генов ИЛ-6, ИЛ-8 и ИЛ-1b. Указанные эффекты обосновывают его применение не только для лечения уже сформировавшегося остеоартрита, но и для профилактики его развития у пациентов с ОН [26]. Преимуществом препарата является возможность снижения потребности в НПВП, особенно при наличии коморбидных состояний (артериальной гипертензии, ишемической болезни сердца, язвенной болезни, хронической болезни почек), при которых риск развития осложнений на фоне их применения значительно выше [27, 28].
Цель исследования – оценить влияние Алфлутопа, применяемого в комплексной медикаментозной терапии коморбидных пациентов с ОН головки бедренной кости, развившимся после COVID-19, на выраженность болевого синдрома, функцию пораженного сустава, степень хромоты и потребность в НПВП.
Материал и методы
В исследование включены 67 пациентов c ОН головки бедренной кости, развившимся после тяжелого течения COVID-19 с двусторонней пневмонией, для комплексного лечения которой применялись глюкокортикоиды.
Все эти больные обратились в клинику Национального медицинского исследовательского центра травматологии и ортопедии им. Р.Р. Вредена по поводу выраженного болевого синдрома и нарушения функции тазобедренного сустава.
Диагноз ОН устанавливался на основании классификации ARCO [29].
В исследование были отобраны пациенты с ОН первой – третьей стадий по классификации АRCO. Расчет объема поражения головки бедренной кости проводили по результатам МРТ. Разделение очагов ОН по объему поражения выполнялось в соответствии с классификацией АRCO. До 15% поражения головки бедренной кости расценивали как малый объем, 15–30% – средний, более 30% – выраженный.
Среди участников исследования преобладали мужчины (55, или 82,1%) молодого и среднего возраста (34–52 года).
Формирование ОН бедренной кости происходило в срок до семи месяцев после перенесенного COVID-19.
У пациентов с ОН зафиксирована разнообразная коморбидная патология. В частности, у 36 (53,7%) – гипертоническая болезнь, у 16 (23,8%) – сахарный диабет, у 15 (22,4%) – ревматоидный артрит, у десяти (14,9%) – хроническая болезнь почек, у девяти (13,4%) – хроническая обструктивная болезнь легких, у восьми (11,9%) – ишемическая болезнь сердца, у семи (10,4%) – острое нарушение мозгового кровообращения, у пяти (7,4%) – подагра.
Методы лечения ОН оценивали ретроспективно. В зависимости от тактики лечения в условиях реальной клинической практики пациенты были распределены на три группы. Первую группу составили 22 пациента, некомплаентных рекомендованному медикаментозному лечению. Эти больные самостоятельно использовали только разгрузку тазобедренного сустава с помощью костылей и применяли НПВП для снятия болевого синдрома. У 21 больного второй группы проводились разгрузка тазобедренного сустава и комплексная медикаментозная терапия НПВП, антирезорбтивными препаратами (алендронатом), препаратами кальция, витамина D, антикоагулянтами, а также в/м вводился Алфлутоп в дозе 2,0 мл через день № 10. В третьей группе 24 пациента получали аналогичную со второй группой терапию, однако без Алфлутопа.
Все пациенты с ОН получали амбулаторное лечение.
Больные в изучаемых группах были сравнимы по полу, возрасту, стадиям ОН, объему поражения головки бедренной кости и коморбидным состояниям.
Исходно, через 7–10, 14–18 и 21–28 дней оценивались выраженность болевого синдрома от нуля до десяти баллов по визуальной аналоговой шкале (ВАШ), показатели функции тазобедренного сустава по Оксфордской шкале тазобедренного сустава (Oxford Hip Score – OHS) [30]. При этом 0–19 баллов по OHS расценивались как тяжелое поражение, 20–29 баллов – средняя тяжесть поражения, 30–39 баллов – умеренная тяжесть, 40–49 баллов – удовлетворительная функция суставов. Кроме того, определяли потребность в приеме НПВП (в подавляющем большинстве коксибов) не более одного, двух и более трех раз в сутки, степень хромоты (стартовая, перемежающаяся, постоянная, требующая опоры).
Статистический анализ полученных данных проводился с использованием программы IBM SPSS Statistics 26.
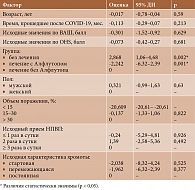
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро – Уилка. Они описывались с помощью средних арифметических значений (М), стандартных отклонений (SD) и границ 95%-ного доверительного интервала (95% ДИ) при нормальном распределении или медианы (Me), нижнего и верхнего квартилей (Q1–Q3) при ненормальном распределении. Категориальные показатели описывались с указанием абсолютных значений и процентов (абс., %). При нормальном распределении для сравнения значений двух несвязанных групп использовали t-критерий Стьюдента (при условии равенства дисперсий) или t-критерий Уэлча (при неравных дисперсиях). Равенство дисперсий проверялось с помощью теста Левена. При ненормальном распределении количественных данных для сравнения двух несвязанных групп применялся U-критерий Манна – Уитни, трех и более групп – критерий Краскела – Уоллиса. Апостериорные сравнения проводились с помощью критерия Данна с поправкой Холма. Сравнение процентных долей при анализе двухпольных таблиц сопряженности выполнялось с помощью χ2 Пирсона или точного критерия Фишера. Для многопольных таблиц использовали точный критерий Фишера. Оценка силы связи между признаками, согласно рекомендациям Rea & Parker, выполнялась с помощью V Крамера. Сравнение связанных выборок осуществлялось с помощью критерия Фридмана для количественных показателей и критерия Кохрена для номинальных показателей. Корреляционный анализ при ненормальном распределении проводился с применением коэффициента Спирмена (ρ). Для построения прогностической модели, позволяющей определить факторы, влияющие на прием НПВП на 21–28-е сутки наблюдения, использовалась порядковая логистическая регрессия. Сопоставление ожидаемых и наблюдаемых частот отдельных значений зависимой переменной осуществлялось с помощью критерия согласия Пирсона. Статистически значимая корреляционная связь между ожидаемыми и наблюдаемыми значениями устанавливалась с помощью метода ранговой корреляции Спирмена.
Различия признавались статистически значимыми при p < 0,05.
Результаты
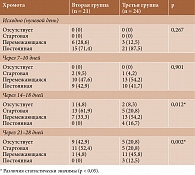
В первой группе исходные показатели болевого синдрома, оцениваемого по ВАШ, и тяжести поражения суставов, оцениваемой по OHS, статистически значимо отличались от показателей третьей группы, что во многом определило отказ пациентов первой группы от комплексной медикаментозной терапии (табл. 2). Во второй и третьей группах эти показатели не различались.
Исходные показатели объема поражения головки бедренной кости по данным МРТ в исследуемых группах не различались. Однако в первой группе зафиксированы более низкая потребность в НПВП и степень хромоты по сравнению со второй и третьей группами (p < 0,05) (табл. 3). К концу исследования в первой группе отсутствовали статистически значимые изменения значений по ВАШ (р = 0,837), OHS (р = 0,392), частоты приема НПВП и степени хромоты (p ≥ 0,05). Напротив, во второй группе отмечалось статистически значимое снижение значений по ВАШ (p < 0,001) и повышение значений по OHS (p < 0,001) уже на 14–18-е сутки от начала терапии. Положительная динамика была более значимой на 21–28-е сутки (табл. 4).
Изменение оцениваемых параметров в третьей группе было аналогичным таковому во второй группе (табл. 5). Однако у пациентов второй группы прирост значений по OHS к 21–28-м суткам терапии был на 30% больше по сравнению с больными третьей группы – от 29,0 (28,0–32,0) до 42,0 (40,0–44,0) и от 28,0 (28,0–30,0) до 38,0 (37,0–40,5) балла. При этом положительная динамика значений по ВАШ к 21–28-м суткам терапии во второй группе была в два раза более выраженной, чем в третьей группе, – от 5,0 (4,0–5,0) до 1,0 (1,0–3,0) и от 5,0 (5,0–5,0) до 3,0 (2,0–3,5) балла.
При попарном сравнении показателей групп установлено, что через 21–28 дней выраженность боли по ВАШ во второй и третьей группах была статистически значимо ниже, чем таковая в первой группе (p < 0,001 и р = 0,001 соответственно). Статистически значимых различий оцениваемого параметра между второй и третьей группами не отмечалось, однако имела место тенденция к более низким значениям у получавших Алфлутоп – 1,0 (1,0–3,0) против 3,0 (2,0–3,5) балла (р = 0,134).
Важно отметить, что у пациентов с изначальным объемом поражения головки бедренной кости более 30% на 21–28-е сутки лечения значения по ВАШ были достоверно ниже среди получавших комплексную терапию с Алфлутопом, чем таковую без Алфлутопа, – 1,0 (1,0–2,5) против 3,0 (2,0–3,0) балла (р = 0,02). В первой группе указанный параметр за период наблюдения не изменился (рис. 1).
К 21–28-м суткам наблюдения значения по OHS во второй группе были статистически значимо выше, чем в третьей и первой группах (p < 0,001 и р = 0,032 соответственно). В первой группе за весь период наблюдения динамики данного параметра не наблюдалось. При сравнительном анализе между группами в популяции с изначальным объемом поражения головки бедренной кости более 30% на 14–18-е и 21–28-е сутки наблюдения у получавших комплексное лечение с Алфлутопом значения по OHS были достоверно выше, чем у получавших комплексное лечение без Алфлутопа, – 34,64 ± 3,30 против 31,40 ± 2,32 балла (p = 0,018) и 40,91 ± 2,74 против 36,60 ± 2,32 балла (p = 0,001) соответственно. В первой группе на протяжении всего периода наблюдения положительная динамика отсутствовала (рис. 2).
На 14–18-е и 21–28-е сутки терапии у пациентов второй и третьей групп отмечалось достоверное снижение степени хромоты относительно исходных значений. У получавших Алфлутоп по сравнению с не получавшими данный препарат в составе комплексной терапии динамика рассматриваемого показателя оказалась более значимой (p = 0,012 и p = 0,002 соответственно) (табл. 6).
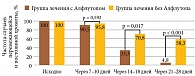
Через 14–18 дней частота случаев перемежающейся и постоянной хромоты у пациентов второй группы уменьшалась в 4,86 раза (95% ДИ 1,37–17,19), а через 21–28 дней – в 28 раз (95% ДИ 3,21–244,28) по сравнению с таковой у больных в третьей группе. Между сопоставляемыми признаками наблюдалась относительно сильная связь (V = 0,567) (рис. 3).
На 14–18-е сутки наблюдения во второй группе частота ежедневного приема НПВП уменьшилась в 7,5 раза (95% ДИ 2,0–28,16), а на 21–28-е сутки – в 28 раз (95% ДИ 3,21–244,28) по сравнению с третьей группой. Между сравниваемыми признаками отмечалась относительно сильная связь (V = 0,567) (рис. 4).
Полученные результаты были подтверждены методом порядковой логистической регрессии, с помощью которой была построена прогностическая модель, позволяющая определить факторы, влияющие на прием НПВП на 21–28-е сутки наблюдения (табл. 7).
Исходя из полученных результатов, уменьшение частоты приема НПВП ожидалось у получавших комплексное медикаментозное лечение с Алфлутопом. Значимость вклада отобранных факторных переменных в улучшение прогнозов, получаемых с помощью модели, соответствовала p < 0,001. При этом с помощью порядковой логистической регрессии было исключено влияние других анализируемых переменных (пол, возраст, сроки от COVID-19, исходные значения по ВАШ и OHS, объем поражения, режим приема НПВП и степень хромоты).
С помощью метода ранговой корреляции Спирмена между ожидаемыми и наблюдаемыми значениями режима приема НПВП была установлена статистически значимая корреляционная связь (ρ = 0,727; p < 0,001).
За период наблюдения ухудшения течения коморбидной патологии и развития нежелательных явлений у пациентов в изучаемых группах не обнаружено.
Заключение
В настоящее время не существует стандартизированного протокола лечения ранней стадии ОН, сформировавшегося после перенесенного COVID-19. Следовательно, накопление клинического опыта в условиях реальной клинической практики является чрезвычайно важным.
Результаты нашего исследования свидетельствуют об отсутствии статистически значимого изменения значений по ВАШ и OHS, частоты приема НПВП и степени хромоты у пациентов с низкой комплаентностью лечению, которые использовали только средства механической разгрузки сустава и НПВП. Улучшение указанных параметров отмечено у получавших комплексную медикаментозную терапию с включением НПВП, антирезорбтивных препаратов, препаратов кальция, витамина D, антикоагулянтов и аналогичное лечение с добавлением в/м введения препарата Алфлутоп. Однако последним начиная с 14–18-х суток наблюдения реже требовались НПВП. Кроме того, у них быстрее уменьшалась степень хромоты. К 21–28-м суткам терапии прирост значений по OHS у них оказался на 30% больше, чем у получавших аналогичное лечение, но без Алфлутопа. Важно отметить, что аналогичная динамика наблюдалась у пациентов с самой продвинутой стадией ОН – 30%-ным поражением головки бедренной кости.
Полагаем, что подобные результаты могут быть обусловлены плейотропными эффектами Алфлутопа. Противовоспалительное, анальгетическое и структурно-модифицирующее действие препарата реализуется через инициацию механизмов, участвующих в подавлении активности генов ИЛ-1β, ИЛ-6 и ИЛ-8, сосудисто-эндотелиального фактора роста, гиалуронидазы и снижении окислительного стресса, инициирующих ангиогенез и деструктивные процессы в костной ткани, стимулировании пролиферации хондроцитов, активации синтеза внеклеточного матрикса посредством модуляции трансформирующего фактора роста β. Эти свойства Алфлутопа позволяют напрямую воздействовать на патогенез ОН и препятствовать развитию его осложнений, в частности остеоартрита тазобедренного сустава.
Необходимо отметить, что требуются дальнейшие проспективные исследования по оценке динамики синовита и изменения структуры хряща по данным МРТ у пациентов с ОН на фоне комплексной терапии с Алфлутопом.
Преимуществом Алфлутопа также является возможность снижения сердечно-сосудистых рисков у коморбидных пациентов с ОН, что связано с уменьшением дозы НПВП. Известно, что при назначении НПВП создается дисбаланс синтеза про- и антитромбогенных факторов (тромбоксана и простациклина) за счет несбалансированной блокады циклооксигеназ 1 и 2, что может увеличить общий сосудистый риск и, следовательно, риск развития острых сердечно-сосудистых событий [31]. В нашей когорте, несмотря на молодой и средний возраст пациентов, у 65% имела место коморбидная патология, ассоциированная с высоким сердечно-сосудистым риском (артериальная гипертензия, ишемическая болезнь сердца, сахарный диабет, хроническая болезнь почек, ревматоидный артрит, подагра, хроническая обструктивная болезнь легких). Известно, что хондроитина сульфат, входящий в состав Алфлутопа, при длительном применении снижает риск развития сердечно-сосудистых событий и сердечно-сосудистой смерти независимо от наличия сердечно-сосудистых факторов риска [32]. Кроме того, Алфлутоп не влияет на показатели свертывающей системы крови у получающих антикоагулянтную терапию, что особенно важно для перенесших COVID-19 [33].
Полученные нами результаты являются объективной доказательной базой для практических выводов о симптоматическом и структурно-модифицирующем эффектах Алфлутопа при ОН головки бедренной кости, развившемся после COVID-19. Они подтверждают обоснованность его использования в ревматологической, травматологической и ортопедической практике для оптимизации комплексной медикаментозной терапии у таких пациентов.
V.I. Mazurov, Academician of the RASci., MD, PhD, Prof., I.B. Belyayeva, MD, PhD, Prof., A.A. Myasoyedov, PhD, D.A. Shimanski
North-Western State Medical University named after I.I. Mechnikov
National Medical Research Center of Traumatology and Orthopedics named after R.R. Vreden
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Irina B. Belyayeva, belib@mail.ru
The aim of the study – to evaluate the effect of Alflutop used in the complex drug therapy of comorbid patients with osteonecrosis (ON) of the femur developed after COVID-19 on the severity of pain syndrome, hip joint function, the degree of lameness and the need for nonsteroidal anti-inflammatory drugs (NSAIDs) in these patients.
Material and methods. The study included 67 patients with femoral head ON, developed after COVID-19, who applied to the clinic of the National Medical Research Center of Traumatology and Orthopedics named after R.R. Vreden. The diagnosis of osteonecrosis was established in accordance with the Association Research Circulation Osseous (ARCO) classification. Patients with stages 1–3 ON according to ARCO were selected. Patients also had comorbid pathology: 36 (53.7%) – hypertension, 16 (23.8%) – diabetes mellitus, 15 (22.4%) – rheumatoid arthritis, 10 (14.9%) – chronic kidney disease, 9 (13.4%) – chronic obstructive pulmonary disease, 8 (11.9%) – coronary heart disease, 7 (10.4%) – acute cerebrovascular accident, 5 (7.4%) – gout.
Depending on the treatment tactics, patients were divided into three groups: in the first group (n = 22), patients used only hip joint unloading with crutches and used NSAIDs to relieve pain. In the second group (n = 21), hip joint was discharged and complex drug therapy was carried out using NSAIDs, antiresorptive drugs, calcium preparations, vitamin D, anticoagulants, and additionally 2.0 ml Alflutop was administered every other day No. 10, in group three (n = 24), patients received a similar medication to group two therapy, however, Alflutop was not used.
The patients in the study groups were comparable in gender, age, stages of ОN, the extent of femoral head lesion and comorbid conditions.
Initially, after 7–10, 14–18 and 21–28 days, the parameters of the pain syndrome were evaluated according to a visual analog scale (VAS), indicators of hip joint function according to the Oxford Hip Score (OHS), the need for NSAIDs was determined, as well as the severity of lameness.
Statistical analysis was carried out using the IBM SPSS Statistics 26 program. The differences were recognized as statistically significant at p < 0.05.
Results. In the group with low compliance, there were no statistically significant changes in VAS, OHS, the frequency of NSAIDs intake and the degree of lameness by the end of the study relative to the baseline values. In the group of patients who underwent joint unloading and complex drug therapy with the inclusion in the treatment regimen of 2.0 ml of Alflutop every other day No. 10, starting from 14–18 days of follow-up, NSAIDs intake was required less often and lameness decreased faster, which increased the increase in the OHS by 30% by 21–28 days of therapy compared to with standard treatment.
During the observation period, there was no deterioration in the course of comorbid pathology and the development of adverse events in patients in the studied groups.
Conclusion. Alflutop has symptomatic and structure modifying effects in post COVID-19 femoral head ON, and it also reduces potential cardiovascular risks in comorbid patients by decreasing required number of NSAIDs. The obtained data substantiate its use in rheumatology, traumatology and orthopedic practice to optimize of complex drug therapy of patients with this pathology.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.