Редкие формы интерстициальных болезней легких. Клинический случай легочного гистиоцитоза Х
- Аннотация
- Статья
- Ссылки
- English
При ЛГКЛ поражение мелких бронхов и бронхиол служит важным звеном патологического процесса, поскольку их просвет обтурируют гистиоцитарные пролифераты, в результате чего возникает расширение мелких бронхов и формируются тонкостенные воздухосодержащие кисты. Предикторами неблагоприятного исхода при ЛГКЛ служат более выраженные кистозные изменения, более низкое соотношение объема форсированного выдоха за первую секунду и форсированной жизненной емкости легких, более высокое соотношение остаточного объема и общей емкости легких, более низкая диффузионная способность легких по монооксиду углерода и наличие легочной гипертензии. ЛГКЛ связан с развитием других новообразований, происходящих из лимфатической и гемопоэтической систем, в том числе хроническим миелогенным лейкозом. Это заболевание также служит предиктором развития рака легких.
При ЛГКЛ поражение мелких бронхов и бронхиол служит важным звеном патологического процесса, поскольку их просвет обтурируют гистиоцитарные пролифераты, в результате чего возникает расширение мелких бронхов и формируются тонкостенные воздухосодержащие кисты. Предикторами неблагоприятного исхода при ЛГКЛ служат более выраженные кистозные изменения, более низкое соотношение объема форсированного выдоха за первую секунду и форсированной жизненной емкости легких, более высокое соотношение остаточного объема и общей емкости легких, более низкая диффузионная способность легких по монооксиду углерода и наличие легочной гипертензии. ЛГКЛ связан с развитием других новообразований, происходящих из лимфатической и гемопоэтической систем, в том числе хроническим миелогенным лейкозом. Это заболевание также служит предиктором развития рака легких.
Введение
Гистиоцитоз клеток Лангерганса – редкое заболевание неизвестной этиологии, вызванное клональной пролиферацией клеток Лангерганса (КЛ), которые гено- и фенотипически изменены и могут поражать любой орган [1]. КЛ имеют миелоидное происхождение, более половины из них экспрессируют онкоген BRAF V600E [2, 3]. КЛ принимают форму узелковых поражений различного размера, инфильтрирующих и повреждающих структуру соседних тканей. Чаще поражаются кости, легкие, кожа и гипофиз, у детей – лимфопоэтические органы (лимфатические узлы, печень, селезенка, костный мозг), пищеварительная и центральная нервная системы.
Легочный гистиоцитоз клеток Лангерганса (ЛГКЛ) – редкое диффузное кистозное заболевание легких, характеризующееся развитием центрилобулярных поражений, состоящих из дендритных клеток CD1a+(DCs) и других воспалительных клеток, различной степени выраженности [4].
ЛГКЛ – обусловленная воздействием сигаретного дыма воспалительная миелоидная неоплазма, при которой дендритные клетки (ДК), несущие патогенные мутации MAPK (mitogen-activated protein kinase), вызывают прогрессирующую нодулоцистную деструкцию легких [3, 5].
Табакокурение приводит к накоплению КЛ в легких. Подобное явление наблюдается у пациентов с ЛГКЛ, а также у здоровых курильщиков, пациентов с хронической обструктивной болезнью легких, десквамативной интерстициальной пневмонией или респираторным бронхитом – интерстициальной болезнью легких [2, 6]. В состав табачного дыма входит множество компонентов, стимулирующих выработку цитокинов, необходимых для привлечения и активации КЛ. Наиболее важными среди цитокинов являются фактор некроза опухоли (ФНО), гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), трансформирующий фактор роста (ТФР) бета и хемокин дендритных клеток (CCL20) [1, 7, 8].
ФНО вырабатывается макрофагами и эпителиальными клетками бронхов. Он играет решающую роль в активизации и дифференцировке КЛ [6]. Под воздействием табачного дыма эпителиальные клетки бронхов и фибробласты выделяют ГМ-КСФ – сильный митогенный фактор для КЛ [2].
Поражение мелких бронхов и бронхиол служит важным звеном патологического процесса, поскольку гистиоцитарные пролифераты обтурируют их просвет, что приводит к вздутию мелких бронхов и формированию тонкостенных воздухосодержащих кист [7]. Диаметр и количество кист имеют прогностическое значение. Неблагоприятным течением отличаются процессы с множественными кистами, кистами больших размеров и увеличением кист в объеме при динамическом наблюдении. Конечной стадией патологического процесса считаются грубые фиброзные изменения с формированием иррегулярной эмфиземы, слиянием кист и их разрывом с развитием спонтанного пневмоторакса [9, 10].
Для ЛГКЛ характерно первоначальное поражение верхних отделов легких с последующим распространением патологического процесса от верхушек к основанию легких. По мере прогрессирования заболевания в легких наблюдаются изменения мозаичного характера: свежие очаги активной клеточной пролиферации соседствуют с участками фиброзных изменений или кистозной трансформации.
Поскольку ЛГКЛ – редкое заболевание, эпидемиологические данные ограниченны. ЛГКЛ может возникнуть в любом возрасте, тем не менее чаще диагностируется у пациентов в возрасте 20–40 лет [11]. О гендерной предрасположенности не сообщается. ЛГКЛ в равной степени поражает как мужчин, так и женщин.
По оценкам, ЛГКЛ у взрослых встречается в основном у активных курильщиков. Распространенность заболевания – 0,27 и 0,07 на 100 тыс. населения среди мужчин и женщин соответственно. На долю ЛГКЛ приходится около 5% интерстициальных заболеваний легких, наблюдаемых в специализированных центрах [12].
В Московской области за последние три года зарегистрировано только два случая ЛГКЛ (морфологически верифицированных) у мужчин в возрасте от 30 до 45 лет. Один из них рассмотрен ниже.
Клинический случай
Больной О., 43 года, профессия – водитель. С 1 февраля по 3 марта 2023 г. находился на обследовании и лечении в пульмонологическом отделении Национального медицинского исследовательского центра высоких медицинских технологий им. А.А. Вишневского. Жалобы при поступлении на периодический малопродуктивный приступообразный кашель, усиливающийся при умеренной физической нагрузке, одышку смешанного характера при умеренной физической нагрузке, общую слабость, повышенную утомляемость.
Из анамнеза: жалобы на периодическое ощущение покалывания и жжения в нижней части грудной клетки справа впервые появились в 2016 г. В мае 2017 г. при выполнении компьютерной томографии (КТ) органов грудной клетки в паренхиме обоих легких были выявлены множественные мелкоочаговые образования различной степени плотности, большинство с нечеткими контурами. В верхних долях обоих легких визуализировались множественные полостные образования диаметром до 7 мм. Обследовался в онкологическом стационаре (Московская городская онкологическая больница № 62). 15 июня 2017 г. выполнена торакоскопическая резекция верхней доли правого легкого.
Гистологическое заключение от 13 июля 2017 г. (Научно-исследовательский институт пульмонологии): в ткани легкого неправильной формы гранулема, состоящая из гистиоцитов (положительная экспрессия CD1а и лангерина при иммуногистохимической реакции), эозинофилов, пигментированных «бурых» макрофагов. В окружающей ткани в просветах альвеол скопление макрофагов и пигментированных макрофагов с примесью эритроцитов. В просветах двух артериол обтурирующие фиброзные тромбы. Диагностирован лангерганс-клеточный гистиоцитоз. В дальнейшем у пульмонолога не наблюдался.
Ухудшение отметил около месяца назад: при привычной физической нагрузке появились периодический приступообразный малопродуктивный кашель с легко отделяемой мокротой слизистого характера, выраженная одышка, повышенная утомляемость, в связи с чем пациент не мог выполнять профессиональные обязанности (кашель с одышкой не позволял подняться в кабину грузовика). При поступлении в стационар медицинских документов представлено не было.
Стаж курения – 20 лет (одна пачка сигарет в день).
Данные объективного обследования: общее состояние удовлетворительное. Сознание ясное. Положение активное. Телосложение гиперстеническое. Питание повышенное (индекс массы тела – 26,5 кг/м2). Кожа физиологичной окраски и влажности, тургор сохранен. Видимые слизистые обычной окраски. Отеков нет. Периферические лимфоузлы не пальпируются. Крупные суставы внешне не изменены, активные и пассивные движения в суставах и позвоночнике в полном объеме.
Органы дыхания: грудная клетка конической формы, симметрично участвует в акте дыхания. Границы легких в пределах возрастной нормы. Перкуторный звук над легкими ясный, легочный. В легких дыхание жесткое, проводится во все отделы, хрипов нет. Частота дыхательных движений – 18 в минуту. SpO2 – 99%.
Сердечно-сосудистая система: область сердца не изменена. Границы относительной тупости сердца: верхняя – третье межреберье, левая на 1,5 см кнутри от левой срединно-ключичной линии, правая – по правому краю грудины. Сердечные тоны ясные, аускультативно ритм правильный, шумов нет. Пульс ритмичный, удовлетворительного наполнения и напряжения. Частота сердечных сокращений (ЧСС) – 90 в минуту, артериальное давление – 130/90 мм рт. ст.
Органы пищеварения, мочевыделения, эндокринная система: язык чистый, влажный, обложен у корня белым налетом. Живот правильной формы, равномерно участвует в дыхании, при пальпации мягкий безболезненный во всех отделах, симптомов раздражения брюшины нет. Печень по краю правой реберной дуги. Размеры печени по Курлову 11 – 9 – 8 см. Пузырные симптомы отрицательные. Селезенка не пальпируется. Область почек не изменена. Поколачивание по поясничной области безболезненное с обеих сторон. Почки не пальпируются. Щитовидная железа не увеличена.
Нервная система: в сознании, ориентирован в пространстве и времени. Очаговой неврологической симптоматики нет. В позе Ромберга устойчив. Пальценосовые пробы выполняет правильно. Зрение и слух не снижены. Восприятие шепотной речи – с 6 метров.
Результаты лабораторных исследований:
- общий анализ крови: эритроциты – 4,84 × 1012/л, гемоглобин – 163 г/л, лейкоциты – 9,64 × 109/л, палочкоядерные нейтрофилы – 4%, сегментоядерные нейтрофилы – 56%, лимфоциты – 34%, моноциты – 6%, скорость оседания эритроцитов – 12 мм/ч;
- иммунологический анализ крови: иммуноглобулин (Ig) А – 1,03 мг/мл, IgМ – 0,97 мг/мл, IgG – 10,77 мг/мл, IgЕ – 97,9 Ед/мл, С-реактивный белок – 6 мг/л, раково-эмбриональный антиген – 2,9 нг/мл, альфа-фетопротеин – 2 Ед/мл, простатический специфический антиген общий – 0,41 нг/мл, СА-19-9 – 3,8 Ед/мл;
- биохимический анализ крови: глюкоза – 5,58 ммоль/л, общий белок – 76 г/л, холестерин общий – 5,77 ммоль/л, билирубин общий – 8,4 ммоль/л, аланинаминотрансфераза – 6 Ед/л, аспартатаминотрансфераза – 24 Ед/л, Т3 свободный – 3,78 пг/мл, Т4 свободный – 1,34 пг/мл, тиреотропный гормон – 0,78 мкМЕ/мл, антитела к тиреоидной пероксидазе < 37,0 Ед/мл;
- коагулограмма: протромбиновый индекс – 95,2%, международное нормализованное отношение – 1,05, протромбиновое время – 11,5 с, фибриноген по Клауссу – 4,25 г/л, активированное частичное тромбопластиновое время – 39,5 с.
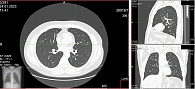
КТ органов грудной клетки: форма грудной клетки обычная. Внутренние контуры грудной стенки ровные и четкие во всех отделах. Легкие расправлены, без инфильтративных изменений. В обоих легких мелкие перилимфатические узелки вдоль междольковых перегородок, в субплевральных отделах. Бронхиальное дерево проходимо. Просвет трахеи и главных бронхов не изменен. Сердце обычно расположено и имеет правильную конфигурацию. Камеры сердца не увеличены. Внутригрудные лимфатические узлы не увеличены – до 8 мм по короткой оси. Средостение обычно расположено, не расширено. Новообразований в переднем и заднем средостении не определяется. Крупные сосуды исследуемой области без особенностей. Расположение диафрагмы обычное, ее контуры ровные, четкие. Костные структуры исследуемого уровня, без признаков очаговой патологии. Плевральные полости свободны.
Заключение: КТ-картина может соответствовать саркоидозу легких. Аденопатии внутригрудных лимфатических узлов не выявлено (рис. 1).
Сцинтиграфия легких: признаки очаговых перфузионных изменений S6-сегмента левого легкого (вероятность тромбоэмболии легочной артерии низкая).
Спирография: жизненная емкость легких (ЖЕЛ) снижена (53,0). Маневр форсированная ЖЕЛ не выполняет (кашель во время форсированного дыхания). Умеренное нарушение вентиляционной функции легких: снижение скорости выдоха в средне-дистальном отделе кривой «поток – объем форсированного выдоха (ОФВ)».
После пробы: ЖЕЛ 92; ОФВ 177; ОФВ за первую секунду/ЖЕЛ 84.
Бодиплетизмография: изменения общей емкости легких не выявлено. ЖЕЛ в норме. Бронхиальное сопротивление не увеличено. Увеличение остаточного объема легких легкой степени. Скоростные показатели в средне-дистальном отделе кривой «поток – ОФВ» снижены.
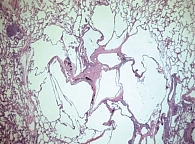
Ключевым методом для постановки диагноза является биопсия легкого с дальнейшим морфологическим исследованием [13]. При микроскопическом исследовании ранние очаги поражения сосредоточены на терминальных и респираторных бронхиолах. На самой ранней стадии можно увидеть КЛ, которые окрашиваются на CD1a и S100 (хотя последний является неспецифическим признаком), инфильтрируя бронхиолярные стенки и эпителий. Позже КЛ окружены различным количеством лимфоцитов, эозинофилов, фибробластов и плазматических клеток, которые прогрессируют до характерных звездчатых фиброзных рубцов, окруженных кистозными областями (рис. 2).
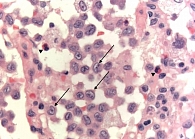
Ключевая морфологическая особенность КЛ, которая помогает отличить их от других клеток, – сильно извитая ядерная мембрана (рис. 3). У КЛ также отсутствуют заметные ядрышки и обильная цитоплазма с плохо очерченными границами. Пигментные макрофаги, которые связаны с воздействием сигаретного дыма, наблюдаются часто и в ряде ситуаций могут быть настолько обширными, что приводят к поражениям, напоминающим десквамативную интерстициальную пневмонию (как в данном клиническом случае). Легочная паренхима между поражениями КЛ может быть нормальной или иметь другие аномалии, связанные с курением.
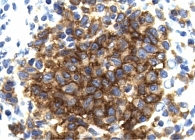
Нарастающая обструкция мелких дыхательных путей является причиной расширения воздушного пространства вокруг очага поражения, которое в конечном итоге приводит к образованию кисты, инвазии тяжей клеток в окружающую паренхиму и, как следствие, звездчатому виду поражения. Со временем поражения становятся бесклеточными, оставляя после себя фиброзный рубец, часто такой же звездчатой формы, как и первоначальное поражение. Изменения в легких при PLCH характерны, но в случаях, когда имеются сомнения в постановке диагноза, достаточно выполнить иммуногистохимическое окрашивание на CD1а (рис. 4).
Ультразвуковое исследование органов брюшной полости: эхографические признаки диффузных изменений паренхимы печени. Эхографические признаки доброкачественной гиперплазии простаты.
Электрокардиограмма (ЭКГ): ритм синусовый, правильный. Вертикальное положение электрической оси сердца, ЧСС – 70 в минуту.
Холтеровское мониторирование ЭКГ: ритм синусовый. Нарушение внутрижелудочковой проводимости. Среднесуточная ЧСС – 78 в минуту, средняя ЧСС за активный период – 84 в минуту с максимальной ЧСС 121 в минуту, средняя ЧСС за период сна – 70 в минуту с минимальной ЧСС 54 в минуту. Зарегистрированы две изолированные политопные наджелудочковые (предсердные) экстрасистолы. Желудочковая эктопическая активность не зафиксирована. Диагностически значимого смещения (1 мм и более) сегмента ST нет. Значимых пауз (2 с и более) нет.
Бронхоскопия: эндоскопическая картина варианта возрастной нормы.
ЭхоКГ: размеры полостей сердца в пределах нормы. Уплотнение створок аортального клапана. Уплотнение створок и хорд митрального клапана, пролапс его передней створки 6 мм. Митральная регургитация 1-й степени. Трикуспидальная регургитация 1-й степени. Регургитация на клапане легочной артерии 1-й степени. Среднее значение артериального давления в легочной артерии – 30 мм рт. ст. Признаков нарушения локальной и глобальной сократительной функции миокарда левого желудочка не выявлено. Фракция выброса левого желудочка – 62%. TAPSE – 18 мм.
Окончательный диагноз: гистиоцитоз легких клеток Лангерганса, морфологически верифицированный, дыхательная недостаточность – 0 степень.
Пациенту назначили глюкокортикостероид (ГКС) преднизолон 0,5 мг/кг (40 мг) с постепенным снижением дозы на 5 мг один раз в 14 дней до дозы 10 мг на один месяц. Если состояние не ухудшается, снижение на 5 мг в неделю до полной отмены. Настоятельно рекомендован отказ от курения.
В результате проведенного лечения состояние и самочувствие пациента значительно улучшились. Выписан в удовлетворительном состоянии. Рекомендовано динамическое наблюдение терапевта и пульмонолога поликлиники по месту жительства.
Обсуждение
Некоторые авторы указывают на необходимость системной ГКС-терапии в случае интенсивных симптомов со стороны дыхательной системы, в частности при наличии узелковых поражений легких: преднизолон 1 мг/кг в течение шести месяцев с постепенным снижением дозы. Такая терапия не подтверждена клиническими испытаниями, а в последнее время подчеркивается ее вредный эффект.
На основании данных, полученных в ходе рандомизированных исследований с участием детей, взрослым пациентам с ЛГКЛ назначали различные виды циторедуктивной терапии (метотрексат, винбластин, меркаптопурин, этопозид). Однако у взрослых заболевание протекает по-разному, переносимость препаратов различна.
В ретроспективном исследовании A. Tazi и соавт. оценивали терапию винбластином и ГКС у 35 взрослых больных ЛГКЛ, включая 17 пациентов с легочным поражением [14]. 70% пациентов ответили на лечение, но более чем у 40% пациентов рецидив заболевания произошел в течение пяти лет наблюдения. Ни в одном случае не зафиксировано улучшения параметров вентиляции на фоне лечения.
В группе из 58 взрослых пациентов с гистиоцитозом с множественным поражением костей, включая 28% пациентов с легочным поражением, M.A. Cantu и соавт. наблюдали высокую эффективность лечения кладрибином и цитарабином по сравнению с группой винбластина [15]. При агрессивном течении ЛГКЛ рекомендуется шесть циклов кладрибина в виде внутривенных инфузий в дозе 6 мг/м2 в течение пяти дней каждые четыре недели. Эффективность терапии оценивается более чем в 75%. Спасительной терапией считается введение цитарабина в дозе 100 мг/м2 в течение пяти последовательных дней каждые четыре недели. Если лечение эффективно, назначаются следующие шесть циклов. У пациентов с поражением легких цитарабин или кладрибин более эффективен по сравнению с другими препаратами (винбластин и преднизолон).
У пациентов со значительным нарушением вентилирующей функции легких, признаками дыхательной недостаточности и легочной гипертензией трансплантация легких является окончательным терапевтическим вариантом. Легочная гипертензия отмечается у 80–90% пациентов, подходящих для трансплантации, и представляет собой важный фактор риска процедуры. Прогноз пациентов, перенесших трансплантацию, существенно не отличается от прогноза тех, кто подвергся этой процедуре из-за лимфангиолейомиоматоза или эмфиземы. Около 75% пациентов выживают в течение года, а более 50% – пяти лет. Более плохой прогноз после трансплантации у лиц с мультисистемным ЛГКЛ. Примерно в 1/5 случаев обнаруживается рецидив ЛГКЛ в пересаженном органе [2, 8, 16].
Течение ЛГКЛ часто трудно предсказать. В одних случаях болезненный процесс купируется спонтанно или на фоне терапии ГКС, в других – прогрессирует, несмотря на отказ от курения и иммунодепрессивную/цитотоксическую медикаментозную терапию.
Течение заболевания при ЛГКЛ весьма вариабельно и непредсказуемо. Медиана выживаемости составляет 12–13 лет [4, 8, 13].
Предикторами неблагоприятного исхода при ЛГКЛ являются более выраженные кистозные изменения (на КТ), пожилой возраст, более низкое отношение объема форсированного выдоха за первую секунду к форсированной ЖЕЛ, более высокое отношение остаточного объема к общей емкости легких, более низкая диффузионная способность легких по монооксиду углерода и наличие легочной гипертензии.
ЛГКЛ связан с развитием других новообразований, происходящих из лимфатической и гемопоэтической систем, в том числе хроническим миелогенным лейкозом. Это заболевание также предрасполагает к развитию рака легких. При этом продолжение курения – основной фактор риска.
Основной причиной смерти при ЛГКЛ является дыхательная недостаточность из-за прогрессирующего заболевания и злокачественных новообразований. Кроме того, у пациентов с ЛГКЛ более низкое качество жизни, более низкая средняя выживаемость по сравнению с представителями общей популяции того же пола и возраста. К негативным прогностическим факторам относятся возраст, курение табака, тяжелая обструкция, пониженное PaO2, более высокий балл по шкале SGRQ, легочная гипертензия и полиорганное поражение. Отметим, что пациенты с более легким или разрешающимся ЛГКЛ не находятся под последующим наблюдением специалиста. Это отражается на статистической оценке их выживаемости.
Заключение
По данным отечественной и зарубежной литературы, табачный дым является основным фактором, вызывающим ЛГКЛ. Отказ от курения – первостепенная рекомендация для пациентов с ЛГКЛ.
A.A. Shumilin, A.I. Pavlov, A.A. Prokhorchik, A.G. Karakozov, A.I. Molodova, I.V. Telyatnikov
A.A. Vishnevsky National Medical Research Center for High Medical Technologies
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Aram G. Karakozov, aram_k@mail.ru
Pulmonary Langerhans cell histiocytosis (PLCH) is a rare diffuse cystic lung disease caused by cigarette smoke and carrying pathogenic MAPK (mitogen-activated protein kinase) mutations, which cause progressive nodulocystic lung destruction. This paper presents a clinical case of a 43-year-old man with a characteristic computed tomographic picture corresponding to sarcoidosis of the lungs with cysts and nodules predominantly located in the upper and middle lung fields.
In PLCH, involvement of the small bronchi and bronchioles is an important link in the pathological process, as histiocytic proliferates obstruct the lumen, resulting in the ballooning of small bronchi and formation of thin-walled air-containing cysts. Predictors of poor outcome in PLCH include more severe cystic changes, lower ratio of forced expiratory volume in 1s to forced vital capacity, higher ratio of residual volume to total lung capacity, lower DL (CO), and the presence of pulmonary hypertension. PLCH is associated with the development of other neoplasms originating from the lymphatic and haematopoietic systems, including LCH overlapping with chronic myelogenous leukaemia. This disease also predisposes to the development of lung cancer.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.