Резолюция Экспертного совета «Необследованная диспепсия: краткосрочная и долгосрочная стратегии ведения пациента»
- Аннотация
- Статья
- Ссылки
- English
Основные положения резолюции. Первичный пациент с недавно возникшими симптомами диспепсии, не принимавший лекарственные препараты, способные вызывать поражения желудка, должен быть рассмотрен как пациент с необследованной диспепсией. Первым диагнозом, требующим исключения у пациента с необследованной диспепсией, является хронический гастрит, ассоциированный с H. pylori. С учетом доказанной эффективности и высокого профиля безопасности, что продемонстрировано в исследованиях на оригинальном препарате, для облегчения или устранения симптомов диспепсии в период до проведения тестирования на H. pylori рекомендовано назначение прокинетика итоприда гидрохлорида. Наличие у пациента таких объективных признаков, как желудочно-кишечное кровотечение, немотивированная потеря веса, отягощенный семейный анамнез по раку желудка, возраст старше 50 лет, является показанием к проведению эзофагогастродуоденоскопии с биопсией. Первичный положительный тест на H. pylori является показанием для проведения эрадикационной терапии, поскольку инфекция является основным этиологическим фактором аденокарциномы желудка, включая проксимальный рак желудка и рак желудочно-пищеводного соединения. Четырехкомпонентная терапия с кларитромицином (амоксициллин + кларитромицин + ингибитор протонной помпы + висмута трикалия дицитрат) в течение 14 дней может быть определена как терапия первой линии на территории Российской Федерации. С целью повышения эффективности эрадикации рекомендовано использование оригинальных препаратов.
Основные положения резолюции. Первичный пациент с недавно возникшими симптомами диспепсии, не принимавший лекарственные препараты, способные вызывать поражения желудка, должен быть рассмотрен как пациент с необследованной диспепсией. Первым диагнозом, требующим исключения у пациента с необследованной диспепсией, является хронический гастрит, ассоциированный с H. pylori. С учетом доказанной эффективности и высокого профиля безопасности, что продемонстрировано в исследованиях на оригинальном препарате, для облегчения или устранения симптомов диспепсии в период до проведения тестирования на H. pylori рекомендовано назначение прокинетика итоприда гидрохлорида. Наличие у пациента таких объективных признаков, как желудочно-кишечное кровотечение, немотивированная потеря веса, отягощенный семейный анамнез по раку желудка, возраст старше 50 лет, является показанием к проведению эзофагогастродуоденоскопии с биопсией. Первичный положительный тест на H. pylori является показанием для проведения эрадикационной терапии, поскольку инфекция является основным этиологическим фактором аденокарциномы желудка, включая проксимальный рак желудка и рак желудочно-пищеводного соединения. Четырехкомпонентная терапия с кларитромицином (амоксициллин + кларитромицин + ингибитор протонной помпы + висмута трикалия дицитрат) в течение 14 дней может быть определена как терапия первой линии на территории Российской Федерации. С целью повышения эффективности эрадикации рекомендовано использование оригинальных препаратов.
В Москве 22 апреля 2023 г. под председательством академика РАН, профессора И.В. Маева и д.м.н., профессора Л.Б. Лазебника состоялось заседание Экспертного совета, посвященное оптимизации подходов к ведению пациентов с необследованной диспепсией (МКБ-10: К30, МКБ-11: MD92). В работе Экспертного совета приняли участие ведущие специалисты в области гастроэнтерологии и онкологии.
В своем вступительном слове академик РАН И.В. Маев обозначил актуальность и значимость заявленной проблемы, поставленной перед членами Экспертного совета, ввиду широкой распространенности синдрома диспепсии среди населения, а также необходимость оптимизации тактики ведения первичного пациента с необследованной диспепсией как с целью повышения эффективности проведения последующей терапии, так и с целью канцеропревенции, в том числе с учетом появившихся новых данных по диагностике и лечению инфекции Helicobacter pylori.
Профессор Л.Б. Лазебник подчеркнул высокий уровень авторитета членов Экспертного совета и отметил целесообразность пересмотра и актуализации рекомендованного ранее алгоритма действий врача при необследованной диспепсии (МКБ-10: К30, МКБ-11: MD92). Данный алгоритм предлагается как развитие утвержденного приказом Министерства здравоохранения РФ № 248 алгоритма по диагнозу «диспепсия неуточненная», что обусловлено не только прошедшим временем, но также проведением большого числа исследований по данной проблеме и выходом в свет целого ряда обновленных международных согласительных документов.
В рамках Экспертного совета, в соответствии с повесткой заседания, были представлены доклады по основным вопросам, касающимся выбора диагностической стратегии и рациональной эмпирической терапии у пациента с необследованной диспепсией (МКБ-10: К30, МКБ-11: MD92), а также выбора наиболее приоритетной схемы эрадикационной терапии на территории Российской Федерации.
Доклад к.м.н. Ю.А. Кучерявого был посвящен общим представлениям о синдроме диспепсии, современным подходам к диагностике и возможностям эмпирической терапии при ведении пациента с необследованной диспепсией (МКБ-10: К30, МКБ-11: MD92).
Симптомы диспепсии часто встречаются в популяции, на их долю приходится до 40% от числа всех обращений за медицинской помощью к врачам первичного звена [1, 2].
Диспепсия представляет собой комплекс симптомов со стороны верхних отделов пищеварительного тракта, которые могут встречаться у пациента в различных сочетаниях: боль и чувство жжения в эпигастральной области вне зависимости от приема пищи (МКБ11: MD81.10); чувство раннего насыщения или переполнения в эпигастральной области после приема пищи. Возможно наличие и таких дополнительных симптомов, как тошнота (МКБ11: MD90) и отрыжка воздухом (МКБ11: MD91) [3]. По данным опроса 205 врачей-терапевтов из 33 городов России, осуществляющих амбулаторную практику, каждый второй пациент с жалобами на гастроэнтерологические симптомы испытывает проявления замедленной моторики желудка (тяжесть в эпигастральной области, боль в эпигастрии, тошноту, раннее насыщение), причем врачи в большинстве случаев склонны ставить такому пациенту первичный диагноз «гастрит» (МКБ-10: К29, МКБ-11: MD92) [45]. Хронический гастрит – группа хронических заболеваний, которые морфологически характеризуются персистирующим воспалительным инфильтратом и нарушением клеточного обновления с развитием кишечной метаплазии, атрофии и эпителиальной дисплазии в слизистой оболочке желудка [12]. Как следует из дефиниции, хронический гастрит создает условия для прогрессирования изменений слизистой оболочки желудка от воспаления к эпителиальной дисплазии и раку. В настоящее время диагностическая стратегия нацелена не просто на фиксацию наличия воспаления слизистой оболочки желудка, но и на стратификацию риска развития рака желудка у конкретного пациента. Именно стадия гастрита по системе OLGA/OLGIM определяет необходимость, объем и кратность динамического наблюдения больного. Таким образом, возникновение синдрома диспепсии свидетельствует о нарушении функции, а верификация гастрита – о структурных изменениях слизистой оболочки желудка. Среди наиболее распространенных причин гастрита можно выделить инфекцию H. pylori, аутоиммунный процесс, дуоденогастральный рефлюкс, гастропатию, вызванную химическими веществами, в первую очередь лекарственными препаратами (нестероидные противовоспалительные средства (НПВС), гормональные препараты, цитостатики и др.). На сегодняшний день ведущей причиной хронического гастрита является инфекция H. pylori.
Широкий спектр заболеваний, которые могут проявляться синдромом диспепсии, затрудняет проведение дифференциально-диагностического поиска, увеличивает время постановки диагноза и препятствует своевременному началу терапии. В связи с этим разработка алгоритма действий врача, который позволит в короткий срок поставить верный диагноз и выбрать тактику ведения пациента с необследованной диспепсией, представляется крайне актуальной задачей.
По происхождению диспепсия подразделяется на функциональную (первичную) и органическую (вторичную) у пациентов с органическими, системными или метаболическими заболеваниями.
Диагноз «диспепсия неуточненная» правомочен у не обследованных ранее пациентов при первичном обращении. На первом этапе диагностики пациента с необследованной диспепсией необходимо исключение причин вторичной диспепсии, прежде всего лекарственной гастропатии, а также диспепсии, связанной с инфекцией H. pylori. При купировании симптомов диспепсии после успешной эрадикации речь идет о диспепсии, ассоциированной с H. pylori [4]. Предпринятые рядом авторов попытки выявить специфический симптом диспепсии, который мог бы сигнализировать врачу о наличии инфекции H. pylori, не увенчались успехом [6–8]. При этом важно помнить, что у большей части H. pylori-позитивных пациентов жалобы и вовсе отсутствуют, а у H. рylori-позитивных пациентов с симптомами диспепсии разрешение клинической симптоматики после эрадикации может быть отсрочено до 12 месяцев [4, 8]. Таким образом, при отсутствии органических заболеваний у пациентов, не инфицированных H. pylori, или при сохранении симптомов через 6–12 месяцев после успешной эрадикации у ранее инфицированных H. pylori устанавливается диагноз функциональной диспепсии (МКБ-10: К30, МКБ-11: DD90.3) [4, 5].
Симптомокомплекс, развивающийся у пациента с функциональной диспепсией, может быть обусловлен целым рядом патогенетических механизмов, включая воспаление слизистой оболочки низкой степени активности и повышение ее проницаемости, иммунные реакции в ответ на персистенцию бактерии H. pylori, раздражающее действие химических агентов, нарушение секреции соляной кислоты, расстройство моторики и изменение висцеральной чувствительности, а также повышение количества эозинофилов и тучных клеток в биоптатах слизистой оболочки желудка и двенадцатиперстной кишки. В работах последних лет накапливаются данные о роли микробиоты желудка и двенадцатиперстной кишки в патогенезе функциональной диспепсии, являясь еще одним перспективным направлением для поиска новых терапевтических мишеней [9].
Стойкие клинические проявления диспепсии со слабым ответом на стандартную терапию укладываются в понятие «рефрактерная диспепсия» и представляют собой сложную задачу для клинициста. Возможно, за диагнозом рефрактерной диспепсии скрываются случаи коморбидного течения функциональной диспепсии с другими функциональными расстройствами пищеварительного тракта, например функциональным расстройством желчного пузыря или сфинктера Одди, а также случаи идиопатического гастропареза, диагностические критерии которого в настоящий момент не разработаны [10].
Касаясь вопроса алгоритма обследования пациента с впервые возникшими симптомами диспепсии (МКБ-10: К30, МКБ-11: MD92), Ю.А. Кучерявый отметил, что в большинстве международных консенсусов решение о необходимости первоочередного выполнения эзофагогастродуоденоскопии (ЭГДС) принимается при наличии у пациента симптомов тревоги, или так называемых красных флагов (объективные признаки желудочно-кишечного кровотечения, немотивированная потеря веса, возраст старше 50 лет, отягощенный семейный анамнез по раку желудка) [11]. Пациентам без симптомов тревоги проводится тестирование на наличие инфекции H. pylori, при этом предпочтение отдается неинвазивным методам диагностики (13С-уреазный дыхательный тест (УДТ), определение антигена H. pylori в кале с моноклональными антителами) [50], и в случае положительного результата тестирования рекомендовано проведение эрадикационной терапии. Ограничение широкого применения ЭГДС объясняется потребностью рационального применения инвазивного исследования с высокой стоимостью и попыткой снизить экономическую нагрузку на систему здравоохранения.
В этом отношении Российская гастроэнтерологическая ассоциация стоит на принципиально иных позициях, предлагая единую стратегию для всех пациентов с симптомами диспепсии. Проведение ЭГДС показано всем пациентам с необследованной диспепсией, в том числе лицам молодого возраста без симптомов тревоги, что, по мнению экспертов, позволяет минимизировать частоту упущенной терапевтической выгоды с помощью своевременного выявления и лечения органической патологии [5, 12].
Вместе с тем важно подчеркнуть, что качество проведения эндоскопической диагностики в России нередко не удовлетворяет соответствующим стандартам (выполнение забора биопсийного материала с последующим гистологическим исследованием по системе OLGA/OLGIM), что снижает диагностическую ценность метода в целом, в том числе в отношении выявления предраковых изменений слизистой оболочки желудка и раннего рака.
Во второй части своего доклада Ю.А. Кучерявый остановился на вопросе эмпирической терапии пациента с необследованной диспепсией на этапе уточнения диагноза, указав на то, что отечественные и зарубежные эксперты схожи во мнении, что итоприда гидрохлорид является препаратом выбора для контроля симптомов у пациента с неуточненной диспепсией (МКБ-10: К30, МКБ-11: MD92), так как его эффективность доказана не только в отношении купирования симптомов постпрандиального дистресс-синдрома [13], но и в лечении эпигастральной боли и смешанного варианта диспепсии. Исходя из этого, можно сделать вывод о том, что Ганатон (итоприда гидрохлорид) будет эффективен для лечения диспепсии вне зависимости от механизма ее возникновения. Положительное влияние препарата на симптомы различных клинических вариантов диспепсии подтверждено в ряде метаанализов и систематических обзоров [14, 15]. Так, по данным двух крупных метаанализов [13, 15], терапия препаратом итоприда гидрохлорид сопровождалась более выраженным купированием симптомов диспепсии по сравнению с другими прокинетиками, при этом частота нежелательных явлений при приеме итоприда гидрохлорида сопоставима с таковой в группе плацебо [16–18]. Многоцентровое рандомизированное плацебо-контролируемое исследование G. Holtmann и соавт. с включением 523 пациентов с функциональной диспепсией продемонстрировало, что прием итоприда гидрохлорида не был сопряжен с длительностью интервала QT, даже с увеличением дозировок в три раза при приеме в течение восьми недель [17]. Вместе с тем необходимо отметить, что все упомянутые исследования проведены с применением оригинального препарата итоприда гидрохлорид и экстраполировать их результаты на генерические препараты итоприда гидрохлорида не представляется возможным. При назначении воспроизведенных препаратов и отсутствии надлежавшего клинического эффекта недостаточная эффективность может быть обусловлена не только некорректной тактикой терапии, но и, вероятно, низким качеством воспроизведенного препарата, что может помешать объективной оценке врачом корректности своих назначений. При назначении оригинального препарата терапевтический потенциал реализуется в той степени, в которой это было продемонстрировано в клинических исследованиях, таким образом, оценка клинического результата может быть более точной. В сравнительном исследовании растворения препаратов итоприда гидрохлорида разного производства было установлено, что частицы, образующиеся при растворении воспроизведенных препаратов, склонны к слипанию и агрегации. Изменение оригинальной технологии производства приводит к значительным изменениям в характере растворимости таблеток дженериков, существенно влияя на этап высвобождения действующего компонента. В дальнейшем это может влиять и на распределение действующего вещества в организме, то есть на связанные с ним диффузионные процессы, что может, в свою очередь, отразиться на клиническом эффекте лекарственных средств [46].
Важно, что итоприда гидрохлорид может применяться на этапе диагностического поиска, в то время как от назначения ингибиторов протонной помпы (ИПП) и/или Н2-гистаминоблокаторов перед проведением диагностического тестирования на наличие инфекции H. pylori рекомендовано воздержаться как минимум в течение 14 дней, от препаратов висмута и антибактериальных средств – в течение четырех недель. При сохранении симптома изжоги ее можно купировать препаратами из группы антацидов или альгинатов.
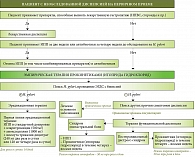
После доклада Ю.А. Кучерявого в ходе дискуссии членами Экспертного совета был принят алгоритм ведения пациентов с необследованной диспепсией (МКБ-10: К30, МКБ-11: MD92) (рисунок).
Д.м.н. А.А. Трякин в своем докладе поднял крайне важные вопросы относительно онкологических рисков, ассоциированных с инфекцией H. pylori, и необходимости широкого внедрения в клиническую практику эффективных мер профилактики рака желудка с учетом высоких показателей заболеваемости и смертности для рака данной локализации в Российской Федерации.
H. pylori вызывает развитие хронического активного гастрита, способного прогрессировать от поверхностного до атрофического с формированием кишечной метаплазии и рака желудка [19, 20]. Исследования типа «случай – контроль» подтвердили, что у лиц, инфицированных H. pylori, риск развития рака желудка был в 3–6 раз выше, чем у неинфицированных лиц из контрольной группы [21–23]. Это побудило Всемирную организацию здравоохранения и Международное агентство по исследованию рака (IARC) отнести H. pylori к канцерогенам I класса [24].
В соответствии с положениями Маастрихт VI с максимальным уровнем согласия между экспертами (100%) и максимальным уровнем доказанности данных, H. pylori является основным этиологическим фактором аденокарциномы желудка, включая проксимальный рак желудка. Относительно новые данные демонстрируют, что H. pylori ассоциирован с раком желудочно-пищеводного перехода, который квалифицирован как отдельная единица в классификации IARC [25], и это положение также нашло свое отражение в согласительном документе Маастрихт VI. Эксперты подчеркивают, что воздействие факторов внешней среды менее значимо по отношению к воздействию инфекции H. pylori.
По мере увеличения числа рандомизированных контролируемых исследований (РКИ) с длительным периодом наблюдения появились убедительные доказательства того, что эрадикация H. pylori способствует снижению риска развития рака желудка [26–28]. В метаанализе 10 РКИ (8323 участника) эрадикация H. pylori привела к снижению заболеваемости раком желудка на 46% и смертности от рака желудка на 39% [28]. В предотвращении развития последующего рака желудка эрадикационная терапия H. pylori превосходила плацебо или отсутствие лечения: по данным шести исследований (6497 участников), среднее отношение риска развития последующего рака желудка составило 0,66 (95%-ный доверительный интервал 0,46–0,95, доказательства среднего качества) [29].
В работе Y.S. Jung и соавт. с включением около 2 млн участников у пациентов с семейным анамнезом рака желудка и без него молодой возраст при проведении эрадикации H. pylori был значительно связан со сниженным риском развития рака желудка в последующем [30]. Результаты данного исследования свидетельствуют о том, что раннее лечение инфекции увеличивает эффективность профилактики рака желудка в старшем возрасте.
Сообщения последних лет демонстрируют эффективность эрадикации H. pylori в отношении снижения риска развития рака желудка, в том числе у пациентов с предраковыми изменениями слизистой оболочки желудка на 52% [31], а также перенесших эндоскопическую резекцию рака желудка на ранней стадии на 50% [32, 33].
Таким образом, в качестве эффективного метода первичной профилактики аденокарциномы желудка, включая проксимальный рак желудка и рак желудочно-пищеводного соединения, может рассматриваться только эрадикационная терапия инфекции H. pylori.
Профессор Д.С. Бордин в своем докладе остановился на основных принципах выбора оптимальной схемы эрадикационной терапии в соответствии с положениями консенсусного доклада Маастрихт VI и с учетом накопленных данных Европейского регистра об эффективности различных схем эрадикационной терапии в Российской Федерации.
Докладчик подчеркнул, что в настоящее время особенно остро стоит проблема антибиотикорезистентности штаммов H. pylori, связанная с широким применением в клинической практике, в том числе в период пандемии COVID-19, антибактериальных препаратов, прежде всего из группы макролидов.
Как следует из данных Европейского регистра ведения инфекции H. pylori (European Registry on the management of Helicobacter pylori, протокол Hp-EuReg) – наблюдательного исследования, которое проводится по инициативе Европейской группы по изучению H. pylori и микробиоты (EHMSG) с 2013 г. для оценки реальной клинической практики применения рекомендаций экспертов по диагностике и лечению инфекции H. pylori, уже к 2018 г. резистентность H. pylori к азитромицину в Европе в среднем составляла 21,6% [34].
Цель эрадикационной терапии заключается в надежном излечении инфекции H. pylori у большинства пациентов (≥ 90%), что обусловливает необходимость использования схем терапии, к которым восприимчива инфекция. Это отражено в рекомендациях Маастрихт VI по выбору эмпирического лечения не только на основе информации о локальной резистентности H. pylori к кларитромицину, но и данных мониторинга эффективности схем в регионе [35].
Кроме того, впервые предложена стратегия индивидуализированной терапии на основе определения чувствительности H. pylori к антибактериальным препаратам перед ее назначением [51].
Информация о резистентности H. pylori к антибактериальным препаратам может быть получена при бактериологическом исследовании или молекулярно-генетическими методами [35]. Мониторинг эффективности схем эрадикации в регионе и обмен данными между врачебными сообществами реализован Европейским регистром ведения инфекции H. pylori [36].
К марту 2023 г. в Европейский регистр внесены данные более 62 тыс. пациентов, при этом Россия занимает второе место по числу набранных пациентов (более 10 тыс.), то есть по сути, подчеркнул Д.С. Бордин, мы уже имеем колоссальную базу, позволяющую оценить, какие схемы эрадикационной терапии эффективно работают на территории Российской Федерации. Согласно данным Европейского регистра на февраль 2022 г., в России доминирует тройная схема эрадикационной терапии с кларитромицином и амоксициллином (56%), однако ее эффективность не превышает 80%. Вместе с тем добавление к 14-дневной тройной терапии препаратов висмута трикалия дицитрата (ВТД) позволяет повысить эффективность эрадикационной терапии до 93% [37–39].
В настоящее время накоплена достаточная доказательная база преимущества добавления к стандартной тройной терапии с кларитромицином препаратов ВТД с целью преодоления резистентности H. pylori к антибиотикам [40–43], а также лучшей переносимости терапии и более низкой частоты антибиотик-ассоциированной диареи [44].
Стоит отметить, что риск повторного инфицирования H. pylori у взрослых после успешной эрадикации крайне низкий и не превышает 1% в год. При этом обследование всех членов семьи и проведение эрадикационной терапии при выявлении инфекции значительно снижают этот риск [47].
В заключение Д.С. Бордин подчеркнул, что, несмотря на рост в популяции резистентности H. pylori к кларитромицину, сохраняется возможность его использования в схемах эрадикационной терапии на территории Российской Федерации, но при условии добавления адъювантных препаратов, выборе современных ИПП (эзомепразол, рабепразол), продолжительности терапии 14 дней.
По данным исследований, использование дженериков в схемах эрадикации может существенно снизить ее эффективность, подвергая пациента дополнительным рискам, провоцировать рост резистентности H. pylori к антибактериальным препаратам, усложняя терапию для будущих поколений пациентов [48]. При проведении сравнительного анализа растворения различных препаратов кларитромицина было выявлено отличие в кинетике растворения. Исследователи приходят к выводу, что данные различия могут существенно отражаться на эффективности схем эрадикации с использованием воспроизведенных аналогов, а также косвенно способствовать развитию резистентности к кларитромицину из-за создания недостаточных концентраций антибиотика в тканях [49].
После обсуждения представленных докладов членами Экспертного совета была принята резолюция.
Положения резолюции Экспертного совета
- Первичный пациент с жалобами на эпигастральную боль, тошноту, чувство тяжести или переполнения в эпигастрии, чувство раннего насыщения, не принимавший препараты, способные вызывать лекарственные поражения желудка, должен быть рассмотрен как пациент с необследованной диспепсией.
- Первым диагнозом, требующим исключения у пациента с необследованной диспепсией, является хронический гастрит, ассоциированный с H. pylori.
- Пациенту с необследованной диспепсией в период до проведения тестирования на H. pylori с целью облегчения симптомов следует назначить прокинетики (итоприда гидрохлорид). При подозрении на хронический гастрит итоприда гидрохлорид способен облегчать симптомы диспепсии.
- Назначение ИПП (и комбинированных средств, в состав которых входит ИПП), а также Н2-гистаминоблокаторов, препаратов висмута, снижает чувствительность диагностических тестов на H. pylori (кроме серологического), поэтому они не должны назначаться до проведения диагностики на H. pylori.
- Наличие у пациента «красных флагов» (объективные признаки желудочно-кишечного кровотечения, немотивированная потеря веса, возраст старше 50 лет, отягощенный семейный анамнез по раку желудка) является показанием к проведению ЭГДС с биопсией.
- После завершения диагностического этапа пациенту с учетом индивидуального клинического ответа, а также высокого профиля безопасности, возможности, при необходимости, продолжать лечение длительным курсом и свободно сочетать с другими лекарственными препаратами, может быть продолжена терапия итоприда гидрохлоридом 50 мг три раза в день.
- Данные об эффективности итоприда гидрохлорида продемонстрированы в исследованиях оригинального препарата.
- Положительный результат теста на H. pylori является показанием для проведения эрадикационной терапии.
- Необходимо убедительно донести до пациента важность выявления H. pylori и риски для здоровья, которые представляет данная инфекция.
- Поскольку H. pylori является основным этиологическим фактором аденокарциномы желудка, включая проксимальный рак желудка и рак желудочно-пищеводного соединения, своевременное выявление и эрадикация H. pylori обеспечивают первичную профилактику этих онкологических заболеваний.
- Эрадикация H. pylori может вызвать регресс атрофии желудка и в некоторой степени кишечной метаплазии, а также у части пациентов остановить прогрессирование хронического атрофического гастрита до рака. Эрадикация H. pylori наиболее эффективна для профилактики рака желудка до развития тяжелого хронического атрофического гастрита (стадии III–IV по OLGA).
- Польза от проводимой эрадикации для здоровья человека значительно превышает потенциальный риск развития нежелательных реакций (в основном аллергические реакции, горечь во рту, диарея).
- Риск повторного инфицирования H. pylori определяется уровнем гигиены и не превышает у взрослых пациентов 1% в год в общей популяции.
- Для скрининга H. pylori следует отдавать предпочтение неинвазивным диагностическим тестам, таким как 13С-УДТ, определение антигена в кале с моноклональными антителами, однако могут быть использованы любые рекомендованные методы.
- Контроль эрадикации должен проводиться не ранее чем через 30 дней после завершения антихеликобактерной терапии, предпочтение также отдается неинвазивным тестам (13С-УДТ или определение антигена в кале с моноклональными антителами). Для контроля эрадикации быстрый уреазный и серологический (антитела к H. pylori) тесты не рекомендуются.
- Согласно локальным данным, четырехкомпонентная терапия с кларитромицином (амоксициллин + кларитромицин + ИПП + висмута трикалия дицитрат) в течение 14 дней обеспечивает эффективность эрадикации, превышающую 90%, что позволяет определить ее как терапию первой линии на территории РФ.
- Передача H. pylori происходит главным образом в детстве, внутри семьи. При выявлении H. pylori рекомендуется диагностика этой инфекции у всех членов семьи.
- Использование оригинальных препаратов обеспечивает целевые уровни эрадикации – ≥ 90%
- Применение некачественных генериков потенциально может негативно сказываться на результатах эрадикационной терапии, способствовать росту резистентности бактерий к антибиотикам.
I.V. Maev, PhD, Prof., Academician of the RAS, L.B. Lazebnik, PhD, Prof., D.S. Bordin, PhD, Prof., N.N. Dekhnich, PhD, Prof., Yu.A. Kucheryavy, PhD, Assistant Prof., A.A. Tryakin, PhD, O.V. Gaus, PhD, M.A. Livzan, PhD, Prof., Corresponding member of RAS7
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific Center
Tver State Medical University
Smolensk State Medical University
Ilyinsky Hospital, Krasnogorsk, Moscow region
N.N. Blokhin National Medical Research Center of Oncology
Omsk State Medical University
Contact person: Maria A. Livzan, mlivzan@yandex.ru
Purpose. To present the materials of the Expert Council, which was held on April 22, 2023 in Moscow and dedicated to modern approaches to the management of patients with unexplored dyspepsia, as well as the choice of the optimal Helicobacter pylori eradication therapy scheme in the Russian Federation.
The main provisions of the resolution. An initial patient with recent dyspeptic symptoms who has not taken drugs that can cause gastric damage should be considered as a patient with undiagnosed dyspepsia. The first diagnosis to be excluded in a patient with unexplored dyspepsia is H. pylori-associated chronic gastritis. In order to alleviate or eliminate the symptoms of dyspepsia in the period before testing for H. pylori, the appointment of the prokinetic itopride hydrochloride is recommended, given the lack of influence on the results of the examination, proven efficacy and high safety profile, as demonstrated in studies on the original drug.
The patient's presence of objective signs of gastrointestinal bleeding, unmotivated weight loss, aggravated family history of gastric cancer, as well as age over 50 years are indications for esophagogastroduodenoscopy with biopsy.
An initial positive test for H. pylori is an indication for eradication therapy, as infection is a major etiological factor in gastric adenocarcinoma, including proximal gastric cancer and cancer of the gastroesophageal junction. Quadruple therapy with clarithromycin (amoxicillin + clarithromycin + proton pump inhibitor + bismuth tripotassium dicitrate) for 14 days can be defined as first-line therapy in the Russian Federation. In order to increase the effectiveness of eradication, the use of original preparations is recommended.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.