Возможности молекулярно-генетического метода выявления резистентности к кларитромицину и левофлоксацину у Helicobacter pylori
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – определение чувствительности и специфичности выявления резистентности изолятов H. pylori к кларитромицину и левофлоксацину методом ПЦР.
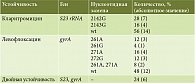
Материалы и методы. Протестировано 25 образцов (изолятов) H. pylori, у которых уже была определена чувствительность к кларитромицину и левофлоксацину методом серийных разведений в агаре. Молекулярно-генетическое выявление резистентности проводили с помощью определения аллельных вариантов в генах, ответственных за резистентность к кларитромицину – S23 (2142A>C, 2142A>G и 2143A>G) и левофлоксацину – gyrA (87-й кодон 259A>T, 261T/C>G/A и 91-й кодон 271G>A, 271G>T, 272A>G).
Результаты. Установлено, что 11 образцов из 25 имели мутации в гене устойчивости к кларитромицину, в 13 образцах зарегистрированы мутации в гене устойчивости к левофлоксацину, шесть образцов имели двойную устойчивость. Все 11 культур с фенотипической устойчивостью к кларитромицину имели мутации в гене S23 рРНК. Из 14 культур с фенотипической резистентностью к левофлоксацину мутации в гене gyrA имели 13 культур. Чувствительность и специфичность молекулярно-генетического метода определения резистентности к кларитромицину составили 100%, в отношении резистентности к левофлоксацину эти показатели составили 93 и 92% соответственно.
Заключение. Молекулярно-генетический метод позволяет быстро и точно определять устойчивость H. pylori к кларитромицину и левофлоксацину, способствует выбору персонализированных схем лечения пациентов с инфекцией H. pylori.
Цель исследования – определение чувствительности и специфичности выявления резистентности изолятов H. pylori к кларитромицину и левофлоксацину методом ПЦР.
Материалы и методы. Протестировано 25 образцов (изолятов) H. pylori, у которых уже была определена чувствительность к кларитромицину и левофлоксацину методом серийных разведений в агаре. Молекулярно-генетическое выявление резистентности проводили с помощью определения аллельных вариантов в генах, ответственных за резистентность к кларитромицину – S23 (2142A>C, 2142A>G и 2143A>G) и левофлоксацину – gyrA (87-й кодон 259A>T, 261T/C>G/A и 91-й кодон 271G>A, 271G>T, 272A>G).
Результаты. Установлено, что 11 образцов из 25 имели мутации в гене устойчивости к кларитромицину, в 13 образцах зарегистрированы мутации в гене устойчивости к левофлоксацину, шесть образцов имели двойную устойчивость. Все 11 культур с фенотипической устойчивостью к кларитромицину имели мутации в гене S23 рРНК. Из 14 культур с фенотипической резистентностью к левофлоксацину мутации в гене gyrA имели 13 культур. Чувствительность и специфичность молекулярно-генетического метода определения резистентности к кларитромицину составили 100%, в отношении резистентности к левофлоксацину эти показатели составили 93 и 92% соответственно.
Заключение. Молекулярно-генетический метод позволяет быстро и точно определять устойчивость H. pylori к кларитромицину и левофлоксацину, способствует выбору персонализированных схем лечения пациентов с инфекцией H. pylori.



Введение
Helicobacter pylori (H. pylori) представляет собой грамотрицательную бактерию, которой инфицировано около 4,4 млрд человек во всем мире. В развитых странах отмечен тренд на снижение распространенности этой инфекции, что ассоциировано со снижением заболеваемости язвенной болезнью и раком желудка [1]. В Российской Федерации распространенность H. pylori ранее оценивали на уровне 50–92% [2–4], а по последним данным, в России инфицировано около 40% населения [5].
Бактерия H. pylori является основной причиной развития хронического гастрита, язвенной болезни, рака желудка, MALT-лимфомы [6] и других заболеваний [7]. Эрадикационная терапия H. pylori является основным методом лечения этих заболеваний и методом первичной профилактики рака желудка [8].
В недавно опубликованном консенсусе Маастрихт VI в первые предложены две основные стратегии выбора эрадикационной терапии: индивидуализированная – на основе определения чувствительности к антибактериальным препаратам (фенотипическим или молекулярно-генетическим методом) до их назначения, и эмпирическая, с учетом данных о локальной резистентности H. pylori к кларитромицину и мониторинга эффективности схем в регионе [9, 10]. В этой связи возрастает роль молекулярных методов диагностики (в частности, ПЦР в реальном времени, полногеномного секвенирования и цифровой ПЦР) для выявления мутаций H. pylori, связанных с резистентностью к кларитромицину, левофлоксацину, тетрациклину и рифабутину [11].
Показатели устойчивости H. pylori к антибиотикам неуклонно растут во всем мире, что ведет к снижению эффективности схем лечения этой инфекции [12]. Использование макролидных антибиотиков в лечении респираторных заболеваний привело к росту резистентности H. pylori к кларитромицину – основному компоненту тройной терапии первой линии и, соответственно, резкому снижению ее эффективности [13, 14].
В Европе показатели резистентности H. pylori к кларитромицину составляют 18–21,4%, левофлоксацину – 11,0–16,3%, метронидазолу – 39,1–56%. Отмечена значительно большая распространенность в странах Центральной и Южной Европы, чем в странах Северной Европы. В Америке зарегистрирована резистентность к кларитромицину на уровне 10% [15, 16]. В Китае первичная резистентность H. pylori к кларитромицину, метронидазолу и левофлоксацину оценивается на уровне 28,9; 63,8 и 28,0% соответственно. Показатели устойчивости H. pylori аналогичны таковым в Южной Корее [17, 18].
Обобщенный показатель резистентности H. pylori к кларитромицину в Российской Федерации за последние десять лет составил 10,39% (95%-ный доверительный интервал (95% ДИ) 7,103–14,219). По результатам исследований, проведенных в Москве и Московской области, выявлена резистентность H. pylori к кларитромицину на уровне 10,87% (95% ДИ 7,280–15,439), Санкт-Петербурге – 22,26% (95% ДИ 9,525–38,470), Смоленске – 5,74% (95% ДИ 3,511–8,789), Казани – 10,0% (95% ДИ 5,023–17,355). Согласно данным метаанализов [19, 20], уровень резистентности к левофлоксацину cоставил 20%, метронидазолу – 34%, амоксициллину – 1,35%, тетрациклину – 0,98%. Авторы этих метаанализов отметили существенную гетерогенность между включенными исследованиями, ряд из которых был проведен более 10 лет назад, а также различия в применявшихся методиках. Кроме того, данные о низкой резистентности к кларитромицину не подтверждаются сообщениями о недостаточной эффективности стандартной тройной терапии, включающей этот антибиотик. Так, в наблюдательном исследовании «Европейский регистр ведения инфекции Helicobacter pylori» (Hp-EuReg) было показано, что в России в 2013–2018 гг. тройная терапия (ингибиторы протонной помпы, кларитромицин, амоксициллин) назначали в 62,8–68,9% случаев. Эффективность 14-дневной тройной терапии у завершивших прием препаратов (per protocol, PP) составила 85%, при анализе начавших терапию (ITT) – 66% [21]. При этом резистентность к антибиотикам в России составила: 24% к кларитромицину, 27% к левофлоксацину, 29% к метронидазолу, 6% к амоксициллину, 0% к тетрациклину [22].
Устойчивость H. pylori к антибиотикам связана с формированием мутаций или других генетических изменений, которые нарушают механизмы их действия. Большинство случаев первичной резистентности к кларитромицину (около 90% в западных странах) связано с точечными мутациями в гене 23S рРНК, кодирующем пептидилтрансферазу в V домене 23S рРНК, которые приводят к снижению аффинности макролидов к рибосомам бактериальной клетки, тем самым формируя резистентность [23]. Наиболее распространенными, связанными с устойчивостью, мутациями гена 23S рРНК являются A2142G, A2142C и A2143G [24].
Бактерицидное и бактериостатическое действие левофлоксацина обусловлено связыванием с ДНК-гиразами. Функции ДНК-гиразы H. pylori кодируются генами gyrA и gyrB. Резистентность в первую очередь обусловлена несинонимичными мутациями, приводящими к заменам аминокислот в положениях 87 и 91 в белке GyrA [25].
Золотым стандартом в определении чувствительности H. pylori к антимикробным препаратам являются фенотипические методы: метод разведений в агаре или метод градиентной диффузии. Эти методы позволяют определить минимальную подавляющую концентрацию антибиотика для каждого тестируемого изолята, полученного культуральным методом, и оценить категорию его чувствительности к исследуемому препарату. Однако необходимость выделения чистой культуры H. pylori, методология определения чувствительности с использованием специальных питательных сред и микроаэрофильной атмосферы культивирования, высокие требования к квалификации персонала, большие временные затраты ограничивают применение культуральных методов выделения H. pylori и определения чувствительности к антимикробным препаратам в клинической практике [26].
В настоящее время актуальными в определении чувствительности H. pylori к антибактериальным препаратам являются молекулярно-генетические методы – ПЦР в режиме реального времени. Коммерческие наборы для ПЦР обеспечивают высокую чувствительность (95%) и специфичность (100%) как для выявления H. pylori, так и определения чувствительности к антимикробным препаратам [27]. Такие тесты выполняются быстро (в течение нескольких часов) и не требуют специальных условий транспортировки, в отличие от культурального метода.
Цель исследования – определение чувствительности и специфичности выявления резистентности изолятов H. pylori к кларитромицину и левофлоксацину методом ПЦР.
Материалы и методы
Протестировано 25 образцов чистой культуры H. pylori, у которых уже была определена чувствительность к кларитромицину и левофлоксацину методом серийных разведений в агаре. Фенотипическое определение антибиотикорезистентности штаммов проводили в НИИ антимикробной химиотерапии Смоленского государственного медицинского университета, последующее молекулярно-генетическое определение резистентности выполнено в Московском клиническом научно-практическом центре им. А.С. Логинова. Исследование проводилось вслепую: после того как были установлены аллельные варианты в генах антибиотикорезистентности, выполняли сравнительный анализ молекулярно-генетических данных с фенотипическими.
Фенотипическую резистентность определяли методом серийных разведений в катионсбалансированном агаре Мюллера – Хинтон (OXOID, Великобритания) с добавлением бараньей крови (итоговая концентрация 5%) (E&O Laboratories Ltd., Шотландия) в соответствии с рекомендациями Института по клиническим и лабораторным стандартам США (CLSI).
Использовали критерии оценки чувствительности H. pylori к антимикробным препаратам, представленные в табл. 1.
Молекулярно-генетическое определение резистентности проводили путем выявления аллельных вариантов в генах, ответственных за резистентность к кларитромицину – S23 (2142A>C, 2142A>G и 2143A>G) и левофлоксацину – gyrA (87-й кодон 259A>T, 261T/C>G/A и 91-й кодон 271G>A, 271G>T, 272A>G).
ДНК из культур выделяли набором «Проба НК» (ДНК-технология) согласно инструкции производителя. Качество выделенной ДНК оценивали с помощью спектрофотометра Biowave II (Biochrom, США). Определение аллельных вариантов в генах резистентности выполняли методом секвенирования по Сенгеру с использованием собственной разработанной тест-системы на 3500 генетическом анализаторе (Applied biosystems, США).
Результаты
Установлено, что 11 образцов из 25 имели мутации в гене устойчивости к кларитромицину, в 13 образцах зарегистрированы мутации в гене устойчивости к левофлоксацину, шесть образцов имели двойную устойчивость. Генетические варианты в генах резистентности S23, gyrA 25 образцов культур H. pylori представлены в табл. 2.
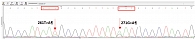
Стоит отметить, что у некоторых культур было обнаружено состояние перехода от дикого типа к мутантному (рис. 1). Чаще всего состояние перехода наблюдалось в гене gyrA, обусловливающем устойчивость к левофлоксацину.
При сравнении данных о резистентности H. pylori, полученных с помощью молекулярно-генетического метода, с данными фенотипического метода (серийных разведений в агаре) было отмечено, что все
11 культур с фенотипической устойчивостью к кларитромицину имели мутации в гене S23 рРНК.
Из 14 культур с фенотипической резистентностью к левофлоксацину 13 культур имели соответствующие мутации в гене gyrA (табл. 3).
Две культуры H. pylori, у которых были выявлены мутации в гене gyrA, не имели фенотипической резистентности. В одной из них наблюдался переход аллеля дикого типа в мутантный (рис. 2).
Таким образом, чувствительность и специфичность молекулярно-генетического метода определения резистентности к кларитромицину составили 100%, в отношении резистентности к левофлоксацину – 93 и 92% соответственно.
Обсуждение
Данные о резистентности H. pylori к кларитромицину, полученные с помощью молекулярно-генетического тестирования, полностью соответствовали таковым, полученным фенотипическим методом. Все 14 культур с фенотипической резистентностью к кларитромицину имели мутации в гене 23S рРНК. В случае с резистентностью к левофлоксацину результаты тоже вполне убедительные: 13 культур из 14 с фенотипической резистентностью к левофлоксацину имели мутации в гене gyrA. В двух культурах, не имеющих фенотипической резистентности к левофлоксацину, были обнаружены мутации в гене gyrA. Однако в одной из них наблюдалось состояние перехода от дикого типа аллеля к мутантному. Во второй культуре мутация была обнаружена в 87-м кодоне гена gyrA.
Известно, что существуют региональные особенности антибиотикорезистентности H. pylori. Значимость нуклеотидных замен в 87-м кодоне гена gyrA именно для российской популяции еще предстоит уточнить. Возможно, резистентность к левофлоксацину в дополнение к заменам в 87-м, 91-м кодах обусловливают иные варианты данного гена или других генов. Так, в исследовании P. Subsomwong и соавт. (2022) в популяции Мьянмы почти все устойчивые к левофлоксацину изоляты имели аминокислотную замену в положении 91 (Asp-91 на Asn или Tyr) и не имели замен в 87-м кодоне. Однако у устойчивых к левофлоксацину штаммов в соседних с Мьянмой странах Юго-Восточной Азии, таких как Индонезия, Малайзия и Камбоджа, были обнаружены обе мутации [28]. Во многих исследованиях описаны одиночные или двойные мутации в положениях Asn87 и Asp91 как наиболее частые сайты мутаций в резистентных изолятах H. pylori из слизистой оболочки желудка [29–31]. Научные исследования подтверждают, что вариации аминокислот придают устойчивость к антибиотикам в зависимости от географического положения [29, 32, 33].
Исследования резистентности H. pylori к антибиотикам, особенно к кларитромицину и левофлоксацину, приобретают особую значимость при выборе стратегии лечения инфекции H. pylori как при индивидуализированном выборе эрадикационной терапии на основе определения чувствительности к антимикробным препаратам (фенотипическим или молекулярно-генетическим методом) до их назначения, так и для обоснования эмпирической стратегии в регионе, основанной на мониторинге локальной резистентности H. pylori к кларитромицину.
Представленные данные свидетельствуют о высокой диагностической ценности молекулярно-генетического метода, позволяющего быстро и точно определять устойчивость H. pylori к кларитромицину и левофлоксацину. Разработанная тест-система с определением мутаций к кларитромицину S23 (2142A>C, 2142A>G и 2143A>G) и левофлоксацину gyrA (87-й кодон 259A>T, 261T/C>G/A и 91-й кодон 271G>A, 271G>T, 272A>G) обладает высокой чувствительностью и специфичностью. Требуются дальнейшие исследования для определения резистентности к указанным антибиотикам методом ПЦР в биоптатах с контролем фенотипическим методом.
L.A. Tsapkova, PhD, V.V. Polyakova, N.A. Bodunova, PhD, I.V. Baratova, I.N. Voynovan, PhD, N.N. Dekhnich, PhD, N.V. Ivanchik, PhD, E.A. Sabelnikova, PhD, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Smolensk State Medical University
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Larisa A. Tsapkova, l.capkova@mknc.ru
About half of the world's population is infected with the bacterium Helicobacter pylori, which in all cases leads to the development of chronic gastritis, which can progress into peptic ulcer, MALT lymphoma and stomach cancer. H. pylori eradication prevents the development of these diseases. The growth of H. pylori resistance to antibiotics, especially to clarithromycin, is the main reason for the ineffectiveness of treatment and is a serious problem. The Maastricht VI Consensus offers two main strategies for the choice of the eradication therapy: individualized – based on determining sensitivity to antibacterial drugs (phenotypic or molecular genetic method) before their appointment, and empirical, taking into account data on local H. pylori resistance to clarithromycin and monitoring the effectiveness of regimens in the region. In this regard, the role of molecular genetic methods for assessing the resistance of H. pylori to antibiotics increases.
The aim of the study – to determine the sensitivity and specificity of detecting the resistance of H. pylori isolates to clarithromycin and levofloxacin by PCR.
Materials and methods. 25 samples (isolates) of H. pylori have been tested, in which sensitivity to clarithromycin and levofloxacin has already been determined by the method of serial dilutions in agar. Molecular genetic detection of resistance was performed by determining allelic variants in the genes responsible for resistance to clarithromycin S23 (2142A>C, 2142A>G and 2143A>G) and levofloxacin gyrA (87 codon 259A>T, 261T/C>G/A and 91 codon 271G>A, 271G>T, 272A>G).
Results. It was found that 11 out of 25 samples had mutations in the clarithromycin resistance gene, mutations in the levofloxacin resistance gene were registered in 13 samples, and six samples had double resistance. All 11 cultures with phenotypic resistance to clarithromycin had mutations in the S23 rRNA gene. Of the 14 cultures with phenotypic resistance to levofloxacin, 13 cultures had mutations in the gyrA gene. The sensitivity and specificity of the molecular genetic method for determining resistance to clarithromycin
was 100%, with respect to resistance to levofloxacin, these indicators were 93 and 92%, respectively.
Conclusion. The molecular genetic method makes it possible to determine the resistance of H. pylori to clarithromycin and levofloxacin quickly and accurately, promotes the selection of personalized treatment regimens for patients with H. pylori infection.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.