количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Результаты многоцентрового годичного исследования препарата Дьюралан
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Ревматология. Травматология. Ортопедия" №1
- Аннотация
- Статья
- Ссылки
В статье дается характеристика препарата Дьюралан, получаемого методом NASHAТМ. Приводятся данные зарубежных РКИ, а также результаты российского многоцентрового двенадцатимесячного исследования эффективности и безопасности Дьюралана у больных с первичным остеоартрозом коленных и тазобедренных суставов (НИИ ревматологии РАМН, ГКБ № 1 г. Москвы, Первый МГМУ им. И.М. Сеченова).
Исследование с участием 45 больных с коксартрозом и гонартрозом показало: однократное введение Дьюралана достоверно уменьшает боль, утреннюю скованность и улучшает функциональную активность суставов на протяжении 12 месяцев. Препарат обладает прекрасной переносимостью, нежелательных явлений, связанных с инъекциями Дьюралана, не наблюдалось.
В течение 40 лет для симптоматического лечения остеоартроза используются препараты гиалуроновой кислоты, эффективность которых доказана в многочисленных рандомизированных контролируемых исследованиях (РКИ).
В статье дается характеристика препарата Дьюралан, получаемого методом NASHAТМ. Приводятся данные зарубежных РКИ, а также результаты российского многоцентрового двенадцатимесячного исследования эффективности и безопасности Дьюралана у больных с первичным остеоартрозом коленных и тазобедренных суставов (НИИ ревматологии РАМН, ГКБ № 1 г. Москвы, Первый МГМУ им. И.М. Сеченова).
Исследование с участием 45 больных с коксартрозом и гонартрозом показало: однократное введение Дьюралана достоверно уменьшает боль, утреннюю скованность и улучшает функциональную активность суставов на протяжении 12 месяцев. Препарат обладает прекрасной переносимостью, нежелательных явлений, связанных с инъекциями Дьюралана, не наблюдалось.
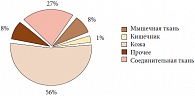
Рис. 1. Распределение гиалуроновой кислоты в тканях организма человека
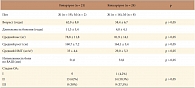
Таблица 1. Клиническая характеристика больных остеоартрозом крупных суставов

Рис. 2. Динамика значений шкалы боли WOMAC в ITT популяции

Рис. 3. Динамика значений шкалы скованности WOMAC в ITT популяции

Рис. 4. Динамика суммарного значения индекса WOMAC в ITT популяции
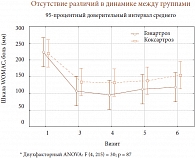
Рис. 5. Динамика значений шкалы боли WOMAC у больных гонартрозом и коксартрозом
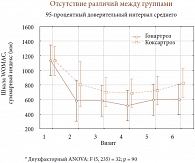
Рис. 6. Динамика суммарного значения индекса WOMAC у больных гонартрозом и коксартрозом

Таблица 2. Изменение режима приема НПВП

Таблица 3. Переносимость Дьюралана при остеоартрозе крупных суставов

Рис. 7. Оценка эффективности лечения, проводимая врачом и пациентом
Одним из основных звеньев патогенеза ОА является деструкция суставного хряща, который представляет собой специализированную ткань, состоящую из матрикса и погруженных в него хондроцитов. Последние продуцируют наиболее важные компоненты хрящевого матрикса – протеогликаны и макромолекулы коллагена различных типов (в основном II типа), а также металлопротеиназы – энзимы, которые катализируют деградацию коллагена и протеогликанов. В норме анаболические и катаболические процессы находятся в сбалансированном состоянии, при ОА этот баланс нарушается. В результате снижается синтез протеогликанов, коллагена II типа и повышается синтез коллагена I, III, Х типов. Активация хондроцитов приводит, с одной стороны, к ухудшению синтеза полноценных компонентов матрикса хряща, а с другой стороны, – к повышенной экспрессии провоспалительных цитокинов (интерлейкина-1, интерлейкина-6, фактора некроза опухоли-?), циклооксигеназы 2, оксида азота, которые принимают участие в процессе деградации хряща [3].
Попадая в синовиальную жидкость, продукты деградации хряща, имеющие антигенные свойства, провоцируют развитие синовита. Синовиальное воспаление приводит к нарушению обменных процессов в синовиоцитах, в результате чего страдает образование синовиальной жидкости и эндогенной гиалуроновой кислоты (ГК). Кроме этого, медиаторы воспаления, продуцируемые синовиальными клетками, способствуют повышению проницаемости сосудов и усиленной трансфузии плазмы в синовиальную жидкость, что ведет к уменьшению концентрации ГК, снижению вязкоэластических и лубрикантных свойств синовиальной жидкости и нарушению ее защитной функции [4]. Таким образом, сущность патологических процессов, происходящих при ОА, заключается не только в структурных и метаболических нарушениях в суставном хряще, но и в изменении характера синовиальной жидкости [5].
В норме синовиальная мембрана регулирует объем и состав синовиальной жидкости, обеспечивает хондроциты питательными веществами, участвует в уничтожении клеток и молекул, инициирующих воспаление. ГК присутствует в межклеточном матриксе практически любой ткани организма человека и является основным компонентом соединительной ткани (рис. 1). По химической структуре ГК представляет собой гетерополисахарид (глюкозаминогликан), мономером которого является дисахарид, состоящий из D-глюкуронила и D-N-ацетилглюкозамина, соединенных между собой гликозидными мостиками (до 25 000 дисахаридов в одной линейной молекуле). Эта длинная неразветвленная цепочка дисахаридов образует ось гигантской молекулы протеогликана, который, наряду с коллагеном, является основным биополимером соединительной ткани и, в частности, суставного хряща. Уникальные вязкоэластичные свойства синовиальной жидкости обеспечивают макромолекулы ГК, которая секретируется синовиальной оболочкой в полость сустава.
ГК играет важную роль в поддержании гомеостаза здорового сустава на разных уровнях:
У здорового человека молекулярный вес ГК синовиальной жидкости равен 3500–5000 кДа. В коленном суставе содержится около 2 мл синовиальной жидкости, и концентрация ГК в ней составляет от 2,5 до 4 мг/мл. Поддержание оптимальных концентраций ГК в синовиальной жидкости предотвращает потерю протеогликанов суставным матриксом, а также инвазию активированных макрофагов в полость сустава.
У больных ОА наблюдается снижение концентрации ГК в синовиальной жидкости в 2–3 раза по сравнению со здоровыми людьми и уменьшение размера молекул ГК, что способствует ускорению ее диализа через синовиальную оболочку, уменьшению вязкости синовиальной жидкости, нарушению ее функций и как следствие – разрушению хряща [7]. Помимо этого, в экспериментах на животных было продемонстрировано: при хроническом воспалении в суставе провоспалительные цитокины, в частности интерлейкин-1, стимулируют экспрессию гиалуронан-синтетазы, вызывающей, в свою очередь, фрагментацию ГК, что тоже влияет на прогрессирование деструктивных изменений хряща.
Эти данные послужили предпосылкой для использования в терапии ОА препаратов на основе ГК (ее натриевой соли). Механизм действия экзогенной ГК в суставе недостаточно ясен. ГК обеспечивает восстановление вязкоэластических свойств синовиальной жидкости, причем клинический эффект сохраняется в течение нескольких месяцев, несмотря на то что время нахождения введенного препарата в суставной полости составляет от нескольких часов до нескольких дней. Можно предположить, что существуют и другие механизмы действия ГК, например, восстановление эластических свойств обусловлено противовоспалительным действием вводимых в сустав препаратов ГК, а также их возможностью стимулировать синтез эндогенной ГК [8].
Большое число исследований, проведенных in vitro и in vivo, показали: ГК способна индуцировать агрегацию и синтез протеогликанов, модулировать воспалительный ответ, уменьшать хемотаксис и обезвреживать действие свободных радикалов кислорода. Помимо этого, ГК ингибирует высвобождение арахидоновой кислоты из фибробластов человека и продукцию простагландина Е2 [9–15]. Первые препараты ГК для лечения больных ОА появились в 70-е гг. XX века, в конце 1980-х гг. они стали широко применяться в Японии, Италии, затем в Канаде. В 1998 г. применение гиалуронанов для внутрисуставного введения при ОА было одобрено FDA в США. В 2000 г. препараты ГК были включены в рекомендации по лечению ОА крупных суставов [16, 17].
Эффективность и безопасность препаратов ГК показана во многих плацебо-контролируемых исследованиях. Так, в Кохрановском систематическом обзоре (2006), который включал 76 клинических исследований, отмечено достоверно значимое улучшение при введении ГК по сравнению с плацебо по основным показателям эффективности лечения (боль в покое и при нагрузке – по визуальной аналоговой шкале, индексы WOMAC, Лекена) [18]. Было также показано, что ГК оказывает более продолжительный эффект по сравнению с кортикостероидами. В отличие от них длительность эффекта у большинства пациентов после окончания курса введения препаратов ГК составляла от 4 месяцев до 1 года, в то время как эффект от внутрисуставного введения кортикостероидов – не более 4 недель.
Клиническая эффективность ГК доказана в метаанализе, включавшем 20 РКИ у пациентов с ОА коленных суставов [19]. Chen-Ti Wang и соавт. было подчеркнуто, что ГК способна положительно влиять на симптомы заболевания (боль в покое, при движении) и функцию сустава при относительно малом риске развития побочных реакций. Однако авторы отметили: результаты зависят от методического уровня проводимых исследований и многих других факторов, например, от возраста участвовавших в исследовании пациентов. Так, у больных старше 65 лет эффект от введения ГК менее выражен, зависит от стадии заболевания, применения дополнительной терапии во время исследования и т. п. Обобщив данные экспериментальных и клинических исследований применения различных препаратов ГК, Victor M. Goldberg и Joseph A. Buckwalter (2005) сделали заключение о наличии у них структурно-модифицирующих свойств, которые влияют на течение заболевания, однако механизмы действия до сих пор остаются невыясненными [20].
Вместе с тем в некоторых работах было показано, что эффект от введения препаратов ГК практически идентичен эффекту от введения плацебо как в кратковременных исследованиях, длительностью до 26 недель [21], так и в более длительных – до 52 недель и более [22]. Тем не менее систематический обзор 5 метаанализов продемонстрировал: низко- и высокомолекулярные препараты ГК эффективно уменьшают симптомы ОА коленных суставов, такие как боль, припухлость и скованность [23].
В настоящее время применяется множество препаратов ГК с различной молекулярной массой, которые получают различными способами, например, методом экстракции, чаще из петушиных гребешков, методом бактериальной ферментации NASHAтм (Non-Animal Stabilized Hyaluronic Acid). Этот метод используется при производстве препарата Дьюралан, который применяется в клинической практике с 2002 г. и состоит из полученной биосинтетическим способом стабилизированной ГК, к которой в качестве буфера добавлен нейтральный физиологический раствор хлористого натрия.
ГК играет важную роль в поддержании гомеостаза здорового сустава на разных уровнях:
- макрогомеостаз (реология) – ГК ответственна за вязкоэластичные свойства синовиальной жидкости;
- мини-гомеостаз (свойства самой синовиальной жидкости): регуляция лимфообращения, обеспечение диффузии питательных веществ и продуктов обмена;
- микрогомеостаз (химические свойства): удаление свободных радикалов, защита хондроцитов и синовиоцитов от воздействия катаболических энзимов, химических веществ и токсинов, стабилизация клеточных мембран, десенсибилизация чувствительных рецепторов, саморегулирующаяся среда для нормального синтеза ГК [6].
У здорового человека молекулярный вес ГК синовиальной жидкости равен 3500–5000 кДа. В коленном суставе содержится около 2 мл синовиальной жидкости, и концентрация ГК в ней составляет от 2,5 до 4 мг/мл. Поддержание оптимальных концентраций ГК в синовиальной жидкости предотвращает потерю протеогликанов суставным матриксом, а также инвазию активированных макрофагов в полость сустава.
У больных ОА наблюдается снижение концентрации ГК в синовиальной жидкости в 2–3 раза по сравнению со здоровыми людьми и уменьшение размера молекул ГК, что способствует ускорению ее диализа через синовиальную оболочку, уменьшению вязкости синовиальной жидкости, нарушению ее функций и как следствие – разрушению хряща [7]. Помимо этого, в экспериментах на животных было продемонстрировано: при хроническом воспалении в суставе провоспалительные цитокины, в частности интерлейкин-1, стимулируют экспрессию гиалуронан-синтетазы, вызывающей, в свою очередь, фрагментацию ГК, что тоже влияет на прогрессирование деструктивных изменений хряща.
Эти данные послужили предпосылкой для использования в терапии ОА препаратов на основе ГК (ее натриевой соли). Механизм действия экзогенной ГК в суставе недостаточно ясен. ГК обеспечивает восстановление вязкоэластических свойств синовиальной жидкости, причем клинический эффект сохраняется в течение нескольких месяцев, несмотря на то что время нахождения введенного препарата в суставной полости составляет от нескольких часов до нескольких дней. Можно предположить, что существуют и другие механизмы действия ГК, например, восстановление эластических свойств обусловлено противовоспалительным действием вводимых в сустав препаратов ГК, а также их возможностью стимулировать синтез эндогенной ГК [8].
Большое число исследований, проведенных in vitro и in vivo, показали: ГК способна индуцировать агрегацию и синтез протеогликанов, модулировать воспалительный ответ, уменьшать хемотаксис и обезвреживать действие свободных радикалов кислорода. Помимо этого, ГК ингибирует высвобождение арахидоновой кислоты из фибробластов человека и продукцию простагландина Е2 [9–15]. Первые препараты ГК для лечения больных ОА появились в 70-е гг. XX века, в конце 1980-х гг. они стали широко применяться в Японии, Италии, затем в Канаде. В 1998 г. применение гиалуронанов для внутрисуставного введения при ОА было одобрено FDA в США. В 2000 г. препараты ГК были включены в рекомендации по лечению ОА крупных суставов [16, 17].
Эффективность и безопасность препаратов ГК показана во многих плацебо-контролируемых исследованиях. Так, в Кохрановском систематическом обзоре (2006), который включал 76 клинических исследований, отмечено достоверно значимое улучшение при введении ГК по сравнению с плацебо по основным показателям эффективности лечения (боль в покое и при нагрузке – по визуальной аналоговой шкале, индексы WOMAC, Лекена) [18]. Было также показано, что ГК оказывает более продолжительный эффект по сравнению с кортикостероидами. В отличие от них длительность эффекта у большинства пациентов после окончания курса введения препаратов ГК составляла от 4 месяцев до 1 года, в то время как эффект от внутрисуставного введения кортикостероидов – не более 4 недель.
Клиническая эффективность ГК доказана в метаанализе, включавшем 20 РКИ у пациентов с ОА коленных суставов [19]. Chen-Ti Wang и соавт. было подчеркнуто, что ГК способна положительно влиять на симптомы заболевания (боль в покое, при движении) и функцию сустава при относительно малом риске развития побочных реакций. Однако авторы отметили: результаты зависят от методического уровня проводимых исследований и многих других факторов, например, от возраста участвовавших в исследовании пациентов. Так, у больных старше 65 лет эффект от введения ГК менее выражен, зависит от стадии заболевания, применения дополнительной терапии во время исследования и т. п. Обобщив данные экспериментальных и клинических исследований применения различных препаратов ГК, Victor M. Goldberg и Joseph A. Buckwalter (2005) сделали заключение о наличии у них структурно-модифицирующих свойств, которые влияют на течение заболевания, однако механизмы действия до сих пор остаются невыясненными [20].
Вместе с тем в некоторых работах было показано, что эффект от введения препаратов ГК практически идентичен эффекту от введения плацебо как в кратковременных исследованиях, длительностью до 26 недель [21], так и в более длительных – до 52 недель и более [22]. Тем не менее систематический обзор 5 метаанализов продемонстрировал: низко- и высокомолекулярные препараты ГК эффективно уменьшают симптомы ОА коленных суставов, такие как боль, припухлость и скованность [23].
В настоящее время применяется множество препаратов ГК с различной молекулярной массой, которые получают различными способами, например, методом экстракции, чаще из петушиных гребешков, методом бактериальной ферментации NASHAтм (Non-Animal Stabilized Hyaluronic Acid). Этот метод используется при производстве препарата Дьюралан, который применяется в клинической практике с 2002 г. и состоит из полученной биосинтетическим способом стабилизированной ГК, к которой в качестве буфера добавлен нейтральный физиологический раствор хлористого натрия.
Препарат представляет собой стерильный прозрачный, вязкоэластичный гель, поставляемый в стеклянных шприцах объемом 3 мл. В организме Дьюралан распадается тем же путем, что и эндогенная ГК. За счет наличия «легких» поперечных связей ГК лучше стабилизирована, обладает высокой биосовместимостью. Высокая степень чистоты препарата неживотного происхождения делает его безопасным для пациентов, поскольку риск аллергических реакций на животный белок исключен. Дьюралан имеет длительный период полувыведения – 4 недели, период действия в суставе продолжается от 6 до 12 месяцев. NASHA-гель обладает максимально высокой концентрацией ГК. Препарат вводится однократно в сустав, что снижает риск развития инфицирования, связанный с многократными инъекциями.
В сравнительном плацебоконтролируемом исследовании, в которое были включены 347 пациентов с ОА коленных суставов, изучались эффективность и безопасность однократного введения Дьюралана по сравнению с плацебо [24]. Положительным ответом считалось снижение боли минимум на 40% от исходного уровня по шкале WOMAC. Через 6 недель после введения препарата снижение боли было отмечено у 47,4% больных по сравнению с 20,4% в группе плацебо (р < 0,01).
Эффективность и безопасность Дьюралана при ОА коленного сустава была показана в открытом многоцентровом исследовании в 5 центрах в Швеции [25]. 103 пациентам с гонартрозом (128 коленных суставов), средний возраст 50 лет, вводился Дьюралан 3 мл / 60 мг. Продолжительность наблюдения составила 3 месяца. Повторное введение препарата было проведено 53 пациентам (72 коленных сустава). Результаты исследования показали статистически значимое снижение боли после двух инъекций (р < 0,0001). 80% пациентов оценили эффект лечения как «хороший» и «очень хороший» уже после первой инъекции. Побочные реакции в виде локального припухания и легких болей в коленном суставе наблюдались в 5,5% случаев после первой инъекции и в 4,2% случаев после второй.
В сравнительном плацебоконтролируемом исследовании, в которое были включены 347 пациентов с ОА коленных суставов, изучались эффективность и безопасность однократного введения Дьюралана по сравнению с плацебо [24]. Положительным ответом считалось снижение боли минимум на 40% от исходного уровня по шкале WOMAC. Через 6 недель после введения препарата снижение боли было отмечено у 47,4% больных по сравнению с 20,4% в группе плацебо (р < 0,01).
Эффективность и безопасность Дьюралана при ОА коленного сустава была показана в открытом многоцентровом исследовании в 5 центрах в Швеции [25]. 103 пациентам с гонартрозом (128 коленных суставов), средний возраст 50 лет, вводился Дьюралан 3 мл / 60 мг. Продолжительность наблюдения составила 3 месяца. Повторное введение препарата было проведено 53 пациентам (72 коленных сустава). Результаты исследования показали статистически значимое снижение боли после двух инъекций (р < 0,0001). 80% пациентов оценили эффект лечения как «хороший» и «очень хороший» уже после первой инъекции. Побочные реакции в виде локального припухания и легких болей в коленном суставе наблюдались в 5,5% случаев после первой инъекции и в 4,2% случаев после второй.
Клиническая эффективность
Дьюралана была доказана также при ОА тазобедренных суставов в пилотном исследовании, проведенном у 31 пациента [26]. Исходно был зарегистрирован уровень боли не менее 7 по WOMAC, в анамнезе – выраженные боли на протяжении 3 предшествующих месяцев. Положительный ответ оценивался как снижение показателей боли по шкале WOMAC не менее чем на 5 пунктов (40%). Через 3 месяца после внутрисуставного введения Дьюралана у больных отмечалось статистически значимое уменьшение боли, скованности и улучшение функционального состояния суставов. Значительно уменьшилось количество пациентов, оценивавших свое состояние как «плохое» и «очень плохое» (55% в начале исследования и 16% через 3 месяца, р < 0,0001). Через 6–11 месяцев были обследованы 18 больных, у которых был зарегистрирован положительный ответ на терапию. Они жаловались на некоторое усиление болей, что свидетельствует о необходимости регулярных инъекций 1 раз в 6 месяцев. Единственный побочный эффект – усиление боли и скованности в первые дни после инъекции – был отмечен у 9 из 31 пациента.
Ретроспективный анализ результатов ряда РКИ показал: предикторами эффективности лечения можно считать возраст больного не старше 65 лет, отсутствие выпота в суставе на момент начала лечения и наличие II/III стадии ОА, по данным рентгенологического исследования. Мы провели многоцентровое открытое двенадцатимесячное исследование эффективности и безопасности препарата Дьюралан у больных с первичным ОА коленных и тазобедренных суставов (НИИ ревматологии РАМН, ГКБ № 1 г. Москвы, Первый МГМУ им. И.М. Сеченова).
В исследовании участвовали 45 больных обоего пола (35 женщин и 10 мужчин) с ОА коленных и тазобедренных суставов I, II и III стадий по Kellgren-Lawrence, удовлетворяющих критериям Американской коллегии ревматологов, в возрасте 45–70 лет (средний возраст – 60,2 ? 7,4 лет). Боль при ходьбе соответствовала 40 мм и более по визуальной аналоговой шкале (ВАШ); больные регулярно принимали НПВП в течение 30 дней в предшествующие 3 месяца. Информированное согласие пациентов на участие в исследовании было получено.
Критериями исключения были наличие синовитов, остеонекроз суставных поверхностей, внутрисуставное введение любых препаратов в течение предшествующих 6 недель, варусная/вальгусная установка сустава (более 15 градусов), терапия медленнодействующими препаратами для лечения ОА в течение предшествующих 4 месяцев, операции на целевом суставе в анамнезе. Дьюралан вводился однократно в коленный сустав 21 больному (2 мужчин, 19 женщин), в тазобедренный – 24 пациентам (8 мужчин, 16 женщин). Длительность наблюдения составила 12 месяцев, больные осматривались спустя 2, 4, 12, 24 и 48 недель после введения препарата.
Оценка эффективности лечения проводилась по первичной конечной точке – изменение боли в целевом суставе по ВАШ – и по вторичным конечным точкам: динамика суммарного индекса WOMAC, динамика боли, скованности и функциональной активности по WOMAC, изменение суточной потребности в НПВП и общая оценка эффективности лечения больным и врачом (значительное улучшение, улучшение, отсутствие эффекта, ухудшение). Нежелательные явления (НЯ) регистрировались на каждом визите.
Больные с коксартрозом и гонартрозом, включенные в исследование, были сопоставимы по возрасту, давности болезни, индексу массы тела (ИМТ, кг/м?) и боли по ВАШ (табл. 1). У 34 больных имелись различные сопутствующие заболевания, чаще всего определялась артериальная гипертония – у 29 (64%) человек, ИБС – у 7 (15,5%), язвенная болезнь двенадцатиперстной кишки – у 2 (4,4%) больных, сахарный диабет – у 5 (11,0%). Из 45 больных завершили исследование 38 (84%), выбыло 7 пациентов с коксартрозом, 4 больных не явились на последний визит, 1 больному произведено эндопротезирование, у 2 пациентов наблюдались нежелательные явления, не связанные с приемом препарата (инфаркт миокарда через 3 и 9 месяцев после введения Дьюралана).
Уже через 2 недели после введения Дьюралана у больных наблюдалось статистически значимое уменьшение боли, которое сохранялось на протяжении 12 месяцев (рис. 2). При оценке симптома скованности были получены аналогичные результаты (рис. 3). Анализ функционального состояния суставов и суммарного индекса WOMAC (рис. 4) также показал достоверное улучшение, начиная со 2-й недели после введения препарата, которое сохранялось на протяжении всего периода наблюдения. При анализе динамики показателей боли, скованности, функционального состояния суставов и суммарного индекса WOMAC в зависимости от локализации ОА получены сходные результаты, статистических различий между группами не было (рис. 5, 6). Однако следует отметить более быстрое, хотя и не достоверное, уменьшение боли и скованности, а также улучшение функции суставов в группе больных гонартрозом по сравнению с коксартрозом.
Оценки эффективности лечения, проводимые пациентом и врачом, практически не отличались друг от друга. При анализе суммарной эффективности в течение 12 месяцев после однократного введения Дьюралана, улучшение или значительное улучшение было отмечено у 73,5% больных с гонартрозом и у 55,3% больных с коксартрозом (рис. 7). Снижение выраженности основных симптомов ОА позволило постепенно уменьшить потребность в НПВП у больных в обеих группах (табл. 2). Через 3 месяца наблюдения суточная потребность в НПВП сократилась более чем у 65% больных, а к концу исследования – у 40,5% пациентов, 28% больных смогли полностью отказаться от приема НПВП.
Нежелательных явлений (НЯ), связанных с введением Дьюралана в тазобедренные и коленные суставы, не наблюдалось (табл. 3). Таким образом, Дьюралан является эффективным и безопасным препаратом для лечения ОА коленных и тазобедренных суставов. Препарат обладает прекрасной переносимостью. Однократное введение Дьюралана достоверно уменьшает боль, утреннюю скованность и улучшает функциональную активность суставов на протяжении 12 месяцев.
1. Рациональная фармакотерапия ревматических заболеваний: руководство для практикующих врачей / Под ред. В.А. Насо- новой, Е.Л. Насонова. Т. 3. Гл. 12. М.: ЛитТерра, 2003.
2. Jordan K.M., Arden N.K., Doherty M. et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report or a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann. Rheum. Dis. Vol. 62. 2003. № 12. P. 1145–1155.
3. Osteoarthritis: clinical and experimental aspects / Ed. by J.Y. Reginster, J.-P. Pelletier, J. Martel-Pelletier, Y. Henrotin. Berlin: Springer-Verlag, 1999.
4. Lajeunesse D., Massicotte F., Pelletier J.-P., Martel-Pelletier J. Subchondral bone sclerosis in osteoarthritis: not just an innocept bystander // Mod. Rheumatol. Vol. 13. 2003. № 1. P. 7–14.
5. Balazs E.A. The physical properties of synovial fluid and the special role of hyaluronic acid // Helfet A.J. Disorders of the knee (2nd ed.). Philadelphia, Pa: J.B. Lippincott Company, 1983. P. 61–74.
6. Adams M.E. Viscosupplementation as articular therapy // The chemistry, biology, and medical applications of hyaluronan and its derivatives / Ed. by T.C. Laurent. London: Portland Press Ltd., 1998. P. 243–253.
7. Pelletier J.-P., Martel-Pelletier J. The pathophysiology of osteoarthritis and the implication of the use of hyaluronan and hylan as therapeutic agents in viscosupplementation // J. Rheumatol. Vol. 20. 1993. Suppl. 39. P. 19–24.
8. Balazs E.A., Denlinger J.L. Viscosupplementation: a new concept in the treatment of osteoarthritis // J. Rheumatol. Vol. 20. 1993. Suppl. 39. P. 3–9.
9. Hardingham T.E., Muir E. The specific interaction of hyaluronic acid with cartilage proteoglycans // Biochem. Biophys. Acta. 1972. Vol. 279. P. 401–405.
10. Ialenti A., Di Rosa M. Hyaluronic acid modulates acute and chronic inflammation // Agents Actions. 1994. Vol. 43. P. 44–47.
11. Peluso G.F., Perbellini A., Tayana G.F. The effect of high and low molecular weight hyaluronic acid in mytogen-induced lymphocyte proliferation // Curr. Ther. Res. 1990. Vol. 47. P. 437–443.
12. Cortivo R., Gonovi E., De Galateo A., Brun P. Hyaluronate reverses inhibition of proteoglycan synthesis by oxygen free-radicals in cultured chick embryonic cartilage // Eur. J. Cell Biol. Vol. 49. 1989. Suppl. 28. P. 18.
13. Abatangelo G., O’Regan M. Hyaluronan: biological role and function in articular joints // Eur. J. Rheumatol. Inflamm. 1995. Vol. 15. P. 9–16.
14. Tamoto K., Tada M., Shimada S., Nochi H., Mori Y. Effects of high-molecular-weight hyaluronates on the functions of guinea pig polymorphonuclear leukocytes // Semin. Arthritis Rheum. Vol. 22. 1993. № 6. Suppl. 1. P. 4–8.
15. Tobetto K., Yasui T., Ando T., Hayaishi M., Motohashi N., Shinogi M., Mori I. Inhibitory effects of hyaluronan on [14C]arachidonic acid release from labeled human synovial fibroblasts // Jpn J. Pharmacol. Vol. 60. 1992. № 2. P. 79–84.
16. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology subcommittee on osteoarthritis guidelines // Arthritis Rheum. Vol. 43. 2000. № 9. P. 1905–1915.
17. Pendleton R., Arden N., Dougados M. et al. EULAR recommendations for the management of knee osteoarthritis: report of a task force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT) // Ann. Rheum. Dis. Vol. 59. 2000. № 12. P. 936–944.
18. Bellamy N., Campbell J., Welch V., Gee T.L., Bourne R., Wells G.A. Viscosupplementation for the treatment of osteoarthritis of the knee // Cochrane Database Syst. Rev. 2006. № 2. CD005321.
19. Wang C.-T., Lin J., Chang C.-J., Lin Y.-T., Hou S.-M. Therapeutic effects of hyaluronic acid on osteoarthritis of the knee. A meta-analysis of randomized controlled trials // J. Bone Joint Surg. Am. Vol. 86. 2004. № 3. P. 538–545.
20. Goldberg V.M., Buckwalter J.A. Hyaluronans in the treatment of osteoarthritis of the knee: evidence for disease-modifying activity // Osteoarthritis Cartilage. Vol. 13. 2005. № 3. P. 216–224.
21. Lundsgaard C., Dufour N., Fallentin E., Winkel P., Gluud C. Intra-articular sodium hyaluronate 2 mL versus physiological saline 20 mL versus physiological saline 2 mL for painful knee osteoarthritis: a randomized clinical trial // Scand. J. Rheumatol. Vol. 37. 2008. № 2. P. 142–150.
22. Medina J.M., Thomas A., Denegar C.R. Knee osteoarthritis: should your patient opt for hyaluronic acid injection? A meta-analysis of hyaluronic acid’s effects on pain, stiffness, and disability // J. Fam. Pract. Vol. 55. 2006. № 8. 669–675.
23. Divine J.G., Zazulak B.T., Hewett T.E. Viscosupplementation for knee osteoarthritis: a systematic review // Clin. Orthop. Relat. Res. Vol. 455. 2007. № 2. P. 113–122.
24. Altman R.D., Åkermark C., Beaulieu A.D., Schnitzer T. Efficacy and safety of a single intra-articular injection of non-animal stabilized hyaluronic acid (NASHA) in patients with osteoarthritis of the knee // Osteoarthritis and Cartilage. Vol. 12. 2004. № 8. P. 642–649.
25. Åkermark C., Berg P., Björkman A., Malm P. Non-animal stabilised hyaluronic acid in the treatment of osteoarthritis of the knee: a tolerability study // Clin. Drug Invest. Vol. 22. 2002. № 3. P. 157–166.
26. Berg P., Olsson U. Intra-articular injection of non-animal stabilised hyaluronic acid (NASHA) for osteoarthritis of the hip: A pilot study // Clin. Exp. Rheumatol. Vol. 22. 2004. № 3. P. 300–306.
Новости на тему
25.02.2025
14.09.2023
11.08.2023
20.06.2022 12:38:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.