Результаты неоадъювантной химиотерапии рака молочной железы в сочетании с перитуморальным применением фактора некроза опухоли – тимозина альфа-1
- Аннотация
- Статья
- Ссылки
- English

Введение
В структуре заболеваемости злокачественными новообразованиями женского населения как России, так и большинства других стран мира лидирует рак молочной железы (РМЖ). Особое место занимают исходно неоперабельные местно-распространенные формы РМЖ, прогноз которых хуже, чем ранних, операбельных форм заболевания [1]. В России 24,3% всех случаев впервые диагностированного РМЖ составляют местно-распространенные формы, когда выполнение радикальной операции невозможно без предварительного системного лечения, направленного на уменьшение размеров опухоли [2]. В настоящее время таксаны и антибиотики антрациклинового ряда считаются золотым стандартом в предоперационной терапии РМЖ [3].
Одним из современных направлений развития онкологии является изучение роли цитокиновых препаратов в лечении злокачественных новообразований, в том числе РМЖ [4]. Если в основу химиотерапии изначально заложено токсическое воздействие на здоровые и больные клетки, то при иммунотерапии эффект достигается посредством активации собственных защитных механизмов организма. Сочетание химиотерапии с иммунотропными веществами способно значительно снижать токсический и иммуносупрессивный эффект цитостатиков [5]. В этом аспекте интерес представляет рекомбинантный фактор некроза опухоли – тимозин альфа-1 (ФНО-Т) – гибридная молекула двух биологически активных агентов – цитокина фактора некроза опухоли и гормона тимозина. Препарат обладает прямым противоопухолевым действием in vitro и in vivo на различных линиях опухолевых клеток, угнетает ангиогенез в противоположность ФНО-альфа, повышает проницаемость эндотелия сосудов, запускает процесс апоптоза опухолевых клеток, а также активирует каскад химических реакций коагуляционной системы крови [6]. Возможно усиление противоопухолевой эффективности цитостатиков при проведении комплексной терапии с ФНО-альфа [7]. Благодаря входящему в состав ФНО-Т тимозину альфа-1 препарат способен оказывать стимулирующее воздействие на Т-клеточное звено иммунной системы, наиболее значимое для противоопухолевого иммунитета, а также участвует в реакциях гуморального иммунитета [6].
Не вызывает сомнений важность неоангиогенеза в развитии раковых опухолей. Экспрессия фактора роста эндотелия сосудов в злокачественных опухолях молочной железы связана с неблагоприятным прогнозом [8], а подавление ангиогенеза ведет к торможению опухолевого роста и развития метастазов. Как известно, развитие и рост злокачественной опухоли обусловлены ее способностью продуцировать ангиогенные факторы, стимулирующие неоваскуляризацию [9]. В ряде исследований были получены морфологические доказательства эффективности аутобиотерапии (аутогемо- и аутоплазмохимиотерапии) с помощью определения микрососудистой плотности раковой опухоли молочной железы [10, 11]. В настоящее время представляет интерес изучение новых препаратов, способных влиять на неоангиогенез в опухоли и локальный противоопухолевый иммунитет.
Вместо стандартного подкожного метода введения препарата нами было предложено вводить рекомбинантный ФНО-Т перитуморально. Проанализировав механизмы действия препарата, мы предполагали получить более выраженный эффект за счет максимального воздействия непосредственно на зону опухоли и перитуморальной ткани.
Материал и методы исследования
Основные критерии включения больных в исследование: гистологически верифицированный РМЖ, степень распространения онкологического процесса T14N02M0, удовлетворительная функция печени, почек, костного мозга, отсутствие отдаленных метастазов, ECOG ≤ 1, возраст старше 18 лет. В исследовании участвовали 82 больных в возрасте от 29 до 69 лет (средний возраст – 53,3 ± 1,1 года). Существенных различий в возрасте, степени распространения заболевания, спектре сопутствующей патологии, гистологическом и иммуногистохимическом типе не наблюдалось. У 41,8% пациенток менструальная функция была сохранной, у 61,2% наступила менопауза. Люминальный В (HER2+/-) тип РМЖ наблюдался в 61,6% случаев, HER2-гиперэкспрессирующий тип – в 24,8%, тройной негативный и люминальный А типы РМЖ – в 9,8%.
Пациентки были рандомизированы на две группы – основную и контрольную. В основную вошли 30 пациенток, которым ФНО-Т вводили перитуморально по 200 000 МЕ в первые сутки (за 30 минут до введения цитостатиков) и далее один раз в день на вторые – пятые сутки каждого цикла химиотерапии (ХТ). Для неоадъювантной ХТ в обеих группах применяли режимы FAC (5-фторурацил 500 мг/м2, доксорубицин 50 мг/м2, циклофосфан 500 мг/м2, интервал 21 день) или РА (паклитаксел 175 мг/м2, доксорубицин 50 мг/м2, интервал 21 день).
Непосредственный противоопухолевый эффект оценивали по критериям RECIST 1.0, побочные токсичные эффекты ХТ – по критериям CТC АЕ 3.0.
Для оценки ангиогенеза в опухолях использовали индекс внутриопухолевой микрососудистой плотности (intratumor microvessel density – MVD), который позволяет количественно оценить процесс ангиогенеза в опухоли и определяется стандартным иммуногистохимическим методом с использованием эндотелиальных антител. Микрососуды окрашивали антителами CD34, CD31, VEGF (vascular endothelial growth factor) и EGFR (epidermal growth factor receptor). Количество сосудов определяли в каждом поле зрения препарата.
CD34 является общим эндотелиальным маркером и предоставляет информацию обо всех сосудах в ткани опухоли – предсуществующих и новообразованных [12]. CD31 – член семейства молекул адгезии поверхностных гликопротеинов, вовлеченный в межклеточные взаимодействия, процессы эмбриогенеза и развития тканей. Маркеры CD34 и CD31 традиционно используются для выявления именно кровеносных сосудов и оценки их плотности в ткани [13].
Среди разнообразных специфических и неспецифических регуляторов ангиогенеза ведущая роль, безусловно, принадлежит VEGF – фактору роста эндотелия сосудов. Он стимулирует неоангиогенез в опухолях, участвует в поддержании микрососудистой сети опухоли, препятствуя апоптозу незрелых эндотелиоцитов, тормозит нормальный ответ на опухоль иммунной системы, подавляя созревание дендритных клеток. Для сравнения использовали гистологический материал, полученный при трепанбиопсии опухоли до лечения, и послеоперационный материал.
Статистическую обработку данных проводили с использованием пакета программ Statistica 10.0.
Результаты и их обсуждение
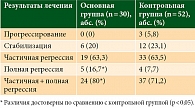
Результаты непосредственного противоопухолевого эффекта проводимой терапии представлены в табл. 1.
Процент достижения объективного ответа в виде частичного и полного регресса опухоли и лимфоузлов в основной группе был выше, чем в контрольной, – 80 против 71,7 (p < 0,05). Достижение полного регресса опухоли в основной группе достигалось в 2,2 раза чаще, чем в контрольной (16,6 и 7,7% соответственно, p < 0,05). У 5,8% пациенток контрольной группы на фоне неоадъювантного лечения отмечалось прогрессирование злокачественного процесса, что не позволило провести хирургическое вмешательство. Случаев прогрессирования заболевания в основной группе не наблюдалось, что было подтверждено рентгенологически [14].
В основной группе удалось добиться операбельного состояния у всех больных, применив не более четырех курсов неоадъювантной ХТ в комбинации с рекомбинантным ФНО-Т. В то же время 24% пациенток контрольной группы потребовалась более длительная неоадъювантная ХТ – до пяти-шести курсов. Достоверных различий по имеющимся осложнениям после проведенной ХТ в группах не выявлено.
В основной и контрольной группах зарегистрированы побочные эффекты низкой и средней степени выраженности. Из клинически значимых осложнений чаще отмечались нейтропения 2–3-й степени – 18–20% циклов, анемия 1–2-й степени – 4%, диспепсия 1–2-й степени – 26–27%, сенсорная полинейропатия 1–2-й степени – 13–14% (при ХТ по схеме РА). Местная реакция на перитуморальное введение ФНО-Т возникала через 6–12 часов у всех больных основной группы в виде очага гиперемии 0–1-й степени, слегка болезненного, без инфильтрации, а ее продолжительность варьировалась в пределах 24–48 часов. У четырех (16%) пациенток отмечалась гипертермия 1–2-й степени через 6–12 часов после введения препаратов со снижением до нормальной температуры в течение 24 часов без применения жаропонижающих средств.
Патоморфоз опухоли под действием цитостатиков является важнейшим показателем эффективности лечения. У больных с полным патоморфологическим эффектом статистически выше показатели пяти- и десятилетней общей и беспрогрессивной выживаемости [15]. Согласно классификации выделяют четыре степени лечебного патоморфоза РМЖ [16].
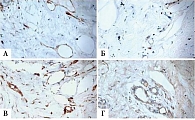
По результатам морфологического исследования опухолевой ткани и перитуморальной ткани больных основной группы в опухоли под действием ХТ в комбинации с перитуморальным введением рекомбинантного ФНО-Т были выявлены изменения, соответствовавшие 3–4-й степени лечебного патоморфоза (рис. 1).
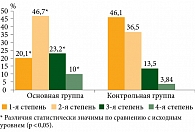
В основной группе на фоне применения комбинации цитостатиков и иммунного препарата отмечалось статистически достоверное увеличение числа лечебного патоморфоза 3–4-й степени по сравнению с контрольной группой – десять (33,2%) и девять (17,34%) случаев соответственно (p < 0,05) (рис. 2) [17, 18].
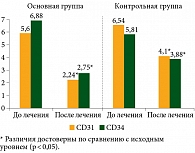
После проведенной ХТ в сочетании с рекомбинантным ФНО-Т в ткани опухоли молочной железы было обнаружено, что микроциркуляторная плотность в поле зрения для CD31 снижалась с 5,9 ± 0,34 в трепанбиоптатах до 2,24 ± 0,35 в операционном материале (p < 0,05), для CD34 – с 6,88 ± 1,07 до 2,75 ± 0,72 соответственно (p < 0,05). В контрольной группе микрососудистая плотность составила для CD31 9,54 ± 0,89 в трепанбиоптатах и 5,1 ± 0,59 в операционном материале (p < 0,05), для CD34 – 8,2 ± 0,52 и 4,08 ± 0,41 соответственно (p < 0,05) (рис. 3).
При морфологическом исследовании образцов тканей больных основной группы в трепанбиоптатах по сравнению с операционным материалом процент VEGF, EGFR был выше (табл. 2).
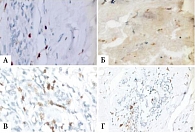
На рис. 4 показано уменьшение плотности микрососудов в опухоли на фоне терапии комбинацией химиопрепаратов и ФНО-Т.
В биоптатах опухолей в отсутствие лечения отмечалось преобладание среди иммунокомпетентных клеток, присутствовавших в опухоли, CD4+-лимфоцитов над CD8+- и CD3+-клетками. В-лимфоциты были обнаружены в виде единичных клеток и немногочисленных скоплений. CD4+- и CD3+-лимфоциты определялись в виде скоплений. Инфильтрация CD8+-лимфоцитами опухолевой ткани представлена одиночно расположенными клетками.
Результаты исследования операционного материала у больных основной группы с выявленной 2-й степенью патоморфоза в лимфоидном инфильтрате показали преобладание CD8+-клеток. Уровень CD4+-лимфоцитов существенно не менялся. Данное обстоятельство свидетельствовало о достаточно высоком уровне локального иммунного ответа на опухоль. У пациенток основной группы с 3–4-й степенью патоморфоза опухоли под действием ХТ и рекомбинантного ФНО-Т, введенного перитуморально, лимфоцитарная инфильтрация была слабо выражена, почти отсутствовала. В наблюдениях с сохраненной опухолевой тканью определялась лимфоцитарная инфильтрация различной степени выраженности (рис. 5).
Все пациентки основной группы были прооперированы. Послеоперационных осложнений, связанных с использованием рекомбинантного ФНО-Т, не зафиксировано. Медиана наблюдения в основной группе составила 35,6 ± 1,2 месяца, в группе сравнения – 34,1 ± 1,1 месяца. Медиана выживаемости в обеих группах не достигнута. Тем не менее имело место достоверное увеличение показателей трехлетней безрецидивной выживаемости на 20% (с 63% в контрольной группе до 83% в основной при включении в схему лечения ФНО-Т), логарифмический ранговый критерий 0,0477. Достоверных различий в общей выживаемости между группами к настоящему времени не выявлено.
Заключение
Результаты проведенного исследования отражают достоверное увеличение эффективности неоадъювантной лекарственной терапии больных РМЖ IIB–IIIB стадии при перитуморальном применении рекомбинантного ФНО-Т. Рост частоты достижения объективного противоопухолевого эффекта обусловлен увеличением случаев полного регресса опухоли. Препарат обладает удовлетворительной переносимостью, не влияет на частоту и степень выраженности системных побочных реакций. Местные побочные реакции клинически незначимы и купируются самостоятельно.
Применение данной методики позволяет сократить сроки предоперационной терапии, достигнуть увеличения числа наблюдений лечебного патоморфоза 3–4-й степени, увеличить трехлетнюю безрецидивную выживаемость на 20%. Одним из возможных механизмов подобного эффекта является угнетение ангиогенеза в опухоли, проявляющегося снижением числа микрососудов в опухоли. Проведенное исследование выявило также активацию локального противоопухолевого иммунитета.
L.Yu. Vladimirova, N.A. Podzorova, Ye.M. Nepomnyaschaya, I.A. Novikova, Ye.P. Ulyanova
Rostov Research Institute of Oncology
Contact person: Lubov Yuryevna Vladimirova, lubovurievna@gmail.com
The article covers the results of clinical application of a domestic drug based on recombinant tumor necrosis factor – thymosin alpha-1 (TNF-T) combined with chemotherapy FAC and РА during neoadjuvant treatment of patients with breast cancer IIB–IIIB stage. In contrast to the standard subcutaneous application method, the authors proposed peritumoral administration of TNF-T to maximize the drug’s action directly on the tumor, peritumoral tissue. TNF-T 200000 IU peritumorally on days 1–5 of each treatment course during chemotherapy showed significant increase in objective effect rate, including increase in frequency of complete regressions, and decrease in frequency and intensity of chemotherapy complications. Morphological examination revealed an increase rate of medical pathomorphosis grade 3–4, decreased number of microvessels in tumor in comparison with primary tumors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.