Роль физических упражнений в комплексном лечении диабетической кардиомиопатии
- Аннотация
- Статья
- Ссылки
- English
Распространенность сахарного диабета (СД) из года в год увеличивается. В настоящее время она достигла масштабов эпидемии. Так, согласно данным экспертов Международной федерации диабета, в 2017 г. в мире насчитывалось 425 млн больных. К 2045 г. ожидается прирост заболеваемости на 48%, то есть число страдающих СД может достичь 629 млн [1].
Сахарный диабет ассоциируется с развитием ряда заболеваний, прежде всего сердечно-сосудистых. Так, на долю сердечной недостаточности приходится до 70% случаев.
У пациентов с диабетом в отличие от лиц без нарушений углеводного обмена риск развития сердечно-сосудистых заболеваний выше в два – пять раз. Таковые обусловлены прежде всего атеросклерозом. Течение сердечно-сосудистой патологии осложняется вследствие артериальной гипертензии, дислипидемии, активации нейрогормональных и воспалительных механизмов [2].
Кроме того, сердечно-сосудистые заболевания являются основной причиной смерти больных СД.
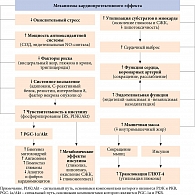
В клинических и экспериментальных исследованиях доказано положительное влияние физических упражнений на сердечно-сосудистую систему при сахарном диабете. Установлено, что их кардиопротективный эффект реализуется за счет ряда молекулярных механизмов (рис. 1) [3, 4]. В результате физических нагрузок улучшается метаболизм глюкозы, повышается чувствительность клеток к инсулину, на фоне снижения массы тела улучшаются показатели кардиореспираторной функции [5, 6].
У пациентов с СД 2 типа физическая активность помимо снижения риска развития сердечно-сосудистых заболеваний способствует уменьшению риска общей и сердечно-сосудистой смерти [7, 8]. При этом указанный эффект зависит от интенсивности упражнений. Так, G. Hu и соавт. доказали, что физическая активность среднего и высокого уровня способствовала снижению риска общей и сердечно-сосудистой смерти независимо от показателей индекса массы тела, артериального давления, общего холестерина и факта курения [9]. Важна также продолжительность нагрузок. J. Karjalainen и соавт. выявили отрицательную зависимость между физической активностью и ближайшим сердечно-сосудистым событием. Тем не менее тренировки в домашних условиях имели незначительное влияние на профиль риска развития сердечно-сосудистых заболеваний у пациентов с ишемической болезнью сердца и СД 2 типа [10].
Доказано, что для достижения значимого эффекта необходимы регулярные аэробные нагрузки средней интенсивности не менее 150 минут в неделю или высокой интенсивности не менее 75 минут в неделю [11].
Диабетическая кардиомиопатия: признаки и патогенез
У многих пациентов с СД развивается диабетическая кардиомиопатия (ДКМП). Для заболевания характерно наличие структурно-функциональных изменений миокарда в отсутствие атеросклероза коронарных артерий, явной ишемической болезни сердца и клапанной патологии [12].
Патогенез ДКМП многофакторный: изменение метаболизма миокарда (нарушение энергетического и кальциевого обмена, функции митохондрий), усиление окислительного стресса, развитие фиброза миокарда, повышение апоптоза и нарушение микроциркуляции. Сначала возникает диастолическая дисфункция, далее нарушается сократительная функция миокарда с развитием клинически значимой сердечной недостаточности [13].
Влияние физических нагрузок на патогенетические механизмы
Метаболизм кардиомиоцитов
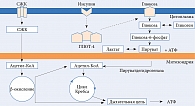
Основными энергетическими субстратами в миокарде являются глюкоза и свободные жирные кислоты (СЖК). Глюкоза проникает в цитоплазму кардиомиоцита с помощью глюкозного транспортера 4 (ГЛЮТ-4). В результате гликолиза образуется пируват, который при участии пируватдегидрогеназы перемещается в матрикс митохондрий и окисляется до ацетил-коэнзима А (ацетил-КоА). В митохондриях происходит β-окисление жирных кислот с образованием ацетил-КоА. Восстановленные в ходе цикла Кребса формы никотинамидадениндинуклеотида 2 и окисленного флавинадениндинуклеотида 2 поступают в дыхательную цепь с последующим синтезом аденозинтрифосфата (АТФ). Таким образом, на уровне митохондрий глюкоза и СЖК конкурируют при образовании ацетил-КоА (рис. 2).
При сахарном диабете энергетический обмен в миокарде нарушается, за счет усиления β-окисления жирных кислот уменьшается скорость окисления глюкозы. Кроме того, снижаются экспрессия и транслокация инсулинзависимого переносчика глюкозы ГЛЮТ-4. Как следствие, снижается транспорт глюкозы в кардиомиоциты и подавляется гликолиз, энергия которого используется ионными насосами.
Одним из основных маркеров ДКМП является нарушение внутриклеточного гомеостаза кальция (Са). Дефицит гликолитической фракции АТФ обусловливает снижение активности Са2+-АТФазы саркоплазматического ретикулума (SERCA2a) и увеличение концентрации ионов Са в цитозоле. В результате диастолическая функция сердца нарушается и повышается ригидность миокарда. Это может вызвать ухудшение микроциркуляции и необратимое повреждение кардиомиоцитов [14].
Согласно результатам исследований, умеренные физические нагрузки могут усиливать экспрессию ГЛЮТ-4, а также увеличивать транспорт глюкозы и активировать пируватдегидрогеназу, которая играет ключевую роль в выборе энергетических субстратов для миокарда [15]. Физические упражнения способны улучшать экспрессию и активность SERCA2a. Это достигается регулированием высвобождения и повторного захвата Са2+ саркоплазматическим ретикулумом. В результате улучшается диастолическая функция сердца [16].
Функция митохондрий
Митохондрии признаны центром энергетического обмена. Поэтому их дисфункция может играть решающую роль в патогенезе ДКМП. Так, при ДКМП в миокарде отмечаются снижение плотности митохондрий, их отек и разрушение, увеличение митохондриального матрикса [17].
Умеренные нагрузки препятствуют развитию дисфункции митохондрий путем увеличения в клетке количества 1-α-коактиватора γ-рецептора, активируемого пролифераторами пероксисом (PGC-1α). PGC-1α стимулирует экспрессию ряда факторов транскрипции, активирующих гены ядерного и митохондриального генома. Они необходимы для биосинтеза митохондрий [18].
Кроме того, механизмы, с помощью которых физические упражнения способны улучшить функцию митохондрий, могут быть связаны с регуляцией уровня Са2+. Последний является ключевым активатором ферментов в митохондриях [16, 19].
Упражнения с отягощением улучшают работу сердца и функцию митохондрий, что сопровождается повышением экспрессии белков биогенеза митохондрий, таких как PGC-1α и транскрипционный фактор A митохондрий [20].
Окислительный стресс
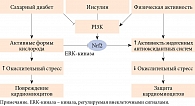
Окислительный стресс считается ключевым звеном в развитии ДКМП. В физиологических условиях в организме поддерживается баланс между активными формами кислорода (АФК) и свободными радикалами. Фосфатидилинозитол-3-киназа (PI3K) фосфорилирует фактор транскрипции – ядерный респираторный фактор 2 (Nrf2), который играет важную роль в регуляции экспрессии генов антиоксидантных ферментов.
В условиях гипергликемии повышается продукция активных форм кислорода и одновременно снижается активность антиоксидантных систем, что ведет к накоплению свободных радикалов и повреждению кардиомиоцитов (рис. 3).
К основным механизмам, с помощью которых физические упражнения приводят к уменьшению окислительного стресса, относятся [21]:
- снижение выработки АФК в организме за счет снижения активности восстановленной никотинамидадениндинуклеотидфосфат-оксидазы;
- усиление экспрессии NO-синтазы и повышение уровня оксида азота и, как следствие, повышение антиоксидантной функции эндотелия.
Установлено, что физические нагрузки приводят к активации Nrf2, который регулирует экспрессию естественных антиоксидантов. Таким образом обеспечивается защита клеток от АФК [22, 23]. При длительных аэробных нагрузках низкой интенсивности повышенный уровень малонового диальдегида в миокарде снижается и увеличивается активность антиоксидантных систем, таких как супероксиддисмутаза (СОД), глутатионпероксидаза и каталаза [24]. Кроме того, доказано влияние физических упражнений на уровни ингибитора активатора плазминогена 1 и эндотелиальной NO-синтазы [25].
Апоптоз кардиомиоцитов
Апоптоз кардиомиоцитов, индуцированный сахарным диабетом, является отличительной чертой ДКМП.
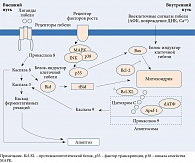
В настоящее время выделяют два механизма запуска гибели клеток: внутренний (митохондриальный) и внешний (рецепторный) (рис. 4). При внутреннем – изменяется баланс митохондриальных противоапоптотических (белка В-клеточной лимфомы 2 (Bcl-2)) и апоптотических (Bax, Bid) факторов, что приводит к открытию пор на наружной мембране митохондрий и выходу цитохрома С в цитоплазму.
Внешний механизм апоптоза заключается в активации каспазы 8, которая напрямую связывает рецепторы клеточной гибели с другими каспазами. Например, каспаза 8 расщепляет белок Bid. Его С-фрагмент (tBid) перемещается в митохондрии и активирует протеин Bax, стимулируя выброс апоптогена.
Высвободившийся цитохром C соединяется с апоптоз-активирующим фактором 1 (Apaf-1) и биотинилированной аденозинтрифосфорной кислотой (dATФ). Это запускает олигомеризацию Apaf-1 и активацию прокаспазы 9. Активированная каспаза 9 переводит прокаспазу 3 в активный фермент. В результате запускается каскад реакций, ведущих к апоптозу.
В индукции апоптоза участвуют также митоген-активируемые протеинкиназы (MAPK), в частности c-Jun N-терминальная киназа (JNK), которая активирует каспазу 8 и клеточный белок Bax. Это стимулирует выход цитохрома С из митохондрий и, как следствие, апоптоз [26].
В условиях гипергликемии избыточное образование АФК может приводить к высвобождению цитохрома С в цитоплазму за счет повышения экспрессии Bax и повреждения структуры митохондрий, что вызывает активацию каспазы 3 и гибель кардиомиоцитов. Этот процесс играет важную роль в гипертрофии и ремоделировании миокарда, а также в развитии сердечной недостаточности.
S. Veeranki и соавт. установили, что физические упражнения уменьшают высвобождение цитохрома С в цитоплазму за счет увеличения митохондриального трансмембранного потенциала. Таким образом предотвращается апоптоз кардиомиоцитов [27]. В ряде исследований, в которых моделировали ожирение у животных, физические нагрузки приводили к снижению фосфорилирования JNK, то есть блокировался один из сигнальных путей гибели клетки. Согласно данным М. Kanter и соавт., физические нагрузки низкой интенсивности вызывают торможение апоптоза кардиомиоцитов, улучшают морфологические и биохимические показатели миокарда [24].
В исследовании, проведенном S. Khakdan и соавт., интервальные тренировки высокой интенсивности привели к значительному увеличению экспрессии сиртуина 1 (SIR1) и Bcl-2 у животных с СД [28]. По-видимому, физические нагрузки высокой интенсивности защищают миокард, способствуя блокаде стресс-индуцированного апоптоза эндоплазматического ретикулума [25].
Физические упражнения и проявления заболевания
Фиброз миокарда
Фиброз миокарда – гистологическое проявление ДКМП. Отложение коллагена в клетках миокарда, интерстициальный и периваскулярный фиброз в конечном итоге вызывают нарушение структуры и функции сердца [29].
Результаты многочисленных исследований свидетельствуют, что умеренные физические нагрузки могут снизить уровень глюкозы в крови, уменьшить фиброз миокарда, способствовать обратному ремоделированию сердечной мышцы и улучшить функцию сердца [29]. В качестве механизма уменьшения фиброза миокарда указано снижение перегрузки давлением вследствие его нормализации [29]. На фоне физических упражнений увеличивается содержание матриксной металлопротеиназы 2, которая участвует в разрушении коллагена и ингибирует фиброз в миокарде [30]. В условиях гипергликемии происходит гликирование коллагена с образованием конечных продуктов гликирования. Последние повышают жесткость сосудов сердца и усиливают эндотелиальную дисфункцию [31].
К механизмам, с помощью которых физические упражнения могут уменьшить фиброз миокарда, также следует отнести улучшение энергетического обмена, снижение уровня глюкозы в крови и отложения гликогена в миокарде [32].
U. Novoa и соавт. доказали, что интенсивная регулярная физическая нагрузка оказывает положительное влияние на ремоделирование сердца, о чем свидетельствуют снижение гипертрофии миоцитов, уменьшение отложения коллагена и фиброза миокарда [33].
Микрососудистые нарушения
Нарушение микроциркуляции является одним из патологических изменений при ДКМП. Гипергликемия обусловливает изменение структур эндотелия и развитие эндотелиальной дисфункции. Повышается продукция факторов, способствующих ангиоспазму, нарушению проницаемости сосудистой стенки, гиперкоагуляции, тромбообразованию, миграции и пролиферации гладкомышечных клеток, активации провоспалительных факторов. В результате нарушаются кровоснабжение миокарда и его функции.
В настоящее время установлены два механизма протективного воздействия физических нагрузок на микрососудистое русло:
- повышение экспрессии эндотелиальной NO-синтазы и продукции оксида азота, что улучшает релаксацию миокарда и диастолическую функцию, а также повышает перфузию тканей [31];
- усиление внутриклеточных инсулин-зависимых сигнальных каскадов. Инсулин при посредничестве субстрата инсулинового рецептора 1 активирует PI3K, которая участвует в активации протеинкиназы В (PKB). Этот механизм опосредует инсулин-стимулированную продукцию оксида азота, независимую от активности NO-синтазы. В свою очередь инсулин через MAPK-сигнальный путь стимулирует выработку вазоконстриктора эндотелина 1. Таким образом, физическая активность поддерживает баланс между сосудорасширяющими и вазоконстрикторными свойствами эндотелия. Благодаря этому обеспечивается нормальная вазомоторная функция [34].
Заключение
Физические упражнения оказывают кардиопротективное воздействие у больных с диабетической кардиомиопатией. Под влиянием физических нагрузок улучшается энергетический метаболизм в миокарде, нормализуется обмен кальция, снижается окислительный стресс, скорость апоптоза кардиомиоцитов и выраженность фиброза, улучшается микроциркуляция. Поэтому регулярные тренировки являются важным немедикаментозным методом снижения сердечно-сосудистого риска.
Выявление молекулярных механизмов, лежащих в основе указанных выше эффектов физических упражнений, имеет большое значение для разработки новых терапевтических стратегий.
O.A. Shatskaya, PhD, I.Z. Bondarenko, DM, K.A. Popov, S.S. Kukharenko, PhD
National Medical Research Center for Endocrinology
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Olga Aleksandrovna Shatskaya, shatskaya@bk.ru
The main pathophysiological factors of diabetic cardiomyopathy are considered. Provided the data on the mechanisms of physical activity influence on cardiomyocyte metabolism, mitochondrial function, oxidative stress, cardiomyocyte apoptosis, myocardial fibrosis and microvascular disorders and its effects.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.