Роль глицирризиновой кислоты в патогенезе псориатической болезни
- Аннотация
- Статья
- Ссылки
- English
Введение
Псориаз остается актуальной и сложной проблемой современной дерматологии, что обусловлено высокой распространенностью в популяции, значительной долей в структуре дерматологических заболеваний и отсутствием единой этиопатогенетической концепции.
В последнее время утвердилось мнение о взаимосвязи кожных проявлений псориаза и поражений других органов, в связи с чем в научной литературе все чаще применяется термин «псориатическая болезнь» [1].
Важное значение в поддержании и рецидивировании дерматоза отводят нарушениям гепатобилиарной системы, поскольку патология печени и желчевыводящих путей может инициировать и усилить выраженность эндотоксикоза, воспаления, иммунный дисбаланс, обусловить нарушение процессов регенерации в организме в целом и коже в частности [2, 3].
Однако данные о частоте нарушений гепатобилиарной системы при разных формах заболевания, клинических, лабораторных и инструментальных особенностях гепатопатий и о состоянии печени и желчевыводящих путей у пациентов с различными формами псориаза противоречивы, а унифицированные алгоритмы диагностики таких нарушений отсутствуют [4, 5].
Псориаз и заболевания печени: факторы развития и взаимообусловленность
Установлена общность факторов, обусловливающих риск развития псориаза и заболеваний печени. Так, у пациентов с псориазом чаще, чем у здоровых лиц, отмечаются ожирение, гиперлипидемия, метаболический синдром. Эти же факторы способствуют развитию неалкогольной жировой болезни печени (НАЖБП). Доказано также, что злоупотребление алкоголем повышает вероятность развития не только алкогольной болезни печени (АБП), но и псориаза, в частности его тяжелых форм [4, 6–8].
Кроме того, показано, что псориаз является независимым фактором развития НАЖБП, риск развития последней увеличивается на 70%, ее тяжелых форм – на 60% [9]. Псориаз также считается дополнительным фактором развития АБП [10].
При сочетанном течении псориаза и НАЖБП, АБП более быстро прогрессирует фиброз и заболевания печени чаще достигают стадии цирроза [10, 11]. Получены данные о повышении смертности среди больных псориазом от цирроза печени [12]. У пациентов с НАЖБП и псориазом чаще развивается псориатический артрит [13], а потребление алкоголя, обусловливающего развитие АБП, способствует более тяжелому течению и ухудшению прогноза псориаза [14].
Результаты исследований ферментативной активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), гамма-глутаминтранспептидазы (ГГТ), лактатдегидрогеназы, монооксигеназной системы не выявили каких-либо специфичных изменений у таких пациентов. Достоверные изменения функции печени наблюдались только при тяжелых, торпидных и осложненных формах псориаза [15, 16].
Патогенетическое обоснование коморбидности
Анализ литературы свидетельствует об общих звеньях патогенеза псориаза и НАЖБП/АБП. Ключевую роль играют воспалительный процесс и выработка провоспалительных цитокинов, в частности интерлейкинов (IL) 1 и 6, и фактора некроза опухоли альфа (TNF-α).
При псориазе IL-1 стимулирует экспрессию молекул адгезии на поверхности эндотелиальных клеток, пролиферацию кератиноцитов и выработку провоспалительных цитокинов [17]. IL-6 способствует миграции Т-клеток в эпидермис, росту и дифференцировке дермальных и эпидермальных клеток [18]. TNF-α стимулирует пролиферацию кератиноцитов, продукцию провоспалительных цитокинов, ангиогенез и экспрессию молекул адгезии [19].
IL-6 при НАЖБП участвует в формировании инсулинорезистентности [20], а IL-1 и TNF-α – в развитии и прогрессировании воспалительного процесса в паренхиме печени [21–23]. Указанные цитокины способствуют развитию воспаления и при АБП [24].
Еще одним аргументом в пользу единого патогенеза является повышенный уровень IL-1 и IL-6, TNF-α, выявляемый как при псориазе, так и при НАЖБП и АБП [11, 14].
Глицирризиновая кислота и псориаз
Сказанное выше свидетельствует о том, что комплексная терапия больных псориазом, имеющих признаки поражения гепатобилиарной системы, должна включать лекарственные препараты с гепатопротективным действием.
Учитывая проблему полипрагмазии, необходимо найти препарат, терапевтическими мишенями которого являются звенья патогенеза как псориаза, так и заболеваний печени. В этом отношении представляют интерес препараты глицирризиновой кислоты.
В экспериментальных исследованиях продемонстрирована способность глицирризиновой кислоты подавлять продукцию IL-1 [25], IL-6 [26] и TNF-α [27]. Кроме того, она характеризуется псевдоглюкокортикостероидной активностью, обусловленной ингибированием 11-бета-оксистероиддегидрогеназы [28], а топические глюкокортикостероиды – наиболее часто применяемый при псориазе класс препаратов.
Эффективность и благоприятный профиль безопасности глицирризиновой кислоты (препарата Фосфоглив (глицирризиновая кислота + фосфолипиды)) изучались в рандомизированных клинических исследованиях при НАЖБП [29], АБП [30], а также в качестве патогенетической терапии у пациентов с хроническим гепатитом С [31], которые не могли получать противовирусные препараты. Полученные результаты позволили включить данную фиксированную комбинацию в клинические рекомендации и стандарты оказания медицинской помощи.
Кроме того, было проведено несколько небольших исследований, доказавших положительное влияние Фосфоглива не только на состояние печени, но и на течение псориаза [32, 33].
Все это послужило основанием для более детального изучения потенциала препарата Фосфоглив у больных псориазом.
Результаты собственных исследований
Авторами проведено эпидемиологическое исследование распространенности заболеваний печени и их структуры у пациентов с псориазом и биоинформационное исследование влияния глицирризиновой кислоты на псориатический процесс.
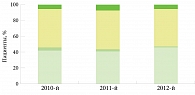
По данным Московского научно-практического центра дерматовенерологии и косметологии, филиал «Клиника им. В.Г. Короленко», в 2010 г. лечение по поводу псориаза проходили 510 пациентов: из них 259 мужчин и 251 женщина, в 2011 г. – 515: из них 390 мужчин и 125 женщин, в 2012 г. – 563 пациента: из них 340 мужчин и 223 женщины. Распределение больных по формам псориаза представлено на рис. 1.
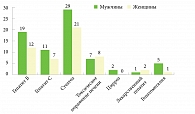
За 2014 г. в филиале «Вешняковский» стационарно лечились 708 пациентов, из них 411 мужчин и 297 женщин. Заболевания печени (гепатит В и С, жировой гепатоз, токсические гепатиты) наблюдались у 74 мужчин и 51 женщины (рис. 2).
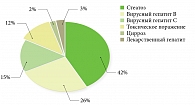
В структуре установленных диагнозов заболеваний печени у пациентов с псориазом преобладали стеатоз и вирусные гепатиты, что отражает тенденцию, характерную для популяции (рис. 3).
Уровень АЛТ оказался повышенным у 119 (28,9%) мужчин и 73 (24,5%) женщин, АСТ – у 124 (30,1%) и 76 (25,6%), ГГТ – у 140 (34,06%) и 69 (23,2%), холестерин – у 93 (22,6%) и 86 (28,9%), билирубин – у 73 (17,76%) мужчин и 66 (22,22%) женщин соответственно. При этом у трети пациентов отмечались изменения по двум или трем показателям.
У 42,7% мужчин и 29,6% женщин с измененными биохимическими показателями диагноз в отношении заболевания печени поставлен не был.
Полученные результаты подтверждают целесообразность применения гепатопротекторов при псориазе.
В связи с актуальностью гепатопротекторов, способных воздействовать не только на гепатобилиарную систему, но и на воспалительные процессы при псориазе, представляется целесообразным применение препарата Фосфоглив. Действие его активных компонентов при поражении гепатоцитов хорошо изучено, в то время как влияние глицирризиновой кислоты на течение псориаза представляет несомненный научный и практический интерес.
С этой целью было проведено биоинформационное исследование с использованием реферативной базы данных ResNet и программы Pathway Studio (компания Ariadne Genomics Inc., США). База данных ResNet содержит аннотации биологических объектов, в том числе клеточных процессов и малых молекул, а также аннотации функциональных связей между ними, сформированные при обработке текстового массива полнотекстовых статей и абстрактов, индексированных в Medline.
Значимость объединенных общей функцией процессов и малых молекул оценивалась по тому, насколько пересечение их множества, приписанного к данной категории, превышало ожидаемый размер. Гипергеометрическое распределение использовали в качестве модели случайного пересечения множеств.
При помощи программы Pathway Studio производилось распределение процессов по приоритетам: чем меньше значение p, тем выше вероятность, что процессы, относящиеся к заболеванию, включены туда неслучайно.
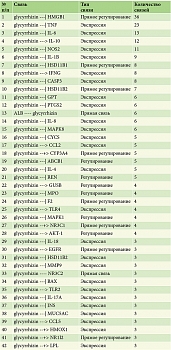
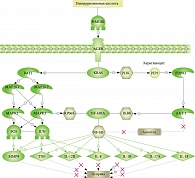
Согласно анализу литературы, 164 белка достоверно регулируются глицирризиновой кислотой. Из них были отобраны белки с большим количеством ссылок. Наиболее релевантными по количеству связей являются только 42 белка (см. таблицу). Первое место среди них занимает HMGB1.
HMGB1 (амфотерин) – белок группы ядерных негистоновых белков HMG. Он взаимодействует с ДНК ядра клетки и играет важную роль в развитии воспаления. HMGB1 как цитокиновый медиатор секретируется активированными макрофагами и моноцитами и, будучи ядерным белком, может высвобождаться при некрозе клеток и тканей. После высвобождения HMGB1 может связываться с рецептором врожденного иммунитета TLR4, что приводит к секреции цитокинов макрофагами и последующей воспалительной реакции.
Помимо ингибирования HMGB1 глицирризиновая кислота угнетает продукцию провоспалительных цитокинов: TNF-α, IL-6, IL-8, IL-1 и др.
Подавляющее большинство белков (см. таблицу) играет важную роль в развитии псориаза. Учитывая, что HMGB1 наиболее представлен в связи с глицирризиновой кислотой, было решено использовать классический сигнальный каскад от этого белка с дальнейшим обогащением сигналинга другими наиболее представленными белками. В результате мы получили сигнальный путь, идущий от глицирризиновой кислоты через HMGB1, который может гипотетически ингибировать псориатический процесс: подавлять продукцию основных провоспалительных цитокинов и клеточные процессы, вовлеченные в развитие псориаза (рис. 4). Ингибирование HMGB1 глицирризиновой кислотой может приводить к снижению активности АКТ-1 и NF-kB, отвечающих за апоптотические процессы в клетке.
Таким образом, снижение ингибирования процесса апоптоза способно снизить псориатические проявления. Уменьшение экспрессии генов TNF-α, IL-17, IL-8, IL-1, IL-18 и ММР9 также должно существенно повлиять на уменьшение патологического процесса.
Заключение
Результаты исследований подтвердили потенциальную возможность Фосфоглива влиять на патогенез псориаза. В связи с этим становится очевидным необходимость проведения исследований влияния Фосфоглива не только на процессы, протекающие в гепатобилиарной системе, но и на цитокиновый статус больных псориазом с целью ингибирования остроты псориатического процесса и, возможно, увеличения периода между рецидивами.
I.M. Korsunskaya, A.L. Piruzyan, L.R. Sakaniya, O.V. Zhukova, Ye.N. Molyarenko, V.V. Sobolev
Center for Theoretical Problems of Physicochemical Pharmacology
Moscow Scientific and Practical Center of Dermatology and Cosmetology
Contact person: Irina Markovna Korsunskaya, marykor@bk.ru
Our study was dedicated to investigating comorbidity between psoriasis and hepatobiliary system diseases. Epidemiology data on liver injury during psoriasis confirmed by results of personal studies are presented in the paper. Undoubtedly, an interest is attracted to drugs acting not only on hepatobiliary system, but on psoriasis as well. During bioinformatics analysis there were determined proteins and small molecules involved in pathogenesis both of psoriasis and liver diseases. HMGB1 protein turned out to be the most relevant marker, which regulation may be affected by glycyrrhizic acid.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


