Биопсия сторожевого лимфоузла при меланоме кожи: опыт одного центра
- Аннотация
- Статья
- Ссылки
- English
Биопсия СЛУ выполнена 310 пациентам (67,4% женщин и 32,6% мужчин), средний возраст которых составил 53,6 года. Распределение стадий было следующим: pT1 – 65 (21,0%) пациентов, pT2 – 103 (33,2%), pT3 – 84 (27,0%), pT4 – 58 (18,8%) пациентов. Биопсия СЛУ с иссечением первичной опухоли проведена в 71 (22,9%) случае, отсроченно – в 239 (77,1%) случаях. Среднее количество дней между эксцизионной биопсией и реэксцизией послеоперационного рубца с биопсией СЛУ составило 44,8 дня (от 12 до 190 дней).
Метастазы выявлены в 42 (13,5%) случаях. В семи случаях биопсия СЛУ выполнялась одномоментно с иссечением первичной меланомы кожи, в 35 – отсроченно. 100% пациентов после выявления метастаза в СЛУ получали современную иммунотерапию в различных режимах. Среднее время наблюдения составило 13,1 месяца (от одного до 27 месяцев). В группе «отрицательных» СЛУ зафиксировано три случая прогрессирования с поражением регионарных лимфатических узлов (через 6, 8 и 12 месяцев соответственно). Во всех случаях метастазирование зафиксировано в лимфоколлекторе, в котором был удален СЛУ. У пяти пациентов возник рецидив в области рубца после широкого иссечения.
Биопсия СЛУ – эффективный метод ранней диагностики регионарных метастазов, позволяющий начать системное лечение и улучшить показатели выживаемости у пациентов с меланомой кожи.
Биопсия СЛУ выполнена 310 пациентам (67,4% женщин и 32,6% мужчин), средний возраст которых составил 53,6 года. Распределение стадий было следующим: pT1 – 65 (21,0%) пациентов, pT2 – 103 (33,2%), pT3 – 84 (27,0%), pT4 – 58 (18,8%) пациентов. Биопсия СЛУ с иссечением первичной опухоли проведена в 71 (22,9%) случае, отсроченно – в 239 (77,1%) случаях. Среднее количество дней между эксцизионной биопсией и реэксцизией послеоперационного рубца с биопсией СЛУ составило 44,8 дня (от 12 до 190 дней).
Метастазы выявлены в 42 (13,5%) случаях. В семи случаях биопсия СЛУ выполнялась одномоментно с иссечением первичной меланомы кожи, в 35 – отсроченно. 100% пациентов после выявления метастаза в СЛУ получали современную иммунотерапию в различных режимах. Среднее время наблюдения составило 13,1 месяца (от одного до 27 месяцев). В группе «отрицательных» СЛУ зафиксировано три случая прогрессирования с поражением регионарных лимфатических узлов (через 6, 8 и 12 месяцев соответственно). Во всех случаях метастазирование зафиксировано в лимфоколлекторе, в котором был удален СЛУ. У пяти пациентов возник рецидив в области рубца после широкого иссечения.
Биопсия СЛУ – эффективный метод ранней диагностики регионарных метастазов, позволяющий начать системное лечение и улучшить показатели выживаемости у пациентов с меланомой кожи.

Введение
Среди всех злокачественных новообразований кожи меланома занимает первое место по смертности [1]. За последние 50 лет отмечается неуклонный рост заболеваемости меланомой по сравнению с другими видами злокачественных новообразований [2]. При установлении диагноза меланомы на ранних стадиях можно говорить о достаточно высоких показателях пятилетней выживаемости, что обусловливает острую необходимость адекватной диагностики и лечения.
Основная цель неинвазивной диагностики – решить вопрос о необходимости выполнения биопсии опухоли. Подобное решение должно основываться на результатах клинического, дерматоскопического исследований и другой информации (динамика роста, симптомы, анамнез). Для пигментных новообразований кожи методом выбора является эксцизионная биопсия [3]. Данный метод позволяет определить важные показатели меланомы, такие как толщина по Бреслоу, уровень инвазии по Кларку, изъязвление и митотическая активность. Кроме того, корректно выполненная эксцизионная биопсия меланомы кожи не ставит под угрозу последующее широкое иссечение или биопсию сторожевого лимфатического узла (БСЛУ) [4, 5].
В соответствии с клиническими рекомендациями Национального противоракового комитета США, Российского общества клинической онкологии, Ассоциации онкологов России, после эксцизионной биопсии должны проводиться динамическое наблюдение (при меланоме in situ), широкая реэксцизия послеоперационного рубца (отступ от 10 до 20 мм в зависимости от толщины опухоли по Бреслоу), а также БСЛУ (при толщине опухоли по Бреслоу > 0,8 мм или < 0,8 мм с изъязвлением либо другими неблагоприятными характеристиками (например, митотический индекс > 2/мм2, лимфоваскулярная инвазия) в отсутствие данных о клинически измененных лимфоузлах.
Концепция БСЛУ основана на том, что метастазы в лимфоузлах появляются последовательно от первого ко второму, затем к третьему уровню. Исходя из этого можно предположить, что если СЛУ не содержит метастазов, то и другие лимфатические узлы не метастатические [6].
Главный принцип, на котором основана методика БСЛУ, заключается во введении в окружающие опухоль ткани препарата-метки, который транспортируется по лимфатическим коллекторам к лимфатическим узлам, непосредственно связанным с первичным опухолевым очагом [7].
В настоящее время в клинической практике применяются разные методы детекции СЛУ, среди которых наиболее популярен радиоизотопный. Радиоизотоп по лимфатическим путям попадает в СЛУ и концентрируется в нем, создавая «горячее пятно» по отношению к окружающим тканям. Согласно метаанализу, включавшему данные о 8000 пациентов, которым выполнялась БСЛУ с использованием радиоизотопного (как единственного) метода, средний показатель детекции СЛУ достиг 97%, а среднее значение ложноотрицательного результата – 7,4% [8]. Рациональное временное окно для обнаружения СЛУ составляет от 2 до 24 часов с момента инъекции радиоизотопа. D. Krag рекомендует считать стандартной активность радиоизотопа 37 МБк (1 мКи), предполагая, что это обеспечит легкое интраоперационное обнаружение СЛУ с помощью гамма-датчика [9].
Материал и методы
Для проведения радионуклидной диагностики лимфооттока от меланомы кожи использовались коллоидные радиофармпрепараты (РФП), меченные 99mTc, с диаметром частиц от 80–100 до 1000 нм. РФП в суммарном объеме 0,2 мл вводили в четыре точки на расстоянии 10 мм от края меланомы или вокруг послеоперационного рубца на 3, 6, 9 и 12 часов условного циферблата. Через 60–120 минут после введения РФП всем пациентам выполнялось гибридное исследование – однофотонная эмиссионная компьютерная томография (ОФЭКТ) с компьютерной рентгеновской томографией по стандартному протоколу, аналогичному исследованию сигнальных лимфоузлов при раке молочной железы [10, 11]. При проведении эмиссионного компонента исследования использовали низкоэнергетический коллиматор высокого разрешения (LEHR). Исследование осуществляли в положении пациента на спине с запрокинутыми наверх руками. На первом этапе проводили двухдетекторную ОФЭКТ с использованием следующих параметров: матрица – 128 × 128, шаг сканирования – 3°, время экспозиции кадра – 16 секунд, угол ротации для каждого детектора – 180°. После завершения ОФЭКТ, не изменяя положение пациента на столе, выполняли спиральную КТ: напряжение трубки – 120 Кв, сила тока – 80–100 мА, время оборота трубки – 0,5 с, время сканирования – 15 с, шаг стола – 1 мм, толщина среза – 5 мм с реконструкцией по 1,5 мм.
Обработку полученных данных осуществляли на рабочей станции Syngo (Siemens). Для сцинтиграфических данных применяли итеративный метод реконструкции (iterations – 8, subsets – 16) с обязательной коррекцией ослабления. КТ изображения, полученного с помощью фильтра B30, анализировали в мягкотканном окне. Общее время ОФЭКТ-КТ составило 16–20 минут.
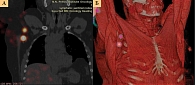
Полученные данные оценивали два специалиста – рентгенолог и радиолог. Анализировали характер лимфооттока, проводили визуализацию лимфатических сосудов, оценивали количество визуализированных лимфатических узлов и порядок их появления, уровень накопления радиометки, топографию лимфатических узлов, накапливающих радиоколлоиды. Полученные ОФЭКТ-КТ-сканы всех выявленных сигнальных лимфоузлов, включая трехмерные реконструкции, также передавались хирургу для осуществления предоперационной навигации (рис. 1).
Через 12–18 часов, согласно двухдневному протоколу, пациентам выполняли оперативное вмешательство в объеме удаления первичной меланомы кожи или реэксцизии послеоперационного рубца с БСЛУ. С помощью ручного стерильного гамма-зонда GammaFinder II осуществляли поиск СЛУ методом сканирования перпендикулярно поверхности тканей по направлению от места инъекции к лимфатическому коллектору со скоростью 1–2 см/с.
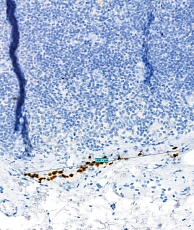
Полученный материал отправляли на патоморфологическое исследование. Проводили макроскопическое описание и измерение образцов лимфатических узлов с удалением излишней окружающей жировой клетчатки. Узлы размером менее 5 мм в наибольшем измерении исследовали тотально, узлы размером от 5 до 10 мм разрезались пополам через ворота лимфатического узла или по наибольшему расстоянию от полюсов лимфатического узла, каждая половина обрабатывалась отдельно. Лимфатические узлы диаметром более 10 мм нарезались фрагментами толщиной 2 мм поперек по наибольшему расстоянию между полюсами лимфатического узла. Затем фрагменты лимфатических узлов фиксировались в 10%-ном нейтральном забуференном растворе формалина в соотношении 1 : 20 в течение 24 часов, в соответствии со стандартной лабораторной практикой, проводились в гистологическом процессоре закрытого типа Logos Microwave Hybrid Tissue Processor (Milestone, Италия). Проведенный материал заливали в парафиновые блоки и далее выполняли серийно-ступенчатые срезы толщиной 3–4 мкм в количестве девяти штук с помощью микротома Microm HM 340E (Thermo scientific, США). Полученные парафиновые срезы окрашивали гематоксилином Майера и водным раствором эозина по стандартной программе в автоматическом гистостейнере Leica CV 5030 (Leica Microsystems, Германия). С помощью световой микроскопии оценивали наличие опухолевых клеток в ткани лимфатического узла. Если опухолевые клетки не визуализировались, проводилось иммуногистохимическое исследование с использованием антител S100, SOX 10 или Tyrosinasa. В случае положительной окраски данный срез сравнивали со срезом, окрашенным гематоксилином и эозином, и формировали заключение о статусе лимфатического узла.
В патоморфологическом заключении, в соответствии с протоколом исследования образцов меланомы кожи CAP [12], указывалось количество исследованных и пораженных СЛУ, размер наибольшего опухолевого депозита, его расположение в структуре лимфатического узла (субкапсулярное, интрамедуллярное) и выход за пределы капсулы лимфоузла.
Результаты
С июля 2018 г. по март 2021 г. в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова выполнено 310 оперативных вмешательств с БСЛУ пациентам с меланомой кожи. Объем оперативного вмешательства определяли в соответствии с клинической картиной: широкое иссечение меланомы кожи с БСЛУ или реэксцизия послеоперационного рубца с БСЛУ.
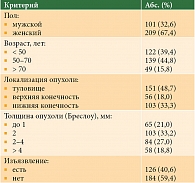
Средний возраст пациентов составил 53,6 года (23–86 лет). Мужчин было 101 (32,6%), женщин – 209 (67,4%). Основные клинические характеристики больных представлены в табл. 1.
БСЛУ с иссечением первичной опухоли выполнена в 71 (22,9 %) случае, отсроченно – в 239 (77,1%) случаях. Среднее количество дней между эксцизионной биопсией и реэксцизией послеоперационного рубца с БСЛУ составило 44,8 дня (от 12 до 190 дней).
После введения РФП и выполнения ОФЭКТ-КТ монолатеральный отток зафиксирован у 260 (83,8%) пациентов, билатеральный отток – у 48 (15,5%), отток в три зоны и более – у 2 (0,7%) больных. Во всех 48 случаях билатерального оттока и в случае оттока в три зоны и более первичная меланома кожи располагалась на туловище. При этом билатеральный отток в подмышечные области зафиксирован у 33 (66,0%) больных, билатерально в паховые области – у 3 (6,0%), сочетание ипсилатерального оттока в паховую и подмышечную области – у 12 (24,0%), билатерально в подмышечные зоны и ипсилатеральную паховую область – у 1 (2,0%) и билатерально в подмышечные и паховые области (четыре зоны) – у 1 (2,0%) пациента.
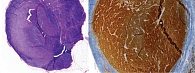
При гистологическом исследовании послеоперационного материала в 258 (86,5%) случаях метастатического поражения лимфатического узла не выявлено. В 42 (13,5%) случаях определен вторично измененный лимфоузел (рис. 2). Из них в 11 (26,1%) случаях размер метастазов был менее 2 мм. Метастазы выявлены только иммуногистохимическим методом (рис. 3).
У 1 (2,4 %) пациента зафиксирован выход метастаза за пределы капсулы лимфоузла. Билатеральное метастатическое поражение лимфоузла зарегистрировано у 3 (6,3 %) больных. В семи случаях БСЛУ выполнялась одномоментно с иссечением первичной меланомы кожи, в 35 случаях – отсроченно. В трех случаях количество дней между эксцизионной биопсией новообразования составило менее 30 дней, в 13 – 31–50 дней, в 11 – 51–100 дней, в 8 случаях – более 100 дней. Двум пациентам БСЛУ выполнили через 190 дней после иссечения меланомы кожи.
Основные характеристики первичной меланомы кожи при выявленном посредством БСЛУ «положительном» лимфоузле представлены в табл. 2.
100% пациентов после выявления метастаза в СЛУ получили консультацию химиотерапевта и современную иммунотерапию в различных режимах. Среднее время наблюдения составило 13,1 месяца (от одного до 27 месяцев). В группе «отрицательных» СЛУ зафиксировано три случая прогрессирования с поражением регионарных лимфатических узлов (через 6, 8 и 12 месяцев соответственно). Во всех случаях метастазирование наблюдалось в лимфоколлекторе, в котором был удален СЛУ. В пяти случаях возник рецидив в области рубца после широкого иссечения.
Обсуждение
Как показали результаты международного многоцентрового рандомизированного исследования (International Multicenter Selective Lymphadenectomy Trial), СЛУ могут быть корректно определены в 95,3% случаев. В исследование включали пациентов со средней толщиной меланомы кожи (1–4 мм), не подвергавшихся широкому иссечению опухоли (более 1,5 см от ее края), трансплантации кожи или другим процедурам, способным изменить лимфоотток. На первом этапе пациентам выполняли БСЛУ. Далее при обнаружении метастаза в удаленном лимфоузле проводили тотальную лимфодиссекцию. Основной целью исследования было определение точности техники и терапевтической значимости БСЛУ. В среднем точность определения СЛУ достигала 95,3%: 99% в паховой области, 95% – в подмышечной, 84% – на шее, 87% – в подколенной ямке и при других эктопичных локализациях. Суммарно у 19% пациентов обнаружены метастазы в СЛУ. У 59 (6,3%) из 944 пациентов, у которых не выявлено метастазов в СЛУ, отмечалось поражение регионарного лимфатического бассейна при медиане наблюдения 54 месяцев. При этом в 48 (81%) случаях поражение возникло в лимфатических узлах ранее оперированных лимфатических бассейнов. Таким образом, БСЛУ следует рассматривать как эффективную процедуру в определении распространенности меланомы кожи.
В то же время отсутствие 100%-ного уровня чувствительности БСЛУ можно объяснить вытеснением лимфоидной ткани из узлов, что приводит к отсутствию накопления РФП и невозможности обнаружить их при использовании единственного метода детекции СЛУ. Одним из способов улучшения показателей чувствительности БСЛУ является применение комбинированных методов детекции. Так, в литературе имеются указания, что при использовании двух методов детекции, например радиоизотопного и контраст-визуального, удается достигнуть показателей детекции до 99% [8].
Активно изучается флуоресцентный метод детекции СЛУ. В исследовании J.R. Vorst и соавт. эффективность детекции СЛУ при использовании индоцианина достигла 93%. При этом в 20% случаев лимфоузлы визуализировались чрескожно до момента разреза [13]. Авторы предположили, что данный метод позволяет не только увеличить чувствительность и снизить количество ложноположительных СЛУ, но и уменьшить травматичность БСЛУ.
В нашем исследовании «положительные» СЛУ выявлены в 13,5% случаев, что несколько ниже данных зарубежных коллег. Подобные различия могут быть связаны с разными патоморфологическими протоколами и особенностями выборки при оценке послеоперационного материала в патоморфологических лабораториях. Следовательно, необходимо стандартизировать процедуру со стороны не только врачей-клиницистов, но и врачей-патоморфологов.
Открытым остается вопрос о времени проведения БСЛУ. M.C. Oude Ophius и соавт. показали, что временной интервал 30 дней достоверно не влияет на статус лимфоузла [14]. Однако в клинических рекомендациях по лечению меланомы кожи не указывается максимальный временной интервал между первичной биопсией и широким иссечением в сочетании с БСЛУ. Только в голландском руководстве обозначено максимальное время – шесть недель [15].
По мнению одних исследователей, безметастатическая выживаемость выше, если БСЛУ проводится в срок до 30 дней [16], по оценкам других, прогноз хуже, если БСЛУ выполняется в ранние сроки [17].
В 2021 г. был проведен метаанализ, включавший данные о 8957 пациентах. Установлено, что статистически достоверная разница в безметастатической и общей выживаемости у пациентов, которым проведена БСЛУ в короткий (до 30 дней) или длительный период времени, отсутствует.
В соответствии с результатами нашего исследования, средний интервал составил 44,8 дня, что несколько превышает мировые данные. Однако на результат могли повлиять территориальные особенности организации системы здравоохранения и маршрутизации пациентов в Российской Федерации. Вероятно, нет необходимости устанавливать временные рамки на основании представленной информации, но логично предположить, что временные интервалы от одного до трех месяцев не влияют на прогноз. Можно установить разумное и безопасное время ожидания, которое, с одной стороны, не перегрузит систему здравоохранения, с другой – не вызовет опасений врачей или пациентов по поводу целесообразности проведения процедуры.
Выживаемость пациентов с меланомой кожи зависит как от количества лимфатических узлов, вовлеченных в опухолевый процесс, так и от степени их поражения. Так, десятилетняя выживаемость пациентов с меланомой кожи при наличии микрометастазов в одном лимфатическом узле при стадиях IIIA и IIIB составляет 63,0 и 47,7% соответственно, при макрометастазах в одном лимфатическом узле – 24,4%, при макрометастазах более чем в четырех лимфатических узлах – 18,4%. Исходя из этого можно предположить, что улучшения прогноза заболевания стоит ожидать при ранней и точной оценке распространенности процесса и его своевременном адекватном лечении.
Метастазы меланомы в регионарные лимфатические узлы часто служат первым признаком прогрессирования заболевания и свидетельствуют о его переходе в метастатическую фазу. Среди пациентов с локализованной меланомой кожи около 18–25% уже имеют скрытые регионарные метастазы, которые не могут быть выявлены неинвазивными методами диагностики, поскольку размеры метастазов выходят за пределы разрешающей способности этих методов. Опасность заключается в том, что регионарные метастазы априори состоят из клеток, способных к метастазированию. Их дальнейшему распространению препятствуют лишь недостаточная дедифференцировка опухолевых клеток, а также отсутствие определенного паттерна хемокинов, селектинов и интегринов, что делает возможным дальнейшую инвазию опухолевых клеток в отдаленные органы.
Ранняя диагностика первичных опухолей и регионарных метастазов позволяет своевременно прервать эти процессы и предупредить лавинообразное распространение опухоли.
Заключение
Как показал собственный опыт, биопсия сигнального лимфоузла является эффективным методом ранней диагностики скрытых регионарных метастазов. Российским пациентам с первичной меланомой кожи могут быть предложены адекватные диагностические мероприятия и своевременная эффективная терапия.
M.A. Ebert, G.V. Zinovyev, PhD, G.I. Gafton, PhD, D.A. Chuglova, A.S. Artemyeva, PhD, A.S. Popovich, P.I. Krzhivitsky, PhD, I.G. Gafton, PhD, M.S. Sinyachkin, PhD, S.G. Romanova
N.N. Petrov National Medical Research Center of Oncology
Contact person: Mariya A. Ebert, mary.ebert.spb@gmail.com
Evaluation of sentinel lymph node (SLN) is crucial for cutaneous melanoma staging and treatment in patients with clinically negative lymph nodes. We evaluated patients’ outcome who underwent SLN biopsy (SLNB) in NMRC of N.N. Petrov National Medical Research Center of Oncology for skin melanoma between July of 2018 and March of 2021.
SLNB was performed in 310 patients with an average age of 53.6 years. 67.4% of patients were female and 32.6% were male. The stage distribution was following: pT1 – 65 (21%), pT2 – 103 (33.2%), pT3 – 84 (27%), pT4 – 58 (18.8%). SLNB was performed with excision of the primary tumor in 71 cases (22.9%), delayed – 239 (77.1%). Average amount of days between excisional biopsy and re-excision of a postoperative scar with SLNB was 44.8 (range 12 to 190 days).
Metastasis was detected in 42 cases (13.5%). In 7 cases SLNB was performed simultaneously with excision of the primary skin melanoma, in 35 cases it was delayed. After detection of metastasis in SLN, 100% of patients receive immunotherapy in various modes. The median follow-up time was 13.1 months (range 1 to 27 months).
In ῾negative’ SLN group there were 3 cases of regional lymph node disease (in 6, 8 and 12 months, respectively). In all cases metastasis was recorded in the lymphatic collector, in which the SLN was removed. 5 patients had true scar recurrence.
SLNB is an effective method for early diagnosis of regional metastases, which allows to start systemic treatment and improve patient’s outcome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.