Синдром Иценко – Кушинга и беременность
- Аннотация
- Статья
- Ссылки
- English
В статье рассматривается клинический случай течения синдрома Иценко – Кушинга у молодой женщины во время беременности. Заболевание сопровождалось метаболическими и гемодинамическими нарушениями, которые привели к развитию тяжелой преэклампсии в третьем триместре и стали причиной экстренного родоразрешения путем кесарева сечения. Своевременную диагностику заболевания затрудняло состояние беременности, ограничивающее спектр гормональных исследований и методов визуализации, а также действующий на тот момент времени особый противоэпидемический режим в учреждениях здравоохранения, связанный с новой коронавирусной инфекцией.
Случаи выявления синдрома Иценко – Кушинга во время беременности редки, поэтому в статье также обобщены актуальные рекомендации по диагностике эндогенного гиперкортицизма у беременных, предлагающие в качестве возможных критериев ночные уровни кортизола в слюне или полуночные уровни кортизола в сыворотке крови, а также уровни кортизола в суточной моче с превышением в три раза верхних границ нормы. Ночной подавляющий тест с дексаметазоном во время беременности не показан.
В статье рассматривается клинический случай течения синдрома Иценко – Кушинга у молодой женщины во время беременности. Заболевание сопровождалось метаболическими и гемодинамическими нарушениями, которые привели к развитию тяжелой преэклампсии в третьем триместре и стали причиной экстренного родоразрешения путем кесарева сечения. Своевременную диагностику заболевания затрудняло состояние беременности, ограничивающее спектр гормональных исследований и методов визуализации, а также действующий на тот момент времени особый противоэпидемический режим в учреждениях здравоохранения, связанный с новой коронавирусной инфекцией.
Случаи выявления синдрома Иценко – Кушинга во время беременности редки, поэтому в статье также обобщены актуальные рекомендации по диагностике эндогенного гиперкортицизма у беременных, предлагающие в качестве возможных критериев ночные уровни кортизола в слюне или полуночные уровни кортизола в сыворотке крови, а также уровни кортизола в суточной моче с превышением в три раза верхних границ нормы. Ночной подавляющий тест с дексаметазоном во время беременности не показан.
Введение
Синдром Кушинга (СК) возникает в результате длительного воздействия избытка глюкокортикоидных гормонов – экзогенного или эндогенного источника избыточного уровня кортизола. Эндогенный СК может быть связан с зависимой или независимой от адренокортикотропного гормона (АКТГ) гиперпродукцией кортизола [1]. Данная патология встречается относительно редко. Предполагаемая ежегодная заболеваемость составляет 1,2–3,2 случая на 1 млн человек [2]. Самой частой причиной является АКТГ-зависимый гиперкортицизм: около 60–70% случаев приходится на болезнь Иценко – Кушинга, 5–10% – на АКТГ-эктопический синдром. При этом первичное поражение надпочечников (синдром Иценко – Кушинга) отмечается в 20–30% случаев эндогенного гиперкортицизма [3].
В отсутствие лечения смертность от синдрома Кушинга достигает 50% в течение пяти лет [4].
Длительный гиперкортицизм оказывает существенное влияние как на течение сопутствующей патологии, так и на общую выживаемость, поэтому важное значение придается ранней диагностике и своевременно назначенному лечению [5, 6].
При ряде состояний диагностика СК может быть затруднительна, в частности при беременности.
Беременность при СК наступает крайне редко вследствие отрицательного влияния гиперкортицизма на репродуктивную систему [7].
При проведении систематического поиска статей в библиотеке MEDLINE G. Kyriakos и соавт. обнаружили только 35 сообщений в период с 2010 по 2020 г. о случаях СК у беременных [8]. Используя ключевые слова «Кушинг и беременность», F. Caimari и соавт. было найдено 168 источников, опубликованных с января 1952 г. по апрель 2015 г. и содержащих данные о 220 пациентах и 263 беременных с активным СК во время беременности и в анамнезе. Основной причиной активного СК во время беременности была аденома надпочечников (44,1%) [9]. Ранее М.А. Buescher и соавт. также указывали на то, что аденома надпочечников лежит в основе примерно 40–50% случаев развития СК у беременных по сравнению с 15% случаев у небеременных женщин [10].
Известно, что нормальная беременность сопровождается физиологической активацией гипоталамо-гипофизарно-надпочечниковой оси, что приводит к повышению уровня кортизола и АКТГ и, как следствие, затрудняет диагностику СК [11]. В исследовании E.M. Scott и соавт. подтверждено значительное повышение уровня общего и свободного кортизола в сыворотке крови, а также значительное повышение уровня кортизола в слюне на поздних сроках беременности в течение дня, но с сохранением суточных колебаний [12].
Трудности с диагностикой гиперкортицизма во время беременности связаны с совпадением симптоматики, а задержка таковой – с риском развития таких физиологических и патофизиологических состояний, как артериальная гипертензия, гипергликемия, увеличение веса, появление ярких стрий и перепады настроения.
Следует также учитывать, что при беременности гормональный анализ и методы визуализации имеют свои ограничения.
В связи со сказанным выше особый интерес может представлять клинический случай, отражающий трудности диагностики и лечения беременных с гиперкортицизмом.
Клинический случай
Описание
Пациентка В. 25 лет в 2020 г. наблюдалась акушером-гинекологом по поводу первой беременности.
В первом триместре регулярно посещала женскую консультацию, жалоб не предъявляла, беременность протекала без особенностей.
Во втором триместре неоднократно фиксировалось повышение артериального давления (АД) до 190–200/100–110 мм рт. ст. При быстрой ходьбе, выполнении рутинной работы по дому беспокоили учащенное сердцебиение (до 150 уд/мин), одышка, дискомфортные ощущения в области сердца. Была назначена антигипертензивная терапия (метилдопа в дозе 250 мг три раза в день). АД стабилизировалось до 140–150/85–90 мм рт. ст.
После 12-й недели отмечена выраженная прибавка массы тела, которая за весь период беременности составила около 30 кг. Значимо изменилась внешность – округлилось лицо, увеличилось отложение жира на животе, похудели ноги и руки. На коже живота, бедер, ягодичной и аксиллярных областей, молочных желез появились багрово-синюшные стрии. Наблюдался также отек нижних конечностей.
В третьем триместре установлен диагноз «гестационный сахарный диабет». Назначен инсулин ультракороткого действия (аспарт в дозе 4 ЕД подкожно перед завтраком, обедом и ужином с коррекцией дозы в зависимости от количества съеденных хлебных единиц) и инсулин длительного действия (гларгин 100 ЕД/мл в дозе 12 ЕД/сут).
Ультразвуковое исследование (УЗИ) органов брюшной полости выявило объемное образование левого надпочечника.
С учетом трудностей диагностики эндогенного гиперкортицизма, обусловленных протекающей беременностью и ограничениями в доступности амбулаторной помощи из-за эпидемии новой коронавирусной инфекции, дальнейшее обследование было отложено до послеродового периода.
В связи с ухудшением состояния из-за развития тяжелой преэклампсии, сопровождающейся повышением АД до 200/120 мм рт. ст., протеинурией до 4,8 г/л в общем анализе мочи и выраженной отечностью лица, верхних и нижних конечностей, на сроке 35–36 недель проведено преждевременное родоразрешение путем кесарева сечения.
На основании данных медицинской документации выполнены нижнесрединная лапаротомия, кесарево сечение по Дерфлеру, вакуумная аспирация.
В первые часы после оперативного вмешательства открылось гипотоническое маточное кровотечение, в связи с чем были проведены баллонная тампонада полости матки и гемотрансфузия. Общая кровопотеря составила 1400 мл.
Родилась здоровая девочка весом 2800 кг, ростом 49 см.
Течение послеоперационного периода без осложнений. Пациентка выписана домой на седьмые сутки. Состояние ребенка оценивалось как удовлетворительное.
При выписке в связи с сохраняющейся артериальной гипертензией (АГ) рекомендован прием метилдопы в дозе 500 мг четыре раза в день, в связи с анемией – прием препаратов железа.
Уровень глюкозы в крови нормализовался через месяц после родоразрешения, поэтому инсулинотерапия была отменена.
В послеродовом периоде вес матери уменьшился на 10 кг.
Через две недели после выписки из перинатального центра пациентка В. была направлена на дообследование.
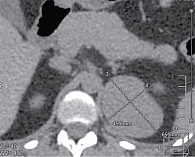
В декабре 2020 г. выполнена мультиспиральная компьютерная томография (МСКТ) надпочечников с толщиной реформатированных срезов 1,0–3,0 мм и последующим трехмерным анализом изображений мультипланарной и объемной реконструкций с внутривенным введением контрастного вещества. На медиальной ножке левого надпочечника определялось объемное образование до 57 × 37 × 43 мм, нативная плотность – 38 ед H, после контрастирования – 53 ед H. Заключение: объемное образование левого надпочечника.
Вследствие эпидемии новой коронавирусной инфекции и особого противоэпидемического режима в учреждениях здравоохранения больная была направлена на углубленное обследование только в сентябре 2021 г. У пациентки В. сохранялась неудовлетворительно контролируемая АГ. На фоне приема назначенной антигипертензивной терапии регистрировалось повышение АД до 180/100 мм рт. ст. Появилась клиника гирсутизма: рост волос на подбородке и по белой линии живота.
В сентябре 2021 г. проведена повторная МСКТ надпочечников. В проекции медиальной ножки левого надпочечника определялось объемное образование размером 57 × 65 × 45 мм, нативная плотность – 38 ед Н. Заключение: МСКТ-картина объемного образования левого надпочечника. По сравнению с исследованием, проведенным в декабре 2020 г., отмечено увеличение размеров образования (рис. 1).
При исследовании гормонального статуса выявлено повышение уровня кортизола в сыворотке крови, уровня кортизола в слюне, а также снижение уровня АКТГ. Так, уровень кортизола в сыворотке крови составил 1367 (референсный интервал (РИ) от 260 до 720) нмоль/л, вечерний уровень свободного кортизола в слюне – 29,9 (РИ менее 9,4) нмоль/л, АКТГ – менее 5 (РИ от 0 до 46) пг/мл.
Для дообследования, уточнения диагноза и определения тактики ведения пациентка В. была направлена на госпитализацию в отделение эндокринологии ГБУЗ «Иркутская ордена „Знак Почета“ областная клиническая больница» со следующим диагнозом: объемное образование левого надпочечника, кортикостерома, синдром Иценко – Кушинга, абдоминальное ожирение, артериальная гипертензия третьей степени, второго риска, хроническая сердечная недостаточность нулевого функционального класса.
В сентябре 2021 г. пациентка поступила в эндокринологическое отделение с жалобами на повышение АД до 180/100 мм рт. ст., учащенную частоту сердечных сокращений, увеличение массы тела на 30 кг за период беременности и снижение веса в послеродовом периоде только на 10 кг, наличие стрий в области живота, молочных желез, подмышечных впадин, бедер, ягодиц, а также на избыточный рост волос на лице, животе и спине.
При осмотре обращало внимание распределение подкожно-жирового слоя по диспластичному типу с преимущественным отложением жира на лице, шее, животе, спине (климактерический горбик). На животе, бедрах, ягодичной и аксиллярных областях, молочных железах – множественные стрии багрового цвета шириной около 1 см. Лицо лунообразное, щеки багрово-красного цвета. Окружность талии – 95 см.
Результаты лабораторных общеклинических и биохимических анализов свидетельствовали о характерных для гиперкортицизма изменениях. В общем анализе крови определялось повышение абсолютного числа лейкоцитов до 14,9 (РИ от 4,0 до 8,8) ×109/л, эритроцитов до 5,14 (РИ от 3,9 до 4,7) ×1012/л, тромбоцитов до 432 (РИ от 150 до 400) ×109/л, а также уровня гемоглобина до 152 г/л. Отмечались изменения лейкоцитарной формулы с увеличением содержания нейтрофилов до 73,6 (РИ от 47,0 до 72,0)%, базофилов до 2,2 (РИ от 0,0 до 1,0%)%, снижением уровня лимфоцитов до 16,4 (РИ от 19,0 до 37,0)% и значительным уменьшением концентрации эозинофилов до 0,3 (РИ от 0,5 до 5,0)%, скорости оседания эритроцитов до 7 (РИ менее 20) мм/ч.
Зафиксирована выраженная дислипидемия: увеличение уровня общего холестерина до 6,8 (РИ от 3,6 до 6,0) ммоль/л, липопротеинов низкой плотности (ЛПНП) до 3,8 (РИ от 2,8 до 3,5) ммоль/л, значительное повышение уровня липопротеинов очень низкой плотности (ЛПОНП) до 1,7 (РИ от 0,0 до 0,9) ммоль/л и триглицеридов до 3,7 (РИ от 0,4 до 1,8) ммоль/л. Коэффициент атерогенности составил 4,3 (РИ от 2,5 до 3,5).
Нарушений углеводного обмена на момент госпитализации не зарегистрировано.
В сыворотке крови также определены уровни гормонов: кортизол утром – 1108 (РИ от 260 до 720) нмоль/л, кортизол вечером – 1210 (РИ от 50 до 350) нмоль/л, АКТГ – менее 5 (РИ менее 46) пг/мл. Ночной подавляющий тест с дексаметазоном (1 мг) показал отсутствие подавления кортизола – 1015 нмоль/л. Диагностическое пороговое значение cut-off – менее 50 нмоль/л.
Для проведения дифференциального диагноза исследованы метилированные катехоламины плазмы, значения которых находились в пределах референсных.
Уровень альдостерона составил 402 (РИ от 30 до 355 в положении стоя) пг/мл, активность ренина плазмы – 2,90 (РИ от 0,48 до 4,88 в положении стоя два часа) нг/мл/ч, альдостерон-рениновое соотношение – 138,62 при общепринятом cut-off в случае первичного гиперальдостеронизма 300 для данных единиц измерения. Таким образом, гиперальдостеронизм имел вторичный генез [13]. Уровень калия в плазме крови находился в референсных пределах – 4,62 ммоль/л.
По данным эхокардиографии выявлена диастолическая дисфункция левого желудочка. Консультирована кардиологом, установлен следующий диагноз: симптоматическая артериальная гипертензия второй степени, первой стадии, первого риска, хроническая сердечная недостаточность нулевого функционального класса.
Проведена коррекция антигипертензивной терапии. Назначены периндоприл в дозе 10 мг/сут, бисопролол в дозе 5 мг/сут, индапамид в дозе 2,5 мг/сут, амлодипин в дозе 10 мг/сут.
Исходя из клинико-анамнестических данных, результатов лабораторного и инструментального обследования, был установлен диагноз «АКТГ-независимый синдром Иценко – Кушинга (кортикостерома левого надпочечника)». Рекомендовано оперативное лечение.
После получения согласия на операцию пациентка была переведена в отделение портальной гипертензии ГБУЗ «Иркутская ордена „Знак Почета“ областная клиническая больница» для хирургического лечения.
Одностороння адреналэктомия слева лапаротомным доступом проведена 5 октября 2021 г.
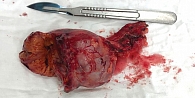
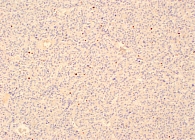
По результатам морфологического исследования в левом надпочечнике подтверждено наличие образования размером 80 × 50 × 40 мм (рис. 2). Гистологическое заключение: кортикостерома (рис. 3).
Послеоперационный период протекал без осложнений. АД нормализовалось до 120–130/80–90 мм рт. ст., отсутствовала одышка, частота сердечных сокращений была в пределах нормы. Уровень калия в крови составил 4,0 (РИ от 3,5 до 5,2) ммоль/л, натрия – 149 (РИ от 135 до 145) ммоль/л.
В периоперационном периоде проводилось введение глюкокортикостероидов. Антигипертензивная терапия была отменена на второй день после операции.
Пациентка В. была выписана из стационара на восьмые сутки после операции в удовлетворительном состоянии.
При динамическом наблюдении у эндокринолога в феврале 2023 г. больная не предъявляла жалоб, отмечала снижение массы тела с 72 до 56 кг, восстановление менструального цикла, нормализацию АД без приема каких-либо антигипертензивных препаратов. При осмотре кожных покровов были заметны бледные стрии на передней брюшной стенке и бедрах. Показатели углеводного обмена, общего кортизола в крови и АКТГ находились в пределах референсных значений.
Обсуждение
Синдром Иценко – Кушинга чрезвычайно сложно диагностировать во время беременности, поскольку происходит физиологичное повышение уровня глюкокортикоидов [7, 14, 15]. Начиная с первого триместра гестации плацента секретирует кортикотропин-рилизинг-гормон (КРГ) в кровоток матери, который достигает максимальной концентрации во втором и третьем триместрах [16, 17]. Это приводит к увеличению КРГ циркулирующей плазмы в 1000 раз [18]. КРГ плаценты молекулярно идентичен материнскому КРГ и стимулирует гипофиз матери, а затем надпочечники [16, 17]. На поздних сроках беременности выработка КРГ у матери снижается в ответ на повышенный уровень кортизола, что приводит к десенсибилизации кортикотрофов [11, 16]. В печени под влиянием эстрогенов вдвое увеличивается синтез кортизолсвязывающего глобулина и уменьшается клиренс кортизола. Как следствие, к 26-й неделе гестации уровень общего кортизола в плазме крови повышается втрое. При этом увеличивается не только синтез кортизола, но и количество кортизола в плазме крови [19]. Регистрируется также повышенное содержание КРГ, АКТГ, кортизола и свободного кортизола в моче [14]. В частности, в работе T. Brue и соавт. показано повышение уровня кортизола в плазме крови и свободного кортизола в моче в два-три раза.
Вышеописанный механизм формирования физиологического гиперкортицизма во время гестации обусловливает такие проявления, как стрии, увеличение массы тела, которые встречаются и при нормальном течении беременности. Поэтому на сегодняшний день диагностика эндогенного гиперкортицизма у беременных остается диагностической проблемой [20].
Анализ анамнеза нашей пациентки позволяет заподозрить наличие эндогенного гиперкортицизма во время беременности. Так, во втором триместре у женщины появились следующие характерные признаки: повышение АД до 200/110 мм рт. ст., значимое изменение внешности вследствие диспластичного перераспределения жира (лунообразное лицо, климактерический горбик, отложение жира на животе, истончение жировой клетчатки на руках и ногах), образование множественных багрово-синюшных стрий не только на животе, но и на бедрах, в ягодичной и аксиллярных областях, на молочных железах, выраженная прибавка массы тела, нарушение углеводного обмена.
Фиолетовые стрии (особенно на участках, отличных от живота), проксимальная миопатия, истончение кожи, образование синяков и патологические переломы не считаются типичными для беременности и могут использоваться в качестве критериев СК [14].
Изменение показателей крови также должно находиться в фокусе внимания врачей.
Лейкоцитоз в общем анализе крови при эндогенном гиперкортицизме встречается примерно в 40% случаев, поскольку глюкокортикоидные рецепторы экспрессируются в лейкоцитах и, как известно, играют роль в клеточной адгезии и рекрутировании лейкоцитов из костного мозга [21].
Дислипидемия также является одним из признаков СК. У пациентов наблюдается увеличение циркулирующих ЛПОНП, ЛПНП с последующим повышением уровня триглицеридов и общего холестерина. Патогенетические механизмы дислипидемии включают прямое и косвенное воздействие кортизола на липолиз, продукцию и циркуляцию свободных жирных кислот, синтез ЛПОНП и накопление жира в печени. АМФ-активируемая протеинкиназа опосредует многие метаболические изменения, индуцированные глюкокортикоидами [22, 23].
Таким образом, наличие лейкоцитоза, выраженной дислипидемии в совокупности с другими симптомами эндогенного гиперкортицизма вносит свой вклад в пользу диагностики СК у пациентки В.
Активный СК во время беременности связан не только с повышенным риском для плода, включающим недоношенность, задержку внутриутробного развития, самопроизвольный выкидыш, внутриутробную смерть, но и для матери [8, 20]. В двух больших обзорах сообщалось о множественных осложнениях у пациенток, таких как артериальная гипертензия (40–68%), гестационный сахарный диабет (25–37%), преэклампсия (14–27%), остеопороз (5%), психические расстройства (4%), сердечная недостаточность (3%), раневые инфекции (2%) и смерть (2%) [9, 24].
У пациентки В. в третьем триместре был диагностирован гестационный сахарный диабет, требующий назначения инсулинотерапии.
На 35–36-й неделях гестации состояние женщины резко ухудшилось в связи с развитием тяжелой преэклампсии, сопровождающейся повышением АД до 200/120 мм рт. ст. и выраженными системными расстройствами. Поэтому было принято решение о преждевременном родоразрешении путем кесарева сечения, осложнившемся гипотоническим маточным кровотечением в первые часы после операции, что потребовало проведения гемотрансфузии и баллонной тампонады полости матки.
Данная клиническая ситуация не является исключительной и, соответственно, актуализирует необходимость своевременной диагностики СК у беременных.
Развитие характерных для СК клинических симптомов должно мотивировать врачей, наблюдающих беременную, к проведению дифференциальной диагностики физиологического и эндогенного гиперкортицизма.
Избыточную выработку кортизола в тестах необходимо интерпретировать с осторожностью, при этом использовать адаптированные верхние границы нормы для беременных. Для постановки диагноза требуется «высокий индекс подозрения» на СК [7]. Следует отметить, что, несмотря на значительное повышение выработки кортизола, суточный ритм его секреции во время гестации остается неизменным [19], в то время как у беременных с СК циркадный ритм секреции нарушается. В связи с этим некоторые авторы предлагают использовать ночной уровень кортизола в слюне или полуночный уровень кортизола в плазме крови в качестве возможных диагностических тестов [20, 25, 26]. Исследование содержания кортизола в слюне может быть оправданным для оценки уровня кортизола во время беременности и ремиссии СК после хирургического лечения [26, 27]. Так, L. Lopes и соавт. установили, что при нормальной беременности уровень кортизола в слюне, определяемый поздно ночью, в два раза выше. Кроме того, были определены триместровые пороговые значения для диагностики СК при использовании набора для иммуноферментного анализа кортизола Salimetrics® (Salimetrics, LLC) – 7,0, 7,2 и 7,9 нмоль/л для первого, второго и третьего триместров соответственно, которые имели чувствительность 80–92% и специфичность 93–100% [27].
Во время беременности не рекомендуется использовать ночной подавляющий тест с дексаметазоном, поскольку у здоровых женщин наблюдается ослабление подавления кортизола. Высокий уровень ложноположительных результатов ограничивает их ценность для диагностики патологической гиперкортизолемии при беременности [14].
Одним из диагностических маркеров эндогенного гиперкортицизма у беременных может быть превышение уровня суточного кортизола в моче в три раза и более верхней границы нормы. Установлено, что уровень суточной экскреции кортизола с мочой при нормальном течении беременности в первом триместре находится в пределах референсных значений, во втором и третьем триместрах увеличивается в три раза [25].
Следующий этап диагностики – использование визуализирующих методов исследования, которые при беременности приобретают особую значимость в связи с объективными ограничениями применения лабораторных методов. Однако выбор метода визуализации ограничен из-за высокой лучевой нагрузки при проведении компьютерной томографии и тератогенности контрастных веществ [7]. Ультразвуковое исследование не имеет ограничений при беременности, при этом чувствительность этого метода для выявления образований надпочечников составляет 89–97%.
В описываемом нами случае пациентке в третьем триместре было проведено УЗИ органов брюшной полости, которое и выявило объемное образование левого надпочечника.
Магнитно-резонансная томография и мультиспиральная компьютерная томография имеют примерно одинаковую специфичность (70–80%) и чувствительность (90–100%).
Для снижения радиационного воздействия на плод предпочтительны УЗИ или магнитно-резонансная томография. Контрастное усиление у беременных не проводится [15].
Оптимальным методом лечения синдрома Иценко – Кушинга во время беременности является хирургическая резекция аденомы надпочечников во втором триместре. Оперативное вмешательство целесообразно проводить около 24-й недели гестации, чтобы снизить риск осложнений как у матери, так и у плода [7, 15, 20]. Необходимо отметить, что некоторые авторы предлагают использовать этот метод лечения даже в третьем триместре [28]. При легком течении СК операцию можно отложить до окончания родов. Фармакотерапия должна быть направлена на контроль метаболических осложнений гиперкортицизма, таких как гипертония и гипергликемия [7].
Заключение
Приведенный клинический случай демонстрирует сложности диагностики СК, а также необходимость предоставления актуальной информации эндокринологам, терапевтам, акушерам-гинекологам об особенностях лабораторных и инструментальных методов исследования эндогенного гиперкортицизма у беременных. Лечение должно быть индивидуальным и проводиться многопрофильной командой в центре, имеющем опыт работы с женщинами, относящимися к группе высокого риска развития СК.
Финансирование
Работа проведена без привлечения дополнительного финансирования со стороны третьих лиц.
Конфликт интересов
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Согласие пациента
Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в медицинском журнале.
L.Yu. Khamnueva, MD, PhD, Prof., L.S. Andreeva, PhD, M.A. Gryaznova, PhD, Ye.A. Danilova, S.B. Buraeva, Ya.V. Sunchugasheva
Federal State Budgetary Educational Institution of Higher Education ‘Irkutsk State Medical University’ of the Ministry of Health of the Russian Federation
State Budgetary Healthcare Institution ‘Irkutsk order ‘Badge of Honor’ Regional Clinical Hospital’
Contact person: Mariya A. Gryaznova, gryaznova_81@inbox.ru
Diagnosis of Cushing's syndrome in pregnancy is difficult because of the physiologic hypercorticism that is characteristic of normal pregnancy, as well as significant limitations in hormone analysis and visualization techniques. At the same time, endogenous hypercorticism during pregnancy is associated with both increased risk for the fetus (prematurity, delayed intrauterine development, spontaneous abortions) and a high level of complications for the mother's organism, such as arterial hypertension, gestational diabetes, preeclampsia, osteoporosis, psychiatric disorders, etc.
The article considers a clinical case of Cushing's syndrome during pregnancy in a young woman. The course of the disease was accompanied by metabolic and hemodynamic disorders, which led to the development of severe preeclampsia in the third trimester and caused emergency delivery by cesarean section in the patient. Timely diagnosis of the disease was hindered by the condition of pregnancy, which limited the range of hormonal studies and visualization methods, as well as by the special anti-epidemic regime at the time in health care facilities due to a new coronavirus infection.
Cases of Cushing's syndrome detection during pregnancy are rare.
The article summarizes current recommendations for the diagnosis of endogenous hypercorticism during pregnancy, suggesting such tests as late-night salivary cortisol levels or midnight serum cortisol levels, as well as cortisol in daily urine (3-fold or higher than the upper limit of normal) as possible diagnostic tests. Late-night suppressive test with dexamethasone is not recommended during pregnancy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.