Соната OBERTON: когда правильно подобран инструмент. XXVII Российский онкологический конгресс
- Аннотация
- Статья
- Ссылки
Иммунотерапия – одно из наиболее перспективных направлений терапии онкологических заболеваний, открывающее новые возможности лечения пациентов со злокачественными новообразованиями (ЗНО). К эффективным методам иммунотерапии солидных опухолей относят моноклональные антитела, способные связываться с рецептором цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4) или рецептором программируемой смерти 1 (PD-1) и ингибировать их функцию. В рамках XXVII Российского онкологического конгресса в Москве 14 ноября 2023 г. при поддержке компании BIOCAD состоялся симпозиум, посвященный обсуждению финальных результатов международного многоцентрового двойного слепого плацебо-контролируемого сравнительного рандомизированного клинического исследования OBERTON, целью которого была оценка эффективности и безопасности терапии фиксированной комбинацией препаратов класса анти-CTLA-4 и анти-PD-1 (нурулимаб + пролголимаб) в первой линии терапии пациентов с нерезектабельной или метастатической меланомой.
Иммунотерапия – одно из наиболее перспективных направлений терапии онкологических заболеваний, открывающее новые возможности лечения пациентов со злокачественными новообразованиями (ЗНО). К эффективным методам иммунотерапии солидных опухолей относят моноклональные антитела, способные связываться с рецептором цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4) или рецептором программируемой смерти 1 (PD-1) и ингибировать их функцию. В рамках XXVII Российского онкологического конгресса в Москве 14 ноября 2023 г. при поддержке компании BIOCAD состоялся симпозиум, посвященный обсуждению финальных результатов международного многоцентрового двойного слепого плацебо-контролируемого сравнительного рандомизированного клинического исследования OBERTON, целью которого была оценка эффективности и безопасности терапии фиксированной комбинацией препаратов класса анти-CTLA-4 и анти-PD-1 (нурулимаб + пролголимаб) в первой линии терапии пациентов с нерезектабельной или метастатической меланомой.







Увертюра
Приветствуя участников симпозиума, его председатель Лев Вадимович ДЕМИДОВ, д.м.н., профессор, руководитель отделения биотерапии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, отметил, что на сегодняшний день иммунотерапия по праву считается высокоэффективной опцией лечения метастатической меланомы. Иммуноонкологические препараты в моно- или комбинированном режиме являются предпочтительными методами первой линии лечения пациентов с метастатической меланомой, независимо от статуса гена BRAF. Данные клинических и наблюдательных исследований доказали преимущество комбинированной иммунотерапии моноклональными антителами к PD-1 и CTLA-4 по сравнению с применением монотерапии анти-CTLA-4/анти-PD-1. Установлено, что для пациентов с метастатической или нерезектабельной меланомой при прогрессировании злокачественного процесса после адъювантной терапии одним из моноклональных антител – ингибитором PD-1 или CTLA-4 – предпочтение рекомендуется отдавать их комбинациям. Ограничением широкого применения комбинации ингибиторов PD-1 и CTLA-4 в клинической практике является высокий риск развития нежелательных явлений (НЯ). Сегодня продолжаются исследования безопасности иммунотерапии и поиск путей снижения риска токсичности комбинированной терапии иммуноонкологическими препаратами.
Завершая вступительное слово, профессор Л.В. Демидов подчеркнул, что результаты фундаментальных научных исследований последних лет позволили разработать эффективные методы лечения ЗНО, направленные на ингибирование иммунологических контрольных точек и приводящие к реактивации противоопухолевого иммунного ответа. В международном рандомизированном исследовании OBERTON продемонстрирован синергический эффект одновременного блокирования двух иммунологических контрольных точек CTLA-4 и PD-1 фиксированной комбинацией нурулимаба и пролголимаба, что привело к достоверному повышению эффективности терапии первой линии у пациентов с нерезектабельной/метастатической меланомой. Нурулимаб + пролголимаб – это фиксированная комбинация оригинальных отечественных моноклональных антител против рецептора CTLA-4 (нурулимаб) и рецептора PD-1 (пролголимаб).
Экспозиция a tempo: эффективность
Игорь Вячеславович САМОЙЛЕНКО, к.м.н., старший научный сотрудник отделения онкодерматологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (Москва), представил дизайн многоцентрового двойного слепого плацебо-контролируемого рандомизированного клинического исследования II фазы OBERTON и его результаты, проанализировал эффективность новой фиксированной комбинации нурулимаба и пролголимаба в сравнении с монотерапией пролголимабом в качестве первой линии терапии у пациентов с нерезектабельной или метастатической меланомой.
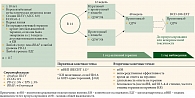
В исследование включили 117 взрослых пациентов (старше 18 лет) с нерезектабельной или метастатической меланомой, ранее не получавших терапию по поводу распространенного или метастатического заболевания, за исключением неоадъювантной или адъювантной терапии, если она была закончена более чем за шесть месяцев до рандомизации. Факторами стратификации были III/IV стадии заболевания, статус по шкале ECOG 0/1, PD-L1: TPS < 5% и TPS ≥ 5%, любой статус гена BRAF (рис. 1)1.
Пациенты были рандомизированы в две группы. Пациенты первой группы получали терапию комбинированным препаратом, содержащим нурулимаб и пролголимаб, один раз в три недели, пациенты второй группы – монотерапию препаратом пролголимаб один раз в три недели в течение первых 12 недель. Затем больные в обеих группах в течение 40 недель получали пролголимаб в открытом режиме. Пациенты, которые заканчивали один год терапии, далее могли продолжать терапию пролголимабом в клиническом исследовании BCD-100-EXTENSION при условии клинической пользы, по мнению исследователей (рис. 1).
Основной первичной конечной точкой исследования являлась выживаемость без прогрессирования (ВБП). Исследование считалось позитивным в том случае, если отношение рисков (ОР) составляло 0,6 и менее при соответствующих уровнях ошибки типа альфа и бета. Другими конечными точками эффективности были медиана общей выживаемости (ОВ), частота объективных ответов на лечение, время ответа и длительность ответа на терапию (рис. 1).
Диспозиция пациентов на момент закрытия базы данных свидетельствует, что 58 пациентов распределены в группу комбинированного лечения и 59 пациентов – в группу монотерапии. Из них в настоящий момент завершили лечение по протоколу 15 и 11 пациентов соответственно, смерть наступила у 13 и 15 больных соответственно.
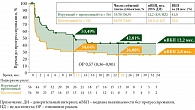
Результаты исследования показали, что медиана ВБП составила 12,2 (4,9; не достигнута) месяца в группе, получавшей нурулимаб + пролголимаб, и 2,8 (1,5; 4,7) месяца в группе монотерапии пролголимабом. Показатели ВБП за 24 месяца составили 41% в группе, получавшей нурулимаб + пролголимаб, и 25,4% – в группе монотерапии пролголимабом. Таким образом, комбинация нурулимаб + пролголимаб показала достоверное преимущество перед монотерапией пролголимабом (95% доверительный интервал 0,36–0,90, ОР 0,57) (рис. 2).
Анализ подгрупп пациентов, получающих терапию фиксированной комбинацией нурулимаба и пролголимаба, в зависимости от общего физического состояния, стадии заболевания, статуса PD-L1, мутации BRAF не выявил каких-либо различий в отношении эффективности терапии и показателей ВБП.
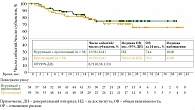
Предварительные данные по ОВ показали, что больные, получившие комбинированную терапию нурулимабом и пролголимабом, имели лучшие показатели по ОВ по сравнению с пациентами из группы монотерапии пролголимабом: на срок наблюдения 24 месяца живы 74,4% и 70,3% соответственно, медианы ОВ не достигнуты для обеих групп, но демонстрируют положительный тренд в сторону комбинации нурулимаб + пролголимаб (ОР 0,71 (95% ДИ, 0,33; 1,53)) (рис. 3).
Таким образом, на срок 24-месячного наблюдения клинического исследования OBERTON установлено, что комбинированная терапия нурулимабом и пролголимабом обладает доказанным преимуществом в эффективности перед монотерапией пролголимабом. Контроль над заболеванием достоверно чаще достигается в группе нурулимаба и пролголимаба, отношение рисков в пользу комбинированного лечения. Данные по ОВ незрелые, но отмечается положительный тренд в сторону комбинированного лечения.
В заключение И.В. Самойленко подчеркнул важность полученных данных о применении новой отечественной фиксированной комбинации лекарственных препаратов, ингибирующих PD-1 и CTLA-4, в лечении больных метастатической меланомой. Результаты исследования OBERTON уже на данном этапе позволяют высоко оценить широкие возможности применения нового комбинированного препарата нурулимаб + пролголимаб для улучшения прогноза выживаемости пациентов с метастатической меланомой.
Разработка con delicatezza: безопасность
Светлана Анатольевна ПРОЦЕНКО, д.м.н., заведующая отделением химиотерапии и инновационных технологий, ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации, профессор отделения аспирантуры и ординатуры ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России (Санкт-Петербург), привела данные ряда клинических исследований, в которых оценивали соотношение эффективности и безопасности препаратов класса ингибиторов иммунных контрольных точек для лечения метастатической меланомы (пролголимаб, ниволумаб, пембролизумаб, ниволумаб в качестве монотерапии, а также ниволумаб в комбинации с ипилимумабом). Так, в исследовании II/III фазы MIRACULUM изучали клиническую эффективность и безопасность монотерапии отечественным препаратом пролголимаб у пациентов с нерезектабельной и метастатической меланомой независимо от статуса BRAF, не получавших ранее таргетной и/или иммунотерапии ингибиторами контрольных точек иммунитета. По данным исследования, частота объективного ответа составила 49%. Согласно полученным данным, по параметрам клинической эффективности препарат пролголимаб не уступает ниволумабу и пембролизумабу по данным непрямого сравнения. Кроме того, пролголимаб демонстрирует лучший профиль безопасности в сравнении с другими представителями класса ингибиторов PD-1 по данным непрямого сравнения. Нежелательные явления 3–4-й степени были отмечены у 12,7% пациентов, отмена терапии по причине развития НЯ потребовалась только в 3,2% случаев2.
В свою очередь клинические исследования комбинированной терапии ниволумаба и ипилимумаба у пациентов с ранее не леченной распространенной меланомой показали высокую эффективность комбинированного лечения – ОВ через три года составила 58%. Однако связанные с лечением НЯ 3–4-й степеней тяжести зафиксированы у 59% пациентов в группе терапии ниволумаб + ипилимумаб. Серьезные НЯ выявлены в 73% случаев, а случаи прекращения терапии из-за развития НЯ – у 39% пациентов3.
Полученные данные свидетельствуют, что у пациентов с метастатической или нерезектабельной меланомой на комбинированной иммунотерапии в два раза чаще возникают НЯ 3–4-й степеней тяжести и в четыре раза чаще происходит отмена терапии из-за развития токсичности 3–4-й степеней, чем на монотерапии препаратами класса анти-PD-14.
Как отметила профессор С.А. Проценко, при выборе препарата для иммунотерапии метастатической меланомы следует оценивать соотношение эффективности и безопасности метода лечения. Накопленные данные позволяют сделать вывод, что пролголимаб характеризуется высокой эффективностью и низкой степенью токсичности. Применение пролголимаба в первой линии терапии нерезектабельной или метастатической меланомы позволяет достичь двухлетней ОВ у 64%, трехлетней ОВ – у 55% пациентов.
Еще одним потенциально эффективным препаратом для лечения метастатической меланомы является нурулимаб – оригинальная молекула, моноклональное антитело IgG1 с измененным Fc-фрагментом, блокирующая CTLA-4 на поверхности Т-клеток, прошедшая этапы in vitro исследований, доклинических и клинических исследований I фазы. Установлено, что нурулимаб блокирует CTLA-4 и приводит к активации способности Т-клеток уничтожать клетки опухоли.
Российские исследователи разработали комбинированный препарат, созданный на основе оригинальных отечественных моноклональных антител CTLA-4 и PD-1 (нурулимаб + пролголимаб), для применения в первой линии терапии нерезектабельной или метастатической меланомы. В целях снижения токсичности и сохранения эффективности терапии фиксированная комбинация включает пролголимаб и нурулимаб в соотношении 3:1.
Объединенный анализ данных ряда исследований показал, что для терапии метастатической меланомы более низкие дозы ингибитора CTLA-4 в комбинации с препаратом класса ингибиторов PD-1 обеспечивают эффективность терапии и облегчают выраженную токсичность лечения5.
В рамках клинического исследования OBERTON изучали безопасность терапии комбинированным препаратом нурулимаб + пролголимаб с продолжением терапии пролголимабом по сравнению с монотерапией пролголимабом в качестве первой линии лечения пациентов с нерезектабельной или метастатической меланомой. Как уже отмечалось, первичной конечной точкой исследования была ВБП. Ко вторичным конечным точкам относили ОВ, непосредственную эффективность, время и длительность ответа на терапию, а также безопасность терапии (все НЯ, НЯ 3–4-й степеней тяжести, частоту отмен терапии по причине НЯ) (см. рис. 1)1.
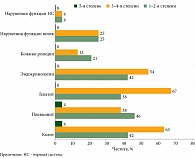
Результаты исследования безопасности применения фиксированной комбинации нурулимаб + пролголимаб у пациентов с нерезектабельной или метастатической меланомой продемонстрировали, что добавление нурулимаба к пролголимабу в заданном соотношении двух антител сохраняет благоприятный профиль безопасности, более характерный для монотерапии ингибиторами PD-1 (рис. 4).
Среди наиболее часто встречающихся иммуноопосредованных НЯ различных степеней тяжести у пациентов, получающих нурулимаб + пролголимаб, отмечались увеличение активности аланинаминотрансферазы, повышение уровня аспартатаминотрансферазы, лимфопения, астения. Тяжелые нежелательные реакции 3–5-й степеней тяжести в ответ на терапию встречались в единичных случаях. Таким образом, по результатам 24 месяцев наблюдения в рамках исследования OBERTON можно сделать заключение, что большинство НЯ, развившихся на фоне лечения новой фиксированной комбинацией нурулимаб + пролголимаб, соответствовали легкой или умеренной степени тяжести и не требовали отмены исследуемой терапии. Доля пациентов без отмены терапии по причине НЯ составила 85,96%. По словам докладчика, полученные данные позволяют надеяться, что в ближайшем будущем в реальной практике появится новый эффективный отечественный комбинированный препарат для иммунотерапии в первой линии лечения пациентов с нерезектабельной или метастатической меланомой (рис. 4).
Реприза con delizia: анализ и сопоставление данных
Цель врача-онколога – назначить оптимальное лечение пациенту с метастатической меланомой или другими опухолями, так начала свое выступление Кристина Вячеславовна ОРЛОВА, к.м.н., старший научный сотрудник отделения онкодерматологии/биотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (Москва). В каждом конкретном случае необходимо выбрать наиболее эффективный и максимально безопасный метод лечения.
На сегодняшний день вариантами лекарственной терапии у пациентов с наличием мутации в гене BRAF являются иммунотерапия в моно- или комбинированном режиме или таргетная терапия. Выбор при назначении лечения пациентам без мутации в гене BRAF более ограничен и подразумевает применение методов иммунотерапии ингибиторами контрольных точек иммунного ответа. Согласно современным представлениям, предпочтительным вариантом лечения у пациентов с метастатической меланомой кожи вне зависимости от мутации в гене BRAF в первой линии лечения является комбинированная иммунотерапия с применением анти-PD-1- и анти-CTLA-4-препаратов. Целесообразность данного терапевтического подхода к лечению метастатической меланомы подтверждается российскими и зарубежными клиническими рекомендациями6, 7.
В частности, в последних рекомендациях экспертов Национальной комплексной онкологической сети (National Comprehensive Cancer Network, NCCN) 2023 г. отмечено, что комбинированная иммунотерапия (ниволумаб + ипилимумаб) является одной из предпочтительных опций первой линии лечения, включая пациентов с метастатическим поражением головного мозга, мутациями в гене BRAF, меланомой слизистых или прогрессированием после адъювантной терапии блокаторами PD-18.
На сегодняшний день наиболее долговременные результаты по применению комбинированной терапии ингибиторами PD-1 и СTLA-4 пациентов с метастатической меланомой в первой линии лечения получены в клиническом исследовании CheckMate 067. По результатам последнего опубликованного среза данных, 48% пациентов с метастатической меланомой, которые получали комбинированную иммунотерапию анти-PD-1- и анти-CTLA-препаратами (ниволумаб + ипилимумаб), живы на срок наблюдения 7,5 лет9.
Несмотря на доказанную эффективность комбинированной иммунотерапии, в реальной онкологической практике в РФ наблюдается невысокое число назначений данной схемы лечения. В исследовании IPSOS в 2023 г. были получены данные о частоте назначения различных методов терапии у пациентов с метастатической меланомой в реальной клинической практике в Российской Федерации. Установлено, что только 13% пациентов с IV стадией меланомы в нашей стране получают комбинированную иммунотерапию10.
По мнению докладчика, интерес представляют данные опроса практикующих клиницистов-онкологов о предпочтительных опциях лечения метастатической меланомы, проведенного в 2023 г. при поддержке компании BIOCAD. В опросе принял участие 71 клиницист-онколог из разных регионов Российской Федерации. Анализ полученных данных показал, что большинство клиницистов считают наиболее предпочтительной опцией для пациентов с диссеминированной меланомой с мутацией BRAF комбинированную иммунотерапию анти-PD-1- и анти-CTLA-4, в частности при бессимптомном метастатическом поражении головного мозга. Тем не менее в клинической практике более 73% врачей применяют комбинированную иммунотерапию только у единичных пациентов.
По данным опроса клиницистов-онкологов, у 25 из 34 (74%) врачей в практике были случаи отмены комбинированной иммунотерапии анти-PD-1- и анти-CTLA-4-препаратами по причине развития неприемлемой токсичности у пациентов с метастатической меланомой (рис. 5)11.
К.В. Орлова подчеркнула, что основной причиной низкой частоты назначения комбинированной иммунотерапии у пациентов с метастатической и/или нерезектабельной меланомой является высокий риск развития иммуноопосредованных НЯ.
Сегодня становится очевидным, что улучшение характеристик комбинированного препарата для иммунотерапии метастатической меланомы позволит не только повысить эффективность, но и снизить токсичность терапии. С этой целью для первой линии терапии нерезектабельной или метастатической меланомы российскими учеными разработана фиксированная комбинация анти-CTLA-4- и анти-PD-1-препаратов (нурулимаб + пролголимаб), которая содержит в составе в три раза больше ингибитора PD-1, чем ингибитора CTLA-4. Такое соотношение действующих веществ позволяет обеспечивать высокую эффективность при сохранении благоприятного профиля безопасности комбинированного препарата.
Непрямое сравнение данных исследований CheckMate-067, CheckMate-069, CheckMate-511, в которых изучалась эффективность и безопасность комбинации ингибитора PD-1 ниволумаба с ингибитором CTLA-4 ипилимумабом в лечении больных метастатической меланомой, и клинического исследования OBERTON показало сопоставимую эффективность и наиболее благоприятный профиль безопасности у отечественной фиксированной комбинации нурулимаб + пролголимаб (таблица)1, 12, 13.
Резюмируя вышесказанное, К.В. Орлова отметила, что результаты клинического исследования OBERTON демонстрируют статистически значимое преимущество комбинации нурулимаб + пролголимаб перед монотерапией пролголимабом. Анализ результатов исследования показал преимущество назначения фиксированной комбинации нурулимаб + пролголимаб в отношении как эффективности, так и переносимости лечения, что будет способствовать комплаентности и улучшению прогноза выживаемости пациентов с метастатической меланомой.
Кода deciso: экспертное мнение
Джакоб ШЕХТЕР (Jacob Schachter), д.м.н., профессор, заведующий отделением онкологии Института иммуноонкологии им. Эллы Лемельбаум, Медицинский центр «Шиба» (Тель-Хашомер, Израиль), напомнил участникам симпозиума, что в настоящее время установлено: Т-клетки обеспечивают иммунную защиту организма. В активации Т-клеточного иммунного ответа участвуют костимулирующие факторы. Однако существуют иммунорегуляторные пути, ингибирующие активность Т-лимфоцитов, такие как CTLA-4 и PD-1. Сегодня известно, что анти-CTLA-4- и анти-PD-1-препараты влияют на созревание и активацию Т-лимфоцитов, в результате чего иммунная система распознает и уничтожает клетки злокачественного новообразования.
Основными целями иммунотерапии метастатической меланомы являются обеспечение долгосрочной выживаемости пациентов, устойчивой длительности ответа на лечение и повышение качества жизни пациентов. Накопленные данные клинических исследований и опыт реальной практики показывают высокую эффективность иммунотерапии в лечении пациентов с онкологическими заболеваниями, приводя к увеличению показателей ВБП, ОВ и регрессу метастазов. Поэтому иммунотерапия является наиболее предпочтительным терапевтическим подходом для большого спектра солидных опухолей, а также метастатической и нерезектабельной меланомы.
Как уже отмечалось, сегодня комбинированная иммунотерапия анти-PD-1- и анти-CTLА-4-препаратами – одна из самых эффективных опций для пациентов с метастатической меланомой. Благодаря синергическому эффекту препаратов на фоне комбинированной иммунотерапии у пациентов с метастатической и нерезектабельной меланомой отмечается более выраженный и длительный ответ на лечение по сравнению с монотерапией ингибиторами иммунных контрольных точек.
Значимые результаты по эффективности комбинированной анти-PD-1- и анти-CTLA-4-иммунотерапии получены в рандомизированном исследовании CheckMate 067, в котором принимали участие 945 пациентов с ранее не леченной нерезектабельной метастатической меланомой14.
Пациенты были рандомизированы в группы. Первая группа получала ниволумаб (1 мг/кг каждые три недели) + ипилимумаб (3 мг/кг каждые три недели, четыре введения) с последующим проведением терапии ниволумабом (3 мг/кг каждые две недели), вторая группа – монотерапию ниволумабом (3 мг/кг каждые две недели) + плацебо, третья группа – монотерапию ипилимумабом (3 мг/кг каждые три недели, четыре введения) + плацебо. Основными критериями эффективности были показатели ВБП и ОВ.
Анализ данных исследования показал беспрецедентно высокие показатели ОВ у пациентов с метастатической меланомой кожи при комбинированной терапии ниволумабом и ипилимумабом по сравнению с монотерапией ниволумабом или ипилимумабом. При анализе результатов наблюдения за период 7,5 лет медиана ОВ в группе пациентов, получающих иммунотерапию комбинацией ниволумаб + ипилимумаб, достигла 71,1 месяца. Таким образом, почти через восемь лет после рандомизации 48% пациентов, получавших комбинированную иммунотерапию, были живы. Кроме того, в группе больных, получивших ниволумаб + ипилимумаб, показатель ВБП был выше, чем в группе больных, получивших монотерапию. Также меланома-специфическая выживаемость за период 90 месяцев наблюдения оказалась выше в группе комбинированной иммунотерапии (ниволумаб + ипилимумаб) по сравнению с монотерапией ниволумабом, ипилимумабом – 55% против 47 и 26% соответственно.
Как отметил профессор Дж. Шехтер, при назначении комбинированной схемы иммунотерапии анти-PD1- и анти-CTLA-4-препаратами следует учитывать высокий риск развития иммуноопосредованных НЯ. Так, у 59% пациентов в группе лечения комбинацией ниволумаб + ипилимумаб наблюдались НЯ 3–4-й степеней тяжести, тогда как в группе ниволумаба – 24%, в группе ипилимумаба – 28%. Отмена терапии из-за НЯ на фоне комбинации ниволумаб + ипилимумаб потребовалась у 31% пациентов, на фоне ниволумаба – у 8%, ипилимумаба – у 13% пациентов.
В стремлении снижения высокой сопутствующей токсичности и сохранения эффективности комбинированного лечения анти-PD-1 и анти-СTLA-4 было проведено клиническое исследование IIIb/IV фазы CheckMate 511, в котором сравнивали эффективность и частоту развития НЯ 3–5-й степеней тяжести, связанных с применением иммунотерапии, в зависимости от дозировки препаратов. Сравнивали комбинации ниволумаба 3 мг/кг с ипилимумабом 1 мг/кг и ниволумаба 1 мг/кг с ипилимумабом 3 мг/кг у пациентов с нерезектабельной или метастатической меланомой, ранее не получавших лечения.
По данным исследования, более низкая дозировка ипилимумаба в сочетании с ниволумабом (1 мг/кг и 3 мг/кг соответственно) ассоциируется с достоверно меньшей частотой развития связанных с лечением НЯ 3–5-й степеней тяжести. При этом существенных различий в эффективности между двумя группами не было выявлено13.
В российском исследовании MIRACULUM оценили эффективность и безопасность двух режимов дозирования пролголимаба у пациентов с распространенной меланомой. Пациенты были рандомизированы для получения пролголимаба: первая группа – по 1 мг/кг каждые две недели, вторая группа – 3 мг/кг каждые три недели до прогрессирования заболевания или непереносимой токсичности. Результаты исследования показали, что двухлетняя ВБП составила 33,3% в первой группе и 30,2% – во второй. Двухлетняя ОВ составила 57,1 и 46% соответственно2.
Как отметил докладчик, на сегодняшний день большой интерес вызывают результаты многоцентрового рандомизированного исследования II фазы OBERTON по оценке эффективности и безопасности терапии комбинированным препаратом нурулимаб + пролголимаб в качестве первой линии терапии пациентов с нерезектабельной или метастатической меланомой. Важно, что данная фиксированная комбинация содержит анти-CTLA-4 нурулимаб в сниженной дозировке для достижения оптимального профиля безопасности терапии. Медиана наблюдения составила 16,8 месяца, медиана ВБП в группе комбинированной терапии (нурулимаб + пролголимаб) – 12,2 месяца, медиана ВБП в группе монотерапии пролголимабом – 2,8 месяца. Таким образом, наблюдается ярко выраженное преимущество назначения комбинации нурулимаб + пролголимаб по сравнению с монотерапией в отношении показателей ВБП у пациентов с нерезектабельной или метастатической меланомой.
Более того, полученные результаты показали благоприятный профиль безопасности в обеих группах терапии: комбинации нурулимаб + пролголимаб и монотерапии пролголимабом. Нежелательные явления 3–4-й степеней тяжести были выявлены в группе комбинированного лечения в 15,5% случаев, в группе монотерапии – в 1,7% случаев. Очевидно, что частота НЯ в данном исследовании гораздо ниже, чем обычно выявляется при комбинации анти-PD-1- и анти-CTLA-4-препаратов. Таким образом, в ходе клинического исследования OBERTON была подтверждена эффективность и безопасность применения российского препарата, в состав которого входит комбинация анти-PD-1- и анти-CTLA-4-препаратов (пролголимаб + нурулимаб), в первой линии терапии нерезектабельной и/или метастатической меланомы.
Заканчивая свое выступление, профессор Дж. Шехтер подчеркнул, что создание современной комбинации иммуноонкологических препаратов из групп ингибиторов PD-1 и CTLA-4 – большой шаг на пути к повышению эффективности и безопасности терапии метастатической меланомы. Профессор пожелал удачи российским коллегам в дальнейших исследованиях и успешном применении в рутинной клинической практике новой фиксированной комбинации анти-PD-1- и анти-CTLA-4-препаратов (нурулимаб + пролголимаб) с доказанной высокой эффективностью и благоприятным профилем безопасности при лечении пациентов с метастатической или нерезектабельной меланомой.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.