Современная терапия атопического дерматита: роль эмолентов и антигистаминных препаратов
- Аннотация
- Статья
- Ссылки
- English
Атопический дерматит и атопический марш
Атопический дерматит (АтД) – аллергическое воспалительное заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям, характеризующееся хроническим рецидивирующим течением, возрастными особенностями локализации и морфологии очагов воспаления, кожным зудом и обусловленное гиперчувствительностью к аллергенам и неспецифическим раздражителям [1]. Это заболевание имеет и другое название – атопическая экзема.
АтД обычно начинается в раннем детстве, в связи с чем наиболее распространен среди детской популяции, но может развиваться и у подростков, а также у взрослых. По данным эпидемиологических исследований, 15–30% детского и 2–10% взрослого населения страдают АтД [2, 3].
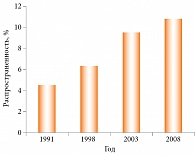
В регионах нашей страны распространенность АтД варьирует от 6,2 до 15,5% [4, 5].
Термин «атопический дерматит» был впервые предложен в 1930 г. F. Wise и M.B. Sulzberger, поскольку заболевание тесно связано с другими атопическими болезнями – аллергическим ринитом и бронхиальной астмой и в ряде случаев становится первым проявлением атопии. В свою очередь термин «атопия» (греч. atopos – странность, необычность) был предложен A.F. Coca и R. Cooke в 1924 г. для определения серии синдромов (астма, ринит и экзема) с наследственной предрасположенностью.
Таким образом, атопия – генетическая предрасположенность к синтезу IgE-антител в ответ на низкие дозы аллергенов, как правило белковой природы. Причем в значительной части популяции не развивается IgE-сенсибилизация в ответ на воздействие этих естественных экзоаллергенов.
За последние несколько десятилетий распространенность АтД в экономически развитых странах заметно возросла, особенно среди детей и подростков (рис. 1) [6]. АтД представляет медико-социальную проблему в силу существенного нарушения качества жизни больных и высокого риска развития респираторного аллергического заболевания – так называемого атопического марша. Его наиболее характерное начало – АтД на первом году жизни, часто обусловленный пищевой аллергией. Затем появляются симптомы риноконъюнктивита и/или астмы.
По данным исследований, приблизительно у 45% больных АтД впоследствии развивается бронхиальная астма, у 30–40% – аллергический ринит [7].
Результаты ряда длительных обсервационных исследований подтверждают концепцию атопического марша и первоочередную роль АтД [8].
Степень тяжести АтД относится к фактору риска развития респираторной аллергии. Риск развития бронхиальной астмы при тяжелом АтД составляет 70%, при легком – 30%. В целом в детской популяции этот показатель достигает 8–10%. Максимальный риск развития астмы среди пациентов с АтД имеют лица с мутациями в гене филаггрина.
Филаггрин – белок, который играет ключевую роль в формировании корнифицированного эпителия и образовании эпидермального барьера, защищающего организм от воздействия токсических соединений [9, 10]. Приблизительно у половины (в Европе – у 30%) больных АтД выявляются мутации в гене филаггрина. Они ассоциированы с повышенным риском развития астмы, но только у пациентов с АтД [10].
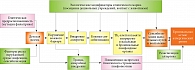
Несмотря на популярность гипотезы атопического марша, механизм, лежащий в его основе, до конца не изучен. Наиболее вероятен биологический механизм, предложенный J.A. Burgess и соавт. [11] и дополненный S. Dharmage и соавт. (рис. 2). Потенциальный механизм атопического марша связан с дефектами кожного барьера при АтД. Вследствие нарушения барьерных функций кожи повышается трансэпидермальная потеря воды (ТЭПВ), через кожу проникают аллергены, бактерии и вирусы, имеющие достаточно высокий молекулярный вес [12]. Сенсибилизация к аллергенам может происходить через нарушенный кожный барьер и инициировать развитие атопического марша, что подтверждают результаты когортных исследований.
Ранняя пищевая сенсибилизация у детей с АтД повышает риск развития бронхиальной астмы в последующие годы [13, 14]. Сказанное позволяет предположить, что IgE-ассоциированный АтД является начальным этапом атопического марша.
Дефекты барьерной функции кожи связаны с системными реакциями, такими как повышение уровня общего IgE и развитие бронхиальной гиперреактивности, возможно, из-за последующей сенсибилизации. У детей АтД может быть обусловлен воспалением дыхательных путей даже в отсутствие астмы [15]. Кожная сенсибилизация предшествует сенсибилизации дыхательных путей к тем же аллергенам [16] и служит одним из самых сильных предикторов развития детской астмы и аллергического ринита [17].
Приведенные данные свидетельствуют о том, что мероприятия, направленные на улучшение барьерной функции кожи и минимизацию проникновения аллергенов, могут стать необходимой мерой профилактики атопического марша.
Роль дисфункции эпидермального барьера в патогенезе атопического дерматита
Нарушение барьерной функции кожи составляет основу многофакторного патогенеза не только АтД, но и, вероятно, других атопических заболеваний. Ксероз, или сухость кожи, – один из основных клинических симптомов АтД и результат дефекта кожного барьера. В частности, в отношении сохранения воды и регулирования кожной проницаемости наиболее важен роговой слой. Он состоит из корнеоцитов и межклеточных пластинчатых образований. В свою очередь последние состоят из липидов – холестерина, керамидов и свободных жирных кислот. Корнеоциты и липиды связаны между собой и представляют две основные целостные цепи эпидермального барьера. Низкое содержание липидов в роговом слое, особенно керамидов, нередко ассоциировано с АтД [18–20]. Именно керамиды выполняют роль основного барьера, препятствующего ТЭПВ. Они составляют до 45–50% массы рогового слоя эпидермиса, являясь важнейшими составляющими билипидного барьера. Керамиды представлены особым типом глицерина – сфингозином, обладающим антимикробной активностью. Уменьшение содержания липидов в роговом слое эпидермиса приводит к снижению эластичности корнеоцитов и увеличению межклеточного пространства. В результате повышается проницаемость кожи для микробных агентов и аллергенов.
Гидратация рогового слоя, также имеющая значение для целостности кожного барьера, обеспечивается натуральным увлажняющим фактором – гигроскопичным веществом, доставляемым в основном из белка филаггрина [21]. Целостность кожного барьера может быть существенно нарушена вследствие изменений в гене, кодирующем синтез филаггрина.
Как уже отмечалось, филаггрин – основной компонент эпидермальных кератогиалиновых гранул, играющий важную роль в программе дифференцировки эпидермиса и поддержании гидратации кожи. У пациентов с мутациями в гене филаггрина наиболее вероятно развитие ксероза. Они более уязвимы при контакте с аллергенами [9, 10, 21].
В результате деятельности сальных желез на поверхности эпидермиса выделяется кожное сало, которое заполняет выводные протоки и устья волосяных фолликулов и, постепенно распределяясь по бороздкам, покрывает всю поверхность кожи слоем толщиной 7–10 мкм. При смешивании кожного сала с секретом потовых желез происходят эмульгация и образование тонкой сплошной водно-жировой эмульсионной пленки, называемой водно-липидной мантией [22]. У пациентов с АтД имеют место снижение функции сальных желез и нарушение образования водно-липидной пленки, участвующей в формировании целостности кожного барьера.
Кроме того, нарушение функции эпидермального барьера обусловлено такими факторами, как снижение синтеза омега-3 и омега-6 жирных кислот, истощение сфингозина, снижение ингибирования сериновых протеаз или усиление протеолитической активности в коже, приводящих к аберрации метаболизма липидов, особенно церамидов [23].
Указанные факторы нарушают нормальную функцию эпидермального барьера, приводя к увеличению ТЭПВ еще до манифестации АтД. Этот процесс часто приводит к сухости кожи, что зачастую определяет воспаление экзематозной кожи [24].
Таким образом, дисфункция кожного барьера является начальным этапом развития АтД – вызывая обезвоживание кожи и повышенную проницаемость для аллергенов и микробов (таких как золотистый стафилококк), способствует высвобождению цитокинов и других воспалительных медиаторов. Расчесывание усиливает воспаление кожи и еще больше повреждает кожный барьер.
Кроме того, рН поверхности кожи нередко повышается у пациентов с AтД. Щелочная среда может нарушать кожную микробиоту и тормозить процессы репарации. Зачастую такая среда способствует колонизации стафилококка [25].
Основные принципы терапии атопического дерматита
Общие принципы терапии АтД заключаются в следующем.
Выбор терапии в каждом случае зависит от вида, тяжести и продолжительности АтД. Единая для всех пациентов с АтД рекомендация – избегать воздействия триггерных факторов. У большинства пациентов используется преимущественно топическое (наружное) лечение. Подобная терапия наиболее эффективна и характеризуется минимальным количеством побочных эффектов. Увлажняющие и смягчающие средства (эмоленты) составляют основу ухода за кожей больных АтД.
Для наружной противовоспалительной терапии АтД применяют две основные группы лекарственных средств:
- топические глюкокортикостероиды (ГКС);
- ингибиторы кальциневрина.
В случае присоединения вторичной микробной или грибковой инфекции эффективны комбинированные препараты, содержащие топический ГКС, антибиотик и/или антимикотик.
Системная фармакотерапия АтД предполагает использование антигистаминных средств, ГКС и иммуносупрессивных препаратов. Эти средства применяются при обострениях и тяжелом АтД, торпидном к топическому лечению. В качестве системного лечения часто назначают антигистаминные препараты.
Эмоленты: виды, механизм действия и эффективность
Эмоленты – вещества, оказывающие смягчающее, успокаивающее и увлажняющее воздействие на кожу. Они способны восстанавливать нарушенные функции эпидермального барьера, тем самым облегчая симптомы АтД. Их основное действие направлено против ксероза и TЭПВ – основных составляющих патогенеза АтД. Помимо смягчающего и увлажняющего такие средства проявляют окклюзионный эффект.
Большинство средств, например пропиленгликоль, соевые стеролы и стеарат глицерина, смягчают и смазывают кожу. Они действуют в качестве смягчителей/эмолентов.
Средства с более специфичным окклюзивным действием, создающие барьер, уменьшающий TЭПВ, включают субстанции на основе вазелина, минеральные масла и диметикон (жидкий силикон) [26].
Такие средства, как глицерин, мочевина, лактат аммония, гиалуроновая кислота, оказывают увлажняющий эффект, привлекая молекулы воды и удерживая воду в коже.
Увлажняющие средства представляют первую линию терапии сухой кожи при АтД. Процент гидрофильных субстанций в этих продуктах варьирует. Например, уровень мочевины в увлажняющих средствах для лечения АтД колеблется от 5 до 20% в зависимости от вида и локализации повреждений, а также возраста пациента [27–29].
В одном средстве для лечения АтД эмоленты c окклюзивным и/или увлажняющим эффектом могут содержаться как по отдельности, так и в совокупности. Эти средства представлены различными формами с разной вязкостью: кремы, лосьоны, масла, мази, гели. Чаще они производятся в виде эмульсий. Традиционные эмульсии состоят из смеси липидов в воде с разным процентным содержанием, связанных эмульгатором. Традиционные эмоленты часто называют «масло-в-воде». Иногда в состав эмолентов вводят загустители, отдушки и консерванты. Важно, чтобы больному АтД нравился применяемый эмолент. Только в этом случае можно рассчитывать на приверженность терапии и ее эффективность.
Эмоленты повышают гидратацию кожи больных АтД, что ощущается субъективно пациентами и объективно при микроскопии [30]. Кроме того, результаты многочисленных клинических исследований продемонстрировали уменьшение на фоне применения эмолентов симптомов АтД, в том числе зуда, эритемы, трещин кожи и лихенизации [30–33].
Таким образом, эмоленты сами по себе способствуют некоторому уменьшению воспаления и тяжести АтД. При использовании эмолентов снижается потребность в наружных противовоспалительных препаратах [33–35]. Стероид-спаринговый эффект увлажняющих/смягчающих средств проявляется в 50%-ной редукции топических ГКС [33, 35].
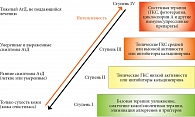
Эмоленты могут составлять основу первичного лечения легкой формы АтД и должны быть обязательной частью терапии среднетяжелых и тяжелых форм АтД [1, 28, 36]. Они являются важным компонентом поддерживающего лечения и профилактики обострений, формируя базовую терапию АтД (рис. 3) [36]. Во всех международных и национальных рекомендациях применение эмолентов при АтД имеет самую высокую степень рекомендаций А и уровень доказательности I [1, 28, 29, 36].
Эмоленты могут применяться в качестве первичной профилактики у здоровых детей с высоким риском развития АтД. В первом пилотном исследовании эффективности этой профилактической стратегии, проведенном в 2010 г., были получены обнадеживающие результаты [37]. Те же авторы в недавнем рандомизированном многоцентровом контролируемом исследовании с участием 124 новорожденных с высоким риском развития АтД оценили превентивный эффект ежедневного применения эмолентов, начиная с третьей недели жизни ребенка и до достижения им шестимесячного возраста. По сравнению с детьми, у которых не применяли увлажняющие/смягчающие средства, в группе детей, у которых использовались эмоленты, отмечалось 50%-ное (отношение рисков 0,50; 95%-ный доверительный интервал 0,28–0,9; р = 0,017) снижение риска развития АтД [38].
В аналогичном исследовании участвовало 59 новорожденных с высоким риском развития АтД. К 32-й неделе жизни в группе детей, у которых применяли эмоленты, риск развития АтД был на 32% ниже, чем у новорожденных контрольной группы [39].
В исследовании с участием детей более старшего возраста (от двух до шести лет) с сухой кожей и атопической предрасположенностью показано значительное улучшение состояния кожи, уменьшение ТЭПВ и кожного рН на фоне применения эмолентов [40].
Разработка безопасной и эффективной стратегии профилактики АтД является одной из актуальных проблем. Данные, полученные в ходе указанных исследований, представляют многообещающий потенциал для будущих масштабных исследований эффективности эмолентов в первичной профилактике АтД.
Эмоленты применяются как у детей, так и у взрослых. Их использование может носить персонализированный характер в отношении типа пациента и выраженности кожного процесса. Увлажняющие и смягчающие средства рекомендуются в качестве монотерапии при легкой форме АтД: они наносятся на кожу всего тела по крайней мере дважды в день как при наличии, так и в отсутствие кожных проявлений [29, 41, 42]. Эмоленты рекомендуется применять сразу после ванны или душа с целью улучшения гидратации кожи больного АтД [28]. Применение эмолентов при среднетяжелом и тяжелом АтД зависит от стадии кожного процесса и должно сочетаться с топическими ГКС или ингибиторами кальциневрина. В ряде случаев при обострении кожного процесса эмоленты наносят на непораженные участки кожи, а противовоспалительные препараты – на пораженные. Увлажняющие/смягчающие средства наносят на поверхность всего тела, включая очаги поражения, с 30-минутным интервалом после использования топических ГКС [43].
В фазе ремиссии АтД эмоленты составляют основу поддерживающей терапии: либо в виде монотерапии, либо (при среднетяжелом или тяжелом АтД) в комбинации с противовоспалительными препаратами, используемыми в режиме проактивной терапии [44, 45]. Эмоленты следует наносить на все кожные покровы, а не только на участки с видимым ксерозом. В связи с этим общее количество эмолента, которое должно быть использовано в неделю, для взрослых пациентов с АтД составляет от 350 до 500 г, для детей – 250 г [46].
В небольшом количестве сравнительных исследований различных эмолентов существенной разницы в эффективности не зафиксировано [47, 48]. Надо отметить, что все эмоленты эффективны и безопасны как у детей, так и у взрослых с АтД. Тяжелых нежелательных эффектов в результате их применения не зарегистрировано. Кроме того, отмечается высокая приверженность пациентов терапии эмолентами.
Таким образом, выбор эмолента зависит от предпочтений врача и пациента, а также особенностей кожного процесса, анамнеза заболевания и ответа на предыдущую терапию.
Эффективность эмолентов серии Эмолиум в лечении атопического дерматита
Идеальным считается эмолент:
- выполняющий функцию липидного барьера кожи и увлажняющий ее для уменьшения зуда и жжения;
- оказывающий противовоспалительное действие;
- защищающий кожу от патогенных микробов;
- характеризующийся приятным запахом и консистенцией, отсутствием в составе раздражающих консервантов и топических аллергенов;
- не влияющий на эффективность любого другого топического препарата.
Большинство пациентов предпочитают гели и эмульсии, поскольку содержание в них воды выше, они легче наносятся и не оставляют ощущения жирной кожи. Однако в отношении ксероза эти средства менее эффективны, чем кремы и мази, их не рекомендуется применять в холодное время года. Удобно, когда эмолент выпускается в разных формах и предназначен для нанесения на разные участки (кожа лица, волосистая часть головы, конечности, туловище) в зависимости от выраженности АтД.
Большинству из перечисленных требований отвечает дерматологическая линия косметических увлажняюще-ожиривающих средств ухода за кожей Эмолиум. Средства линии Эмолиум, разработанные с участием дерматологов и педиатров, не содержат красителей и ароматических веществ. Эта обширная косметическая линия включает крем и эмульсию для тела для ежедневного базового ухода за кожей, специальные крем и эмульсию для ухода за кожей в периоды обострения кожного процесса, связанного с сухостью кожи. Они содержат больше жиров и увлажнителей и оказывают противозудный эффект. Кремы имеют более насыщенную текстуру и предназначены для нанесения на небольшие участки кожи. Эмульсии удобны для нанесения на распространенные пораженные участки кожи.
Косметическая линия Эмолиум включает также щадящие средства гигиены: кремовый гель для умывания, применяемый в качестве ежедневного базового средства очищения кожи, и эмульсию для ванн, применяемую в качестве средства очищения кожи в периоды обострения состояний, связанных с сухостью кожи. К преимуществам кремового геля и шампуня серии Эмолиум относится отсутствие в них агрессивного поверхностно-активного вещества лаурилсульфат натрия. Это поверхностно-активное вещество обладает сильными моющими, очищающими, пенообразующими, жирорастворяющими и смачивающими свойствами. Но процесс очищения происходит преимущественно за счет окисления поверхности, в том числе кожи, оставляя пленку на ней. Эта пленка может раздражать кожу, вызывать зуд, шелушение, покраснение, ирритантную или аллергическую реакцию при длительном применении. Лаурилсульфат натрия разрушает гидролипидную защиту кожи, вступает в реакции с липидами кожи и дегенерирует их. Напротив, присутствие в гигиенических средствах Эмолиум компонентов, соответствующих натуральному увлажняющему фактору и способствующих эффективному увлажнению, – мочевины, гиалуроната натрия обеспечивает бережное очищение сухой кожи.
Средства косметической линии Эмолиум:
- увлажняют и удерживают воду в коже (мочевина, гиалуроновая и молочные кислоты);
- восстанавливают гидролипидную пленку кожи (натуральные масла макадамии, карите и авокадо);
- обогащают межклеточными липидами (экстракт огуречника аптечного и кукурузное масло);
- устраняют зуд и жжение (кукурузное масло и пантенол).
Увлажнение кожи обеспечивает входящая в состав средств линии Эмолиум мочевина. За счет низкой молекулярной массы она быстро проникает в глубокие слои кожи и, удерживая воду, обеспечивает выраженную гидратацию. Удержанию воды в коже способствует и глицерин, также входящий в состав косметических средств линии Эмолиум. Полученное из орехов макадамии жирное масло насыщает глубокие слои кожи фосфолипидами и жирными кислотами – олеиновой (54–65%), пальмитолеиновой (16–23%), пальмитиновой (7–10%), стеариновой (2–5%), линолевой (1–3%), миристиновой (0,4–1,6%), арахидоновой (1,5–3%), а также витаминами групп В и РР. Масло карите питает, смягчает и разглаживает кожу, улучшает микроциркуляцию и стимулирует клеточный метаболизм. Масло авокадо содержит олеиновую (36–80%), пальмитиновую (7–32%), линолевую (6–18%), пальмитолеиновую (2–13%), стеариновую (0,5–1,5%), альфа-линоленовую (0–5%) кислоты и обладает выраженным увлажняющим и заживляющим свойствами. Обогащение кожи межклеточными липидами способствует укреплению липидного барьера эпидермиса, ограничивая ТЭПВ, уменьшает раздражение за счет активного вещества Arlasilk Phospholipid GLA (2,5%), полученного из семян огуречника аптечного. Экстракт масла огуречника содержит до 25% гамма-линоленовой кислоты – составного компонента фосфолипидов в мембранах клеток и керамидов межклеточного пространства. Противозудное действие эмолентов Эмолиум обусловлено аллантоином и триглицеридами кукурузного масла (линолевая (40–48%) и олеиновая (42–45%) кислоты), которое отличается высоким содержанием токоферолов (до 0,1%). Пантенол (провитамин В5) усиливает защитные свойства внутренних слоев кожи.
Щадящие средства гигиены косметической линии Эмолиум содержат жировые добавки, восполняющие дефицит собственных липидов кожи. Использование кремового геля для умывания Эмолиум позволяет бережно очищать кожу, не разрушая и не ощелачивая водно-липидную мантию. Эмульсия для купания Эмолиум, содержащая до 90% липидных веществ, доставляет в глубину эпидермиса межклеточные липиды, создает на поверхности кожи липидную пленку, препятствующую ТЭПВ, и, что немаловажно, обладает хорошими моющими свойствами.
В серию Эмолиум входят средства ухода трех типов:
- базовые (крем и эмульсия для тела, эмульсия для купания, кремовый гель для мытья) для ухода и защиты чувствительной, сухой и склонной к воспалению кожи детей с первого дня жизни;
- специальные (специальные крем и эмульсия для тела, шампунь и эмульсия для кожи головы) для ухода за сухой кожей, склонной к аллергическим реакциям и сухости;
- триактивные (триактивные крем и эмульсия для купания) для ухода за сухой кожей с признаками острого зуда и АтД.
Большинство средств Эмолиум могут применяться с первого дня жизни. Эффективность эмолентов косметической линии Эмолиум подтверждена результатами отечественных и зарубежных клинических исследований [22, 49].
Клинический случай
Пациентка С. 62 лет поступила в аллергологическое отделение ГКБ № 52 в ноябре 2015 г. с обострением АтД.
Из анамнеза. АтД с локализацией в области кистей рук страдает с детского возраста. Эпизодически принимала топические ГКС, использовала увлажняющие косметические средства. Имели место три эпизода тяжелых обострений: в 1982 г. после родов, в 1995 г. после стресса и в 2005 г. после гриппа. Проходила лечение в дерматологическом стационаре. В октябре 2013 г. снова отмечалось тяжелое обострение: сильный зуд, высыпания на лице и конечностях с распространением по телу. В дерматологическом стационаре получала терапию Реамберином, Актовегином, Сонапаксом, циклоспорином в течение двух недель, ретинолом с положительным эффектом. Отмечалась ремиссия в течение года. Пациентка пользовалась только косметическими средствами (детский крем). После возобновления в сентябре 2015 г. высыпаний с распространением по телу самостоятельно применяла антигистаминные препараты, Атодерм крем, Белосалик лосьон, Элоком – без видимого эффекта. Отмечалось появление выраженной сухости и шелушения кожи, сильного зуда, слабости, раздражительности, снижения массы тела, периодических болей в суставах.
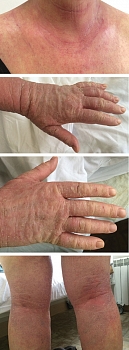
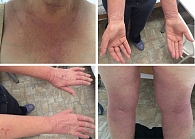
Состояние при поступлении. Кожа шеи, в области декольте, верхней части спины, предплечий, кистей рук, на бедрах, в области подколенных ямок гиперемирована и отечна. Эритематозно-папулезные очаги, обильное шелушение, трещины, корочки, расчесы. Выраженная сухость кожи (рис. 4).
Ультразвуковое исследование органов – без значимых клинических изменений.
Общий анализ крови: гемоглобин – 144 г/л, гематокрит – 42,9%, эритроциты – 4,88 × 1012/л, цветовой показатель – 0,88, лейкоциты – 7,1 × 109/л, тромбоциты – 322 × 109/л, нейтрофилы – 4,0, лимфоциты – 2,1, моноциты – 0,42, эозинофилы – 0,49, базофилы – 0,04, скорость оседания эритроцитов –12 мм/ч.
Общий анализ мочи – без патологических изменений.
Биохимический анализ крови: уровни глюкозы – 5,47 ммоль/л, общего белка – 68,7 г/л, общего билирубина – 8,3 ммоль/л, аспартатаминотрансферазы – 29,3 Ед/л, аланинаминотрансферазы – 40,4 Ед/л, С-реактивного белка – 5,35 мг/л.
ЭКГ. Ритм синусовый, нормальное направление электрической оси сердца. Частота сердечных сокращений – 81 уд/мин.
Консультация дерматолога: распространенный АтД, тяжелое течение, стадия обострения.
Диагноз. Атопический дерматит, распространенная форма, тяжелое течение, фаза обострения.
Назначенная терапия:
- Реамберин 400,0 внутривенно один раз в день;
- Эмолиум – кремовый гель для душа и триактивный крем наружно после душа; гидрокортизоновая мазь два раза в день на пораженные участки, через 30 минут триактивный крем;
- цетиризин (Зодак®) 10 мг в качестве противозудного средства.
Через семь дней лечения наблюдались выраженная положительная динамика кожного процесса, купирование зуда, нормализация сна и общего состояния (рис. 5). Пациентка выписана в удовлетворительном состоянии с рекомендациями продолжить применение кремового геля для душа Эмолиум и триактивного крема Эмолиум наружно после душа.
Роль антигистаминных препаратов в терапии атопического дерматита
Выраженный кожный зуд доставляет наибольшее беспокойство пациентам с АтД, нарушает сон, существенно снижает качество жизни.
Противозудная терапия при АтД требует многомерного лечения, включающего прежде всего применение эмолентов и топических противовоспалительных препаратов (ГКС и/или ингибиторов кальциневрина).
Системные (пероральные) антигистаминные препараты (АГП) традиционно применяются для уменьшения кожного зуда при АтД [29]. Однако результаты небольшого количества рандомизированных клинических исследований показали слабый противозудный эффект АГП при АтД [50–54]. АГП первого поколения улучшают сон пациентов с АтД в фазе обострения. Но этот эффект является результатом побочного (седативного), а не антигистаминного влияния. Нежелательные побочные эффекты АГП первого поколения обусловлены:
- низкой специфичностью к Н1-гистаминовым рецепторам (сухость слизистых оболочек, задержка мочи, тахикардия, повышение аппетита и др.);
- короткой продолжительностью действия (требуют двух-, трех- и четырехкратного применения);
- липофильностью и высоким прохождением через гематоэнцефалический барьер (выраженное седативное действие);
- развитием тахифилаксии (быстрое привыкание и снижение эффекта).
АГП второго поколения практически лишены или оказывают незначительное седативное действие, которое, как правило, не отличается от эффекта плацебо. Кроме того, они не влияют на холинергические и адренергические рецепторы либо это влияние незначительно. АГП второго поколения эффективны в отношении купирования симптомов аллергического ринита и конъюнктивита, которые часто имеют место у больных АтД.
В экспериментальных исследованиях показано, что спектр фармакологической активности АГП второго поколения не ограничивается связыванием с H1-гистаминовыми рецепторами. Препараты также подавляют высвобождение провоспалительных медиаторов (гистамина, лейкотриенов), снижают экспрессию адгезионных молекул (ICAM-1 и Р-селектина) и некоторых цитокинов (интерлейкинов 4, 6, 8, 13, гранулоцитарно-макрофагального колониестимулирующего фактора).
Сказанное позволяет предположить наличие у современных АГП противовоспалительного эффекта [55].
В ряде исследований показан дозозависимый противозудный эффект цетиризина у пациентов с АтД [56].
В известном исследовании ETAC, посвященном оценке профилактической эффективности цетиризина в отношении развития респираторной аллергии у детей с АтД, продемонстрирован стероид-спаринговый эффект препарата у детей с тяжелым АтД, который был расценен исследователями как противозудная эффективность цетиризина [57].
В исследовании H. Murota и соавт. [58] сравнили эффективность седативных (первого поколения) и неседативных (второго поколения) АГП в отношении заболеваний, проявляющихся кожным зудом, в том числе зудящих дерматозов. Существенной разницы не зафиксировано. При этом АГП второго поколения значимо уменьшали нарушенную в результате зуда дневную активность и профессиональную продуктивность.
Отечественными исследователями проведено открытое несравнительное исследование эффективности цетиризина (Зодак® 5 мг один раз утром) у 36 детей в возрасте от двух до шести лет с АтД [59]. В течение четырех недель пациентам разрешалось пользоваться только эмолентами. Топические противовоспалительные препараты, равно как и другие АГП, были исключены. Эффективность терапии оценивали по выраженности зуда в баллах от ноля до десяти, нарушениям сна и интенсивности кожного процесса. Обобщающей оценкой состояния кожи на каждом визите был индекс по шкале SCORAD. Как известно, значения SCORAD могут находиться в диапазоне от ноля (нет проявлений поражения кожи) до 103 баллов (максимально выраженные проявления АтД). У четырех пациентов отмечалось тяжелое течение АтД (индекс SCORAD > 60 баллов, площадь кожного поражения > 20% поверхности тела), у 32 – средней степени тяжести (индекс SCORAD от 30 до 59 баллов, площадь кожных поражений < 20% поверхности тела).
На фоне проводимой терапии, предусматривавшей соблюдение гипоаллергенной диеты и применение нестероидных наружных средств, к началу лечения цетиризином индекс зуда и индекс SCORAD составили 5,4 и 44,8 балла соответственно. К концу второй недели лечения цетиризином индекс зуда уменьшился в два раза и достиг 2,7 балла, а индекс SCORAD снизился почти в два раза – до 23,6 балла. Однако эти различия были статистически недостоверны. Все остальные показатели также имели положительную динамику к концу второй недели лечения.
Исследователи пришли к выводу, что применение цетиризина (Зодак®) при АтД у детей может способствовать развитию ремиссии. Это обусловливает целесообразность включения цетиризина в комплексную терапию обострения АтД.
Наш опыт применения цетиризина у подростков и взрослых больных АтД также свидетельствует о его эффективности в отношении уменьшения зуда, эритемы, кожных элементов, что скорее всего объясняется противовоспалительным эффектом препарата.
В исследованиях in vivo показано, что цетиризин тормозит миграцию эозинофилов [60] и может оказывать регулирующее воздействие на экспрессию молекул адгезии [61, 62].
Таким образом, АГП второго поколения, в частности цетиризин, способны оказывать дополнительное противозудное и небольшое противовоспалительное действие при обострении АтД и назначаются в комплексной терапии обострения, особенно у пациентов, страдающих не только АтД, но и респираторными проявлениями аллергического заболевания.
Заключение
Основным лечением АтД является наружная терапия, включающая противовоспалительные средства (топические ГКС и ингибиторы кальциневрина) и эмоленты.
Увлажняющие и смягчающие средства (эмоленты) составляют основу ухода за кожей больных АтД и применяются во всех возрастных периодах независимо от формы, стадии болезни и тяжести процесса.
Современные комплексные средства линии Эмолиум обладают способностью эффективно и длительно увлажнять кожу, восстанавливать липидный барьер, уменьшать зуд и раздражение кожи у детей и взрослых, страдающих АтД.
Антигистаминные препараты второго поколения характеризуются дополнительным противозудным и небольшим противовоспалительным эффектами при обострении АтД и назначаются в комплексной терапии обострения, особенно у пациентов с АтД и респираторными проявлениями аллергического заболевания.
N.M. Nenasheva
Russian Medical Academy of Postgraduate Education
Contact person: Natalya Mikhaylovna Nenasheva, 144031@gmail.com
Usually, patients suffering from atopic dermatitis are administered with topical (external) treatment. Such therapy displays the highest efficacy and characterized by minimal side effects. Moisturizers and emollients underlie the basis of skin care in such patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.