Эффективность рупатадина при кожных аллергических заболеваниях
- Аннотация
- Статья
- Ссылки
- English
Одним из таких препаратов является рупатадин, эффективность и безопасность применения которого у пациентов с острой, хронической и приобретенной холодовой крапивницей была подтверждена в клинических исследованиях.
Одним из таких препаратов является рупатадин, эффективность и безопасность применения которого у пациентов с острой, хронической и приобретенной холодовой крапивницей была подтверждена в клинических исследованиях.


Введение
Кожные аллергические заболевания включают атопический дерматит, контактный аллергический дерматит, острую и хроническую крапивницу. Следует отметить, что генез этих заболеваний различен, однако все они сопровождаются более или менее выраженным кожным зудом и разнообразными морфологическими кожными элементами. Поэтому антигистаминные препараты часто назначают для терапии этих заболеваний, хотя их применение патогенетически обосновано при острой и хронической крапивнице, в механизме формирования которой наиболее значима роль гистамина.
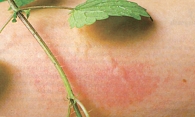
Основными симптомами крапивницы (от лат. urtica – крапива) являются уртикарные, волдырные элементы на коже, схожие с теми, которые образуются после ожога крапивой (рис. 1). Волдырь представляет собой ограниченный отек поверхностных слоев дермы, имеет бледно-розовый цвет с покраснением по периферии, сопровождается интенсивным зудом, сохраняется на коже в течение нескольких часов и разрешается, как правило, без каких-либо следов. Иногда крапивница сопровождается ангиоотеком, развивающимся в результате отека глубоких слоев дермы, подкожной клетчатки или подслизистых тканей. В отличие от волдыря ангиоотек может сохраняться дольше 24 часов и разрешаться в течение 72 часов.
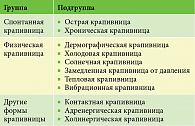
Согласно классификации, предложенной в международных рекомендациях 2006 г., выделяют спонтанную, физическую и другие формы крапивницы (табл. 1) [1]. Спонтанная крапивница считается острой, если продолжается менее шести недель, и хронической в случае персистенции высыпаний более шести недель. Именно высокая распространенность острой спонтанной крапивницы обусловливает медико-социальное значение заболевания. Считается, что почти у 25% населения хотя бы раз в жизни развивается острая крапивница. Хроническая крапивница встречается существенно реже (от 0,1 до 3%) [2]. Крапивницей страдают люди преимущественно трудоспособного возраста. Только у 50% больных острой крапивницей удается установить этиологический триггер высыпаний, а доля идиопатической хронической крапивницы еще выше. Тем не менее в любом случае следует предпринять тщательный диагностический поиск причины кожных высыпаний.
Патофизиология крапивницы
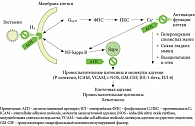
В патофизиологии крапивницы ключевую роль играют тучные клетки кожи, активация которых иммуно- или неиммунообусловленными триггерами приводит к высвобождению из них преформированных и вновь образованных медиаторов. Гистамин, брадикинин, лейкотриен С4, простагландин D2 и фактор активации тромбоцитов (ФАТ) (platelet-activating factor, PAF) – лишь основные биологически активные вещества, секретируемые тучной клеткой. Эти медиаторы вызывают экстравазацию плазмы в дерму, что и приводит к формированию волдыря. В результате активации гистамином немиелинизированных С-волокон нервных окончаний в коже этот процесс сопровождается интенсивным зудом.
Гистамин является естественным лигандом для четырех типов связанных с мембраной рецепторов (Н₁, Н₂, Н₃, Н₄), из которых наиболее изучены H₁- и H₂-рецепторы. Н₁-рецепторы (постсинаптические) представлены на клетках гладких мышц бронхов, пищеварительной системы, мочевого пузыря, сердца и сосудов, головного мозга. Н₂-рецепторы (постсинаптические) локализуются на клетках слизистой оболочки желудка, матки, головного мозга. Активация Н₁-рецепторов гистамина на эндотелиальных и гладкомышечных клетках приводит к увеличению проницаемости капилляров, а активация Н₂-рецепторов – к вазодилатации артериол и венул.
Хорошо известно, что гистамин – важнейший медиатор аллергических реакций немедленного типа, который обладает широким спектром биологической активности, осуществляемой путем активации клеточных поверхностных специфических рецепторов. Свободный гистамин вызывает повышение проницаемости сосудов, отек, гиперсекрецию и спазм гладкой мускулатуры. Собственно, именно эти эффекты гистамина блокируют антигистаминные препараты (рис. 2). Однако из тучной клетки высвобождаются и другие медиаторы, которые также являются фармакологически активными субстанциями и участвуют в формировании уртикарных элементов. Вероятно, что именно это объясняет случаи неэффективности антигистаминных препаратов при крапивнице. В частности, таким фармакологически активным медиатором тучной клетки является ФАТ.
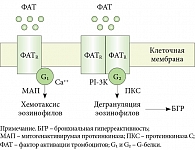
ФАТ – семейство структурно родственных физиологически активных фосфолипидов, синтезируемых клетками воспаления (базофилы, тучные клетки, макрофаги, нейтрофилы, эндотелиальные клетки) под воздействием бактерий и вирусов, иммунных комплексов, компонентов комплемента (С3А, С5А), а также в результате IgЕ-опосредованной стимуляции тучных клеток и базофилов. ФАТ обладает следующими свойствами:
- вызывает агрегацию тромбоцитов, активирует тучные клетки легких человека;
- вызывает дегрануляцию эозинофилов мышей и человека; привлекает эозинофилы и нейтрофилы, активирует их;
- при ингаляционном пути введения может вызвать кратковременную бронхиальную гиперреактивность и бронхоконстрикцию;
- повышает сосудистую проницаемость, причем это действие в 1000 раз более сильное, чем у гистамина;
- стимулирует биосинтез циклооксигеназных (тромбоксан А2) и липоксигеназных (цис-лейкотриены) продуктов [3–6].
Фармакологические эффекты ФАТ, так же как и гистамина, осуществляются через специальные рецепторы на клетках (рис. 3). В исследовании K. Grandel и соавт. [7] изучалась роль ФАТ в патогенезе холодовой крапивницы. У части больных была отмечена корреляция клинического эффекта доксепина с ингибицией ФАТ, но не гистамина, что может косвенно указывать на определенную роль этого медиатора в развитии холодовой крапивницы.
Лечение крапивницы
Два основополагающих направления лечения крапивницы – это, во-первых, поиск и исключение причины уртикарных высыпаний, а во-вторых, фармакотерапия, облегчающая/контролирующая симптомы. Безусловно, первая линия терапии наиболее эффективна, однако определить этиологический триггер крапивницы не всегда возможно. По этой причине при любой форме крапивницы чаще всего назначается симптоматическая фармакотерапия. С учетом ведущей роли гистамина в патогенезе крапивницы препаратами первой линии для контроля симптомов у всех больных крапивницей являются антигистаминные препараты.
Существует две группы антигистаминных препаратов: первого поколения (седативные) и второго поколения (неседативные) (табл. 2). Использование антигистаминных препаратов первого поколения ограничивается их побочными эффектами: выраженным седативным действием, антихолинергическим, антиадренергическим эффектами, коротким периодом действия, быстрым развитием тахифилаксии. Описаны неблагоприятные, потенцирующие взаимодействия этой группы антигистаминных препаратов с алкоголем, психотропными и снотворными средствами.
Антигистаминные препараты второго поколения являются высокоселективными блокаторами Н₁-гистаминовых рецепторов. Эти препараты характеризуются быстрым наступлением эффекта (в течение 1–2 часов), который сохраняется до 12–24 часов, что позволяет применять их один, максимум два раза в сутки. Они оказывают незначительное седативное действие, которое, как правило, не отличается от такового при приеме плацебо, или совсем лишены его. Неседативные антигистамины незначительно влияют или не влияют совсем на холинергические и адренергические рецепторы.
Антигистаминные препараты второго поколения эффективно купируют симптомы крапивницы, причем этот эффект дозозависимый [8]. В экспериментальных исследованиях было показано, что спектр их фармакологической активности не ограничивается лишь связыванием с H₁-гистаминовыми рецепторами, с которыми они взаимодействуют по принципу обратных агонистов, стабилизируя Н₁-рецептор в неактивном состоянии [9]. Антигистаминные препараты подавляют высвобождение провоспалительных медиаторов (гистамина, лейкотриенов), снижают экспрессию адгезионных молекул (молекула межклеточной адгезии 1-го типа (intercellular adhesion molecule-1) и Р-селектина) и некоторых цитокинов (интерлейкинов 4, 6, 8, 13-го типов, гранулоцитарно-макрофагального колониестимулирующего фактора (granulocyte-macrophage colony-stimulating factor – GM-CSF)). Все эти данные позволяют предположить о наличии у современных антигистаминных препаратов противовоспалительного эффекта, опосредованного даун-регуляцией, то есть снижением экспрессии транскрипционных факторов, таких как ядерный фактор каппа B (nuclear factor kappa B – NF-kappa B) и активирующий протеин 1 (АР-1), отвечающих за синтез провоспалительных цитокинов и молекул адгезии
(рис. 2) [10].
В соответствии с рекомендациями Европейской академии аллергологии и клинической иммунологии (European Academy of Allergology and Clinical Immunology – EAACI), Европейского консорциума по изучению аллергических заболеваний и бронхиальной астмы (Global Allergy and Asthma European Network – GA2LEN), Европейского дерматологического форума (European Dermatology Forum, EDF), Всемирной организации по аллергии (World Allergy Organization – WAO) первое поколение антигистаминных препаратов не должно использоваться в качестве препаратов первого выбора, за исключением ситуаций, когда преимущества их применения перевешивают риски, или в случае невозможности применения антигистаминных препаратов второго поколения по каким-либо причинам [11]. Например, при необходимости парентерального введения антигистаминного препарата. Как известно, парентеральных форм антигистаминных препаратов второго поколения пока не существует.
В рекомендациях EAACI/GA2LEN/EDF/WAO представлен алгоритм терапии хронической спонтанной крапивницы (рис. 4) [11]. Начинать терапию следует с назначения неседативного антигистаминного препарата, при сохранении симптомов дозу можно увеличить в два – четыре раза. Этот подход рекомендован европейскими и мировыми экспертами и довольно широко распространен, несмотря на то что четырехкратная доза ни одного антигистаминного препарата не одобрена для клинического применения вследствие прежде всего недостаточной доказательной базы в отношении безопасности. Вместе с тем эффективность высоких доз антигистаминных препаратов продемонстрирована в ряде клинических исследований и подтверждена реальной врачебной практикой [11].
Следует отметить, что около 85% рецепторов гистамина в коже относятся к H₁-рецепторам, а остальные 15% – к Н₂-рецепторам. Данный факт обусловливает приоритет использования для лечения крапивницы антигистаминных препаратов, являющихся блокаторами Н₁-рецепторов. Добавление антагонистов Н₂-рецепторов к Н₁-антигистаминным препаратам иногда усиливает эффект последних за счет максимальной блокады рецепторов [11, 12].
Возможность применения антилейкотриеновых препаратов при хронической крапивнице обосновывается тем, что цистеиниловые лейкотриены могут быть задействованы в образовании волдырей у некоторых пациентов в связи, например, с непереносимостью аспирина и нестероидных противовоспалительных средств или у пациентов с тяжелой резистентной крапивницей [13–15]. Однако антагонисты лейкотриеновых рецепторов пока не одобрены для лечения крапивницы. Кроме того, по сравнительной эффективности они уступают антигистаминным препаратам и могут рассматриваться только как дополнительные средства.
Применение циклоспорина при тяжелой резистентной хронической крапивнице, равно как и терапия ингибиторами кальциневрина (такролимус), являющимися продуктами дальнейшей разработки молекулы циклоспорина А, относится к терапии крапивницы третьей линии и требует дополнительных исследований для определения оптимальной дозы и схемы приема, позволяющей достигнуть эффекта с минимальным риском развития побочных явлений.
Подтвердил свою эффективность при хронической крапивнице омализумаб. В недавно опубликованном рандомизированном двойном слепом плацебоконтролируемом исследовании у 323 пациентов со среднетяжелой и тяжелой хронической идиопатической крапивницей, резистентной к антигистаминным препаратам, изучали разные дозы омализумаба: 75, 150 или 300 мг, назначаемые с интервалом в 4 недели [18]. Дозы 150 и 300 мг оказались значимо эффективнее плацебо в отношении уменьшения зуда и тяжести симптомов крапивницы, при этом частота нежелательных эффектов при применении разных доз не различалась.
Системные глюкокортикостероиды, как правило, назначаются и демонстрируют эффективность в случае выраженного обострения крапивницы (рис. 4), когда действия антигистаминных препаратов недостаточно. После купирования обострения системные глюкокортикостероиды должны быть отменены, а терапия антигистаминными препаратами продолжена. В редких ситуациях при хронической крапивнице, когда необходимо системное лечение глюкокортикостероидами, следует использовать низкую суточную дозу (титровать ее до минимально эффективной) или назначать прием препарата через день. Однако долгосрочная терапия системными глюкокортикостероидами не рекомендуется [11].
Таким образом, неседативные антигистаминные препараты второго поколения в обычных или повышенных дозах являются препаратами первого выбора для лечения крапивницы.
Клиническая эффективность рупатадина в лечении крапивницы
Рупатадин (Рупафин®) – антигистаминный препарат второго поколения, относительно недавно появился на отечественном фармацевтическом рынке. Особенностью молекулы рупатадина является способность оказывать антагонистическое действие не только по отношению к Н₁-гистаминовым рецепторам (к которым рупатадин обладает высоким сродством), но и к ФАТ-рецепторам. Исследования рупатадина в высокой концентрации in vitro показали подавление дегрануляции тучных клеток, вызванной иммунологическими и неиммунологическими раздражителями, подавление хемотаксиса эозинофилов и нейтрофилов, а также высвобождения цитокинов (интерлейкина 5, 6, 8-го типов, GM-CSF), фактора некроза опухоли альфа из тучных клеток и моноцитов человека. Кроме того, рупатадин вызывал дозозависимое подавление экспрессии молекул адгезии нейтрофилов [19–22]. Вследствие селективности рупатадина в отношении периферических Н₁-гистаминовых рецепторов он не оказывает значительного влияния на активность центральной нервной системы в дозах 10 или 20 мг/сут [22]. Некоторые из его метаболитов (дезлоратадин и 3-гидроксидезлоратадин) сохраняют антигистаминную активность и могут вносить свой вклад в общую эффективность препарата. Поскольку выброс гистамина является ключевым звеном патогенеза всех видов крапивницы, ожидается, что при назначении рупатадина в соответствии с клиническими рекомендациями он сможет эффективно уменьшать выраженность симптомов не только хронической идиопатической, но и других вариантов крапивницы, что было продемонстрировано в ряде исследований [23, 24]. Препарат выпускается в виде таблеток, содержащих 10 мг рупатадина, и рекомендуется к однократному применению в день для cимптоматического лечения аллергического ринита и крапивницы у взрослых и подростков (старше 12 лет).
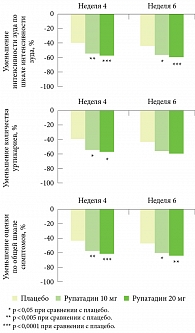
Эффективность рупатадина при хронической идиопатической крапивнице была продемонстрирована в нескольких рандомизированных клинических исследованиях [25, 26]. A. Gimenez-Arnau и соавт. [25] провели двойное слепое плацебоконтролируемое исследование, в котором сравнивали эффективность двух доз рупатадина (10 и 20 мг) у 333 больных среднетяжелой и тяжелой хронической идиопатической крапивницей. Терапия рупатадином оказалась значимо эффективнее плацебо в отношении уменьшения кожного зуда, количества уртикарных элементов и общей выраженности симптомов крапивницы, причем эта разница была отмечена уже через неделю лечения и сохранялась на протяжении всего курса (6 недель) (рис. 5). Обе дозы рупатадина имели благоприятный профиль безопасности и в основном хорошо переносились пациентами. Однако больные, получавшие 10 мг препарата, реже отмечали сонливость, частота которой составила 5,3, 2,7 и 8,3% для плацебо и рупатадина 10 и 20 мг соответственно. Учитывая полученные результаты, авторы пришли к выводу, что рупатадин в дозе 10 мг является эффективным и безопасным препаратом для лечения среднетяжелой и тяжелой хронической идиопатической крапивницы, при этом эффект препарата наступает быстро и длится долго.
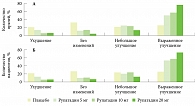
В другом исследовании также были отмечены эффективность и безопасность 10 и 20 мг рупатадина у больных хронической идиопатической крапивницей [26]. В ходе этого исследования эффективность лечения оценивали врачи, проводившие исследование, и пациенты (рис. 6). Большинство врачей и пациентов отметили выраженное улучшение на фоне приема 10 и особенно 20 мг рупатадина, что еще раз свидетельствует о дозозависимой эффективности антигистаминных препаратов при хронической крапивнице.
Особый интерес представляют исследования по изучению эффективности рупатадина у больных холодовой крапивницей. Учитывая уже упоминавшееся выше исследование K. Grandel и соавт. [7], можно предположить более значимую эффективность рупатадина по сравнению с другими антигистаминными препаратами у данной категории больных. В рандомизированном двойном слепом плацебоконтролируемом исследовании M. Metz и соавт. оценивали эффективность 20 мг/сут рупатадина в предотвращении уртикарной реакции в ответ на холодовую провокацию у больных с приобретенной холодовой крапивницей [27]. Главным критерием оценки являлся период времени от момента холодового воздействия до появления уртикарных элементов. Этот период увеличился на 1,9 и 0 минут в результате применения рупатадина и плацебо соответственно (p = 0,004). Кроме того, на фоне рупатадина в отличие от плацебо значимо снижалась пороговая температура холодового воздействия, оценивавшаяся с помощью устройства TempTest 3.0 (EMO Systems GmbH, Германия). 52% (11 из 21) пациентов полностью ответили на терапию рупатадином: у них отсутствовали уртикарные высыпания после провокации кубиком льда. В этом исследовании была отмечена хорошая переносимость рупатадина в дозе 20 мг в день: 4 пациента чувствовали легкую усталость на фоне лечения, 1 – сонливость и 1 – головную боль. Авторы пришли к заключению, что рупатадин в дозе 20 мг в день является эффективным и хорошо переносимым препаратом для лечения приобретенной холодовой крапивницы.
Эффективность рупатадина в предотвращении локальной аллергической реакции на укусы комаров была изучена в плацебоконтролируемом исследовании A. Karppinen и соавт. [28]. Кожная реакция и зуд оказались почти вполовину менее выражены на фоне предварительного применения рупатадина по сравнению с плацебо, что говорит об эффективности препарата в данной группе пациентов.
Заключение
Острая и хроническая крапивница является распространенным заболеванием у детей, подростков и взрослых и существенно снижает качество жизни пациентов. Гистамин играет ведущую роль в формировании крапивницы, поэтому препаратами первой линии для контроля симптомов у всех больных крапивницей являются антигистаминные препараты. Рупатадин – антигистаминный препарат второго поколения, способный оказывать антагонистическое действие по отношению к Н₁-гистаминовым рецепторам и рецепторам фактора активации тромбоцитов, – является эффективным и безопасным препаратом для купирования симптомов острой крапивницы, контроля симптомов хронической и приобретенной холодовой крапивницы.
N.M. Nenasheva
Russian Medical Academy of Continuous Professional Education
Contact person: Natalya Mikhaylovna Nenasheva, 1444031@gmail.com
The article addresses the management of acute and chronic urticaria. Standard or high doses of non-sedating second-generation antihistamines are regarded as first-choice therapy for urticaria. Rupatadine is an antihistaminic agent exerting additional antagonistic effects on some other allergic mediators involved in urticaria formation. Clinical studies have demonstrated efficacy and safety of rupatadine in acute, chronic and acquired cold urticaria.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.