Современные подходы к управлению постпрандиальной гипергликемией у пациентов с сахарным диабетом типа 2
- Аннотация
- Статья
- Ссылки








Цели гликемического контроля: современный взгляд на проблему
Количество больных сахарным диабетом 2 типа (СД 2) неуклонно возрастает. Эксперты говорят о том, что количество невыявленного сахарного диабета (СД) может превышать регистрируемый сегодня уровень в 2-3 раза. С учетом большой опасности хронической (и часто не осознаваемой пациентами и даже врачами) декомпенсации СД, в последние годы разработаны жесткие критерии компенсации (точнее сказать, цели лечения) СД 2. Основными принципами лечения СД 2 в настоящее время являются: диета, физические нагрузки, пероральные сахароснижающие препараты, инсулин, обучение больных, самоконтроль показателей обмена веществ, раннее лечение осложнений и сопутствующих заболеваний.
Подбор адекватной сахароснижающей терапии и достижение желаемой степени компенсации заболевания у больных СД 2 представляют определенные сложности. Это обусловлено значительной гетерогенностью СД 2, которая затрудняет поиск патогенетического лечения в каждом конкретном случае. Назначение пероральных сахароснижающих препаратов (ПССП) рекомендуется при впервые выявленном СД 2, если правильное соблюдение диеты в сочетании с физическими нагрузками не приводит к компенсации углеводного обмена. Традиционно лечение СД 2 начинают с монотерапии метформином или ПСМ и только при выраженном ухудшении гликемического контроля добавляют второй препарат или инсулин. Такая тактика приводит к тому, что достаточно большая часть больных СД 2 постоянно находятся в состоянии неудовлетворительной компенсации, имея уровень гликированного гемоглобина (HbA1C) не ниже 9%. Логичным представляется интенсивное воздействие в возможно более ранние сроки на оба патогенетических звена. Такая терапия создает меньший риск тяжелых побочных эффектов. В настоящее время используются готовые комбинации ПСМ и метформина. Число больных СД 2, требующих лечения инсулином, неуклонно возрастает, уже давно превысив количество больных СД 1. В ряде случаев инсулин должен назначаться очень рано, если не вообще с самого начала заболевания. В настоящее время отечественная диабетология обладает полным арсеналом терапевтических средств для лечения СД 2, включая самые современные препараты, средства самоконтроля гликемии и программы обучения больных. Все это позволяет обеспечить хороший гликемический контроль и высокое качество жизни больных, отдалив развитие тяжелых хронических осложнений заболевания.
Роль гормонов инкретина в регуляции углеводного обмена
Сахарный диабет – состояние, угрожающее жизни. И если говорить о том, что в основе заболевания лежат инсулинорезистентность и относительный дефицит инсулина, то в данном случае слово дефицит не предполагает нехватку инсулина – его, иногда больше, чем у здорового человека. Это – дефицит периферических тканей по отношению к инсулину. Все ли возможности мы используем в лечение сахарного диабета? Сейчас много внимания уделяется инкретинам. Инкретины – это гормоны желудочно-кишечного тракта, вызывающие стимуляцию секреции инсулина после приема пищи. Известны они достаточно давно, еще с 1932 года. До 70% постпрандиальной секреции инсулина у здоровых людей обусловлено именно эффектом инкретинов, который значительно снижен у больных СД 2. Двумя самыми важными инкретинами являются:
-
глюкозозависимый инсулинотропный полипептид (ГИП);
-
глюкагон-подобный пептид (ГПП-1).
У здоровых людей ГПП-1 является одним из самых сильных стимуляторов секреции инсулина. Физиологические эффекты ГПП-1 реализуются после его взаимодействия со специфическими рецепторами, расположенными во многих органах и тканях: поджелудочной железе, желудке, тонком кишечнике, мозге, гипофизе, легких, почках, сердце. Активность ГПП-1 в отношении инсулина обусловлена взаимодействия ГПП-1 со специфическими рецепторами, расположенными на мембране β-клетки. Экспериментальное введение ГПП-1 вызывает снижение концентрации глюкозы крови до уровня гликемии натощак. Как только уровень гликемии приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается. Таким образом, ГПП-1 не может вызывать выраженную гипогликемию, что чрезвычайно важно. Действие ГПП-1 способствует адекватному секреторному ответу β-клеток на уровень глюкозы. Важным физиологическим эффектом ГПП-1 является подавление секреции глюкагона. В исследованиях был показан цитопротективный эффект ГПП-1, включающий увеличение массы β-клеток, стимуляцию неогенеза островков Лангерганса. В последнее время терапевтические подходы к лечению СД 2 связывают с активностью ГПП-1, которую модулируют миметиками ГПП-1. Препарат эксенатид (Баета) является наиболее изученным. Это пептид, выделенный из слюнных желез ящерицы Gila monster, на 53% аналогичный строению человеческому ГПП-1. По данным исследования больных СД типа 2, в группе получавших подкожно 10мг Баеты, зафиксировано снижение уровня HbA1c на 0,9%, у получавших 5 мг – на 0,6%. Уровень HbA1c < 7% был достигнут у 34,2% больных, получавших 10 мг Баеты, и у 26,7% больных, получавших 5 мг Баеты. Помимо этого, в I группе больных (10 мг Баеты) наблюдалось снижение веса на 1,9 кг. Через 26 недель у всех больных наблюдалось улучшение контроля гликемии и почти одинаковое снижение показателей HbA1с. Дополнительным эффектом лечения Баетой явилось снижение массы тела больных, в то время как на фоне лечения инсулином гларгин больные прибавили в весе. Гипогликемия натощак реже возникала у больных, получавших Баету. Еще в одном исследовании было продемонстрировано снижение уровня глюкагона на фоне терапии эксенатидом, что является значительным преимуществом этого препарата по сравнению с другими. Побочным эффектом терапии Баетой является тошнота, проходящая через одну-две недели. Легкость в применении препарата, снижение гликемии (как натощак, так и постпрандиальной), гликированного гемоглобина и уменьшение массы тела выгодно отличают Баету от существующих антидиабетических препаратов. Прием препарата должен начинаться с минимальной дозы – 5 мкг два раза в день, подкожно. И если возникает необходимость, то после завершения этого курса можно перейти на 10 мкг. Мы лечим больного человека, и у нас все диапазоны лечения индивидуальные. Среди больных есть такие, которые великолепно ответят на низкую дозу, и тогда можно будет продолжать достигать эффекта этими пятью микрограммами.
Разбор клинического случая применения препарата Баета
На кафедре эндокринологии и диабетологии Московского государственного медико-стоматологического института в настоящий момент наблюдается более 50 больных, страдающих сахарным диабетом типа 2, которым проводится терапия препаратом Баета. И закономерно проиллюстрировать наш первый клинический опыт в отношении использования препарата Баета.
Первые больные были включены в наши исследования в 2004 году. Одной из них была пациентка Р., 1953 года рождения, больна диабетом 2 типа с 1999 г. Ее исходные антропометрические данные характеризовались следующим: вес – 107 кг, рост – 167 см, индекс массы тела соответствовал второй степени ожирения и составлял 38,4 кг на метр квадратный. У пациентки была достаточно широкая талия, ее окружность составляла 112 см. Исходный гликемический профиль в 2004 году характеризовался отсутствием контроля гликемии как в отношении показателя сахара натощак (средние показатели гликемии натощак колебались в пределах 8-9 ммоль/л). А постпрандиальные цифры составляли 11-12 ммоль/л, что свидетельствовало о декомпенсации углеводного обмена. Исходная фармакотерапия а именно, сахароснижающая терапия, была представлена комбинацией Манинила-3,5 в дозе 7 мг в сутки, и Сиофора – 1500 мг в сутки. Также проводилась терапия сопутствующих заболеваний. Пациентка принимала препарат Престариум 4 мг в сутки. В дальнейшем, в марте 2004 года, пациентке дополнительно с указанной выше сахароснижающей терапией был назначен препарат Баета. Впервые препарат назначается в режиме по 5 мкг два раза в день. Впервые препарат Баета назначается в двукратном режиме, за 15 минут до завтрака и за 15 минут до ужина. В течение месяца пациентка получала Баету в указанном режиме. В дальнейшем, при хорошей переносимости препарата, начиная со второго месяца терапии доза препарата увеличивается и назначается по-прежнему в двукратном режиме, но уже по 10 мкг в сутки, до завтрака и до ужина.
На фоне проводимой терапии обращала внимание выраженная положительная динамика массы тела пациентки. Если исходно вес больной составлял 107 кг, то к маю 2008 году масса тела составила 80 кг. Результаты многочисленных исследований свидетельствует что даже небольшое снижение массы тела, а именно в пределах одного килограмма, приводит к позитивным изменениям со стороны липидного обмена крови: уменьшается концентрация общего холестерина на 0,05 ммоль/л, ХС ЛПНП – на 0,02 ммоль/л, триглицеридов – на 0,015 ммоль/л.
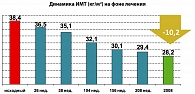
В соответствии с этим, положительная динамика касалась и индекса массы тела. Исходный индекс массы тела составлял 38,4 кг/м2, что соответствовало второй степени ожирения. Спустя четыре года терапии индекс массы тела снизился, и пациентка попала в категорию избыточной массы тела. Ее индекс мысы тела составил 28,2 кг/м2.
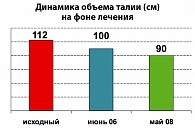
Закономерно мы наблюдали и снижение окружности талии, известного маркера абдоминальной формы ожирения. Составляя исходно 112 см, окружность талии к 2008 году уменьшилась до 90 см.
Снижение массы тела на фоне терапии Баетой сопровождалось и положительной динамикой как систолического, так и диастолического артериального давления. И следует отметить, что изменение артериального давления потребовало снижения, а затем и полной отмены препарата Престариум спустя 28 недель терапии. Наиболее важные изменения касались и динамики гликемии. Как мы уже отмечали выше, исходно уровень гликемии составлял 9,7 ммоль/л. Спустя 8 недель терапии отмечалась положительная динамика гликемии натощак, и медиана снижения гликемии составила 6,9 ммоль/л. Спустя 4 года терапии Баетой, а именно в мае 2008 года, средний уровень гликемии составил 5,2 ммоль/л.
Препарат Баета – первый препарат группы миметиков инкретина – относится к классу препаратов прандиальных регуляторов гликемии. В связи с этим заслуживает внимания динамика гликемии после еды. Исходная медиана гликемии в постпрандиальный период составляла 11,2 ммоль/л. Уже после первой инъекции Баетой наблюдалось снижение показателей гликемии после еды. И, спустя 4 недели терапии, потребовалась коррекция сопутствующей сахароснижающей терапии, а именно доза Манинила была снижена и составила 3,5 мг в сутки. В дальнейшем, спустя 9 недель терапии, мы снизили суточную дозу препарата Манинила до 1,75 ммоль/л. Спустя год терапии вновь была произведена коррекция суточной дозы Манинила. Через три года препарат Манинил был полностью отменен в связи со значительным улучшением показателей гликемии.
В первую очередь следует отметить такие достоинства препарата Баета, как отсутствие риска гипогликемических состояний. Препарат Баета обладает влиянием на секреторный аппарат бета-клетки опосредованно за счет глюкозозависимого механизма. То есть препарат Баета стимулирует выброс инсулина до той поры, пока сохраняется повышение уровня глюкозы в постпрандиальный период. При нормализации показателей гликемии в постпрандиальный период стимулирующее действие препарата Баета на функцию бета-клеток прекращается. И, соответственно, подавляющее влияние не секрецию глюкагона тоже осуществляется опосредованно, за счет глюкозозависимых механизмов. Что это означает? В первую очередь то, что снижение уровня гликемии до определенного предела в постпрандиальный период тоже в дальнейшем приводит к отсутствию подавляющего действия Баеты на функцию альфа-клеток. Поэтому в целом Баета характеризуется низким риском гипогликемических состояний. И в случае возникновения у больных гипогликемических состояний закономерно снизить на 30-50% суточную дозу препаратов, относящихся к классу секретогогов. Смысл этого состоит в том, что механизм действия препарата чисто глюкозозависимый, когда глюкоза снижается до определенного предела, то прекращается стимулирующее действие Баеты на функцию бета-клеток, и инсулин уже не выбрасывается в больших концентрациях. Параллельно происходит подавление функции альфа-клеток, которые вырабатывают глюкагон, когда уровень сахара снизился до определенного предела. Тем самым Баета не вызывает повышенный риск гипогликемических состояний. Это очень важно. На практике мы отметили, что при возникновении гипогликемий, они, в первую очередь, связаны с приемом препаратов класса секретогогов, и мы их дозу корригируем, снижаем на 30-50%. И вот получается, что в 2007 году, через три года, мы полностью отменили Манинил.
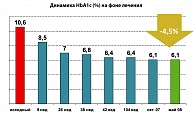
Положительная динамика, касающаяся показателей изменения гликемии натощак и постпрандиально, отразилась и на уровне гликозилированного гемоглобина. Если в 2007 году уровень гликозилированного гемоглобина нашей пациентки составлял 10,6%, то спустя 4 года терапии он снизился и составил 6,5%. Результаты крупнейших эпидемиологических исследований свидетельствуют, что снижение гликозилированного гемоглобина даже на 1% приводит к клинически значимому снижению риска осложнений.
Таким образом, на протяжении терапии Баетой в течение 4 лет мы наблюдали положительную динамику клинического состояния больной: снижение массы тела составило 27 кг, что закономерно отразилось на динамике индекса массы тела, которое за указанный период времени составило 10,2 кг/м2. В результате окружность талии снизилась на 22 см.
Обращала внимание стабилизация уровня артериального давления, причем антигипертензивную терапию больная уже не получала.
Уровень гликозилированного гемоглобина в динамике снизился на 4,5%.
Спустя четыре года терапии у больной была достигнута долгосрочная компенсация показателей углеводного обмена. О чем свидетельствуют показатели гликемии натощак и через два часа после еды. Важно отметить, что это долгосрочная, а не одномоментная компенсация.
В заключении следует отметить, что в настоящий момент фармакотерапия пациентки Р. представлена приемом препарата Метформин 500 мг на ночь в комбинации с инъекциями Баеты по 10 мкг 2 раза в день, за 15 минут до завтрака и ужина. Никакой терапии сопутствующих заболеваний не проводится. То есть пациентка получает на настоящий момент только два препарата.
И в клиническом плане нас очень волнует ситуация, что происходит с больными, которые имеют избыточную массу тела, но которые еще не достигают крайних степеней ожирения. Насколько потенциально препарат Баета влияет на их массу тела? И для этого следует привести еще один клинический пример. Это больная С. Из анамнеза известно, что она страдала сахарным диабетом с 1993 года и имела избыточную массу тела, о чем свидетельствовал индекс массы тела, который составлял 27,4 кг/м2. Окружность ее талии составила 86 см, исходный гликозилированный гемоглобин составлял 9,9% на фоне следующей сахароснижающей терапии. Пациентка получала Диабетон 320 мг в сутки в комбинации с Сиофором 850 мг 2 раза в день. В дальнейшем к указанной сахароснижающей терапии был назначен препарат Баета. И, на фоне комбинации из трех препаратов, был достигнут контроль углеводного обмена, о чем свидетельствовала положительная динамика гликозилированного гемоглобина. За 4 года терапии гликозилированный гемоглобин снизился на 3,3%. И, соответственно, положительные изменения касались гликемии натощак и постпрандиальной гликемии.
В отношении веса следует отметить, что через два года терапии пациентка снизила массу тела до нормальной, и в дальнейшем, спустя год терапии, масса тела уже не менялась. Баета способствует восстановлению физиологического контроля пищевого поведения, и на этом фоне пациентки достигают нормальной массы тела, и снижение массы тела в дальнейшем приостанавливается.
Ящерица Хила, обитающая в Аризоне в бассейне реки Хила, – самая крупная из всех ящериц в Северной Америке. Особый научный интерес представляет тот факт, что организм ящерицы прекрасно адаптирован к редкому употреблению больших объемов пищи. Взрослые особи способны потребить за один раз количество, составляющее около одной трети их веса, и питаться три-четыре раза в год. В процессе поглощения пищи модифицированная слюнная железа ящерицы секретирует особое вещество – эксентид-4, которое, поступая в пищеварительный тракт и далее в систему кровообращения, обеспечивает равномерное потребление тканями питательных веществ в течение длительного периода.
В начале 90-х годов прошлого века исследователи обнаружили, что действие эксентид-4 ящерицы Хила очень похоже на действие гормона, вырабатываемого эндокринными клетками пищеварительного тракта человеческого организма, – глюкагоноподобного пептида-1 (ГПП-1). Но по сравнению с ГПП-1, эксентид-4 обладает существенно большей продолжительностью действия. Это открытие послужило основой для создания компанией Eli Lilly и Amylin Pharmaceuticals синтетического аналога эксендина-4 для лечения СД типа 2, названного эксенатид. Эксенатид – это первый инкретино-миметик, относящийся к новому классу сахароснижающих препаратов для лечения диабета 2 типа. С помощью двух подкожных инъекций эксенатида в день с фиксированной дозой можно достичь долговременного улучшения гликемического контроля, сопровождающегося снижением веса у пациентов с сахарным диабетом 2 типа. Именно этот препарат станет прорывом в лечении диабета в ближайшие десятилетия.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.