Сравнительное клинико-иммунологическое исследование эффективности комплексного послеоперационного лечения, включающего программы иммуномодулирующей терапии Имунофаном
- Аннотация
- Статья
- Ссылки
- English
Цель – провести сравнительное клинико-иммунологическое исследование эффективности разработанных программ иммуномодулирующей терапии с использованием Имунофана, включенных в комплексное послеоперационное лечение, с традиционными методами послеоперационного лечения детей с различными формами нетипично протекающих острых перитонитов.
Материал и методы. В исследовании приняли участие иммунокомпрометированные дети в возрасте от 5 до 12 лет с различными формами ОП, находившиеся на традиционной и комплексной (с включением Имунофана) терапии. Группу 1 составили дети с местным неотграниченным ОП, группу 2 – с разлитым ОП.
У пациентов были определены субпопуляции НГ CD16+CD64-CD32+CD11b+ и CD16+CD64+CD32+CD11b+, фенотип по плотности экспрессии рецепторов (MFI) (FC 500, Beckman Coulter, США), фагоцитарная и NADHP-оксидазная активность до и после лечения.
Результаты. Показана клинико-иммунологическая эффективность разработанных программ иммуномодулирующей терапии, включенных в комплексное послеоперационное лечение детей с различными формами ОП, в частности отсутствие послеоперационных осложнений, быстрый регресс симптомов интоксикации, раннее удаление дренажей на фоне восстановления адекватного функционирования НГ, связанного с реорганизацией негативно трансформированных субпопуляций НГ.
Заключение. Клинико-иммунологические эффекты разработанных программ с использованием Имунофана обусловливают целесообразность их применения у иммунокомпрометированных детей с ОП. Их реализация будет способствовать уменьшению курсов антибактериальных препаратов, количества дней пребывания в стационаре и длительности реабилитационного периода, а также улучшению качества жизни пациентов.
Цель – провести сравнительное клинико-иммунологическое исследование эффективности разработанных программ иммуномодулирующей терапии с использованием Имунофана, включенных в комплексное послеоперационное лечение, с традиционными методами послеоперационного лечения детей с различными формами нетипично протекающих острых перитонитов.
Материал и методы. В исследовании приняли участие иммунокомпрометированные дети в возрасте от 5 до 12 лет с различными формами ОП, находившиеся на традиционной и комплексной (с включением Имунофана) терапии. Группу 1 составили дети с местным неотграниченным ОП, группу 2 – с разлитым ОП.
У пациентов были определены субпопуляции НГ CD16+CD64-CD32+CD11b+ и CD16+CD64+CD32+CD11b+, фенотип по плотности экспрессии рецепторов (MFI) (FC 500, Beckman Coulter, США), фагоцитарная и NADHP-оксидазная активность до и после лечения.
Результаты. Показана клинико-иммунологическая эффективность разработанных программ иммуномодулирующей терапии, включенных в комплексное послеоперационное лечение детей с различными формами ОП, в частности отсутствие послеоперационных осложнений, быстрый регресс симптомов интоксикации, раннее удаление дренажей на фоне восстановления адекватного функционирования НГ, связанного с реорганизацией негативно трансформированных субпопуляций НГ.
Заключение. Клинико-иммунологические эффекты разработанных программ с использованием Имунофана обусловливают целесообразность их применения у иммунокомпрометированных детей с ОП. Их реализация будет способствовать уменьшению курсов антибактериальных препаратов, количества дней пребывания в стационаре и длительности реабилитационного периода, а также улучшению качества жизни пациентов.




Введение
Ухудшение экологической обстановки и влияние различных неблагоприятных антропогенных факторов обусловливают неуклонный рост числа вторичных дисрегуляторных расстройств иммунной системы с поражением различных ее звеньев. На фоне развития тяжелых гнойно-воспалительных процессов или рецидивирующих гнойно-воспалительных заболеваний (ГВЗ) основной причиной этого может являться дефект работы основных эффекторных и регуляторных клеток врожденного иммунитета – нейтрофильных гранулоцитов (НГ). При дисфункции в системе НГ невозможно реализовать адекватную противомикробную защиту, что приводит к развитию тяжело протекающих инфекционно-воспалительных заболеваний (ИВЗ), зачастую полиэтиологичных, характеризующихся рецидивированием и/или хронизацией инфекционно-воспалительного процесса.
Описаны различные дисфункции НГ c нарушением фагоцитарной и микробицидной активности [1, 2]. Неадекватное реагирование или отсутствие ответа НГ на внедрение патогенных микроорганизмов является причиной вялотекущих хронических ИВЗ, при которых использование только традиционной терапии недостаточно эффективно [3]. Нарушение функционирования НГ может стать причиной не только повышения заболеваемости ИВЗ, но и инвалидизации и даже высокой летальности при тяжелых ГВЗ [4, 5].
Нарушению функционирования НГ способствуют многие внутренние и внешние факторы, такие как дефицит питательных веществ в организме, персистирующие инфекции, нарушение нормальной микрофлоры открытых и закрытых слизистых оболочек и кожи, частое использование антибактериальных препаратов.
НГ осуществляют противобактериальную защиту путем фагоцитоза, трансмембранной дегрануляции, продукции цитокинов, образования нейтрофильных внеклеточных ловушек (NET) и эктосом [6, 7], изменяя свой фенотип с формированием новых субпопуляций, обладающих различной функциональной активностью [8, 9]. Основополагающие эффекторные процессы НГ находятся в прямой зависимости от плотности экспрессии мембранных рецепторов CD16 (FcγRIII), CD32 (FcγRII), CD11b (Mac-1/CR3A), CD64 (FcγRI), формирующих определенный фенотип клетки, а также от их кооперации. В результате кооперации могут быть запущены механизмы эффективного фагоцитоза или дегрануляции, кислородного взрыва или формирования NETs [3].
Особой проблемой является рост числа заболеваемости острым перитонитом (ОП) среди детей и связанных с ним осложнений, что диктует необходимость поиска и разработки новых тактических приемов лечения [10, 11]. С учетом того что в основе иммунопатогенеза ОП лежат дисфункции НГ, ассоциированные с негативной трансформацией фенотипа и количественного содержания функционально-значимых субпопуляций НГ, представляется необходимым разработка программ иммуномодулирующей терапии, направленных на восстановление нормального функционирования НГ, способствующих оптимизации лечения и профилактике послеоперационных осложнений у иммунокомпрометированных детей с ОП.
Определенный интерес в связи со сказанным ранее представляет иммунотропная субстанция синтетический гексапептид (ГП) – аргинил-α-аспартил-лизил-валил-тирозил-аргинин. Это аналог активного центра гормона тимуса – тимопоэтина, обладающий всеми биологическими эффектами нативного гормона [12, 13]. ГП оказывает положительное иммунорегуляторное воздействие на дефектно функционирующую иммунную систему, осуществляет регуляцию и восстановление Т-клеточного звена, нормализацию синтеза цитокинов, влияя на численность и активность НГ, моноцитов, усиливает эффективность антибактериальной терапии. Известны гепатопротективные и антиоксидантные свойства ГП, позволяющие профилактировать множественную лекарственную резистентность [12]. ГП является активной субстанцией отечественного препарата Имунофан, разрешенного к применению у детей с двух лет.
Имунофан хорошо зарекомендовал себя в лечении вторичных иммунных нарушений адаптивного иммунитета при ГВЗ [14, 15]. Однако его целенаправленное действие на НГ остается неизученным, поэтому представляет определенный научный и практический интерес.
Цель исследования
Целью нашего исследования стала сравнительная клинико-иммунологическая оценка эффективности разработанных программ иммуномодулирующей терапии с использованием Имунофана, включенных в комплексное послеоперационное лечение, с традиционными методами послеоперационного лечения детей с различными формами нетипично протекающих острых перитонитов.
Материал и методы
Для реализации проекта осуществляли иммунофенотипирование с помощью FC 500 (Beckman Coulter, США) и МКАТ (Beckman Coulter International S.A., Франция) НГ периферической крови (ПК) условно здоровых детей, детей с местным неотграниченным ОП (группа 1) и разлитым ОП (группа 2) до и после лечения, а также при выполнении экспериментальной части исследования в системе in vitro.
С учетом клинической симптоматики, клинико-лабораторных показателей и этапов исследования были сформированы следующие группы (табл. 1).
Методом последовательного гейтирования определяли процентное соотношение субпопуляций НГ CD16+СD64-СD32+СD11b+ и CD16+СD64+СD32+СD11b+, плотность экспрессии изучаемых рецепторов – с использованием показателя интенсивности флуоресценции (mean fluorescence intensity – MFI). Параллельно оценивали функциональный потенциал НГ. Для оценки фагоцитарной функции НГ образцы ПК инкубировали с Staphylococcus aureus (штамм 209) в течение 120 минут при температуре 37 ºC. Определяли также содержание активно фагоцитирующих НГ (%ФАН), фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ). Для оценки киллинговой активности рассчитывали процент переваривания (%П), индекс переваривания (ИП). Активность NADРН-оксидазы НГ устанавливали с помощью NBT-спонтанного теста (NBTсп) и нагрузочного теста в системе in vitro (NBTст), позволяющих выявить функциональный эффекторный резерв НГ. Рассчитывали средний цитохимический индекс и процент формазан-позитивных клеток (СЦИсп, %ФПКсп и СЦИст, %ФПКст), по соотношению %ФПК в стимулированном и спонтанном NBT- тестах (%ФПКcт/%ФПКсп) – коэффициент мобилизации (КМ) [16].
Отбор детей в группы проводился на базе хирургического отделения № 1 ГБУЗ «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края с учетом наличия клинических критериальных признаков иммунокомпрометированности [17].
Клинический статус ребенка устанавливали на основании жалоб, данных анамнеза заболевания, жизни и развития, иммунологического анамнеза, оценки объективного статуса и клинического течения основного заболевания.
Математическую обработку полученных результатов проводили с помощью программ Microsoft Exel 2016 и StatPlus 2017. После оценки нормальности распределения лабораторных показателей применяли непараметрические статистические критерии Вилкоксона – Манна – Уитни.
Результаты представлены в виде медианы и 25-го и 75-го квартилей.
Статистически значимые различия определяли при p < 0,05.
Результаты и их обсуждение
При проведении исследования использовался разработанный нами алгоритм иммунодиагностики дефектов функционирования НГ у детей разного возраста с различными нетипично протекающими ГВЗ, который включал оценку критериальных признаков иммунокомпрометированности пациентов [17], количества НГ и особенностей трансформации фенотипов CD16+CD64-CD32+CD11b+НГ и CD16+CD64+CD32+CD11b+НГ, отражающих тяжесть ГВЗ, а также эффекторных функций НГ, а именно фагоцитоз с бактериальным антигеном (БАГ) с параллельной оценкой количества активно фагоцитирующих НГ, процессов захвата, киллинга и переваривания, спонтанной и индуцированной кислород-зависимой микробицидности.
Исходя из анамнеза, в группе 1 частота эпизодов ОРВИ составляла более десяти в год с продолжительностью острого периода более десяти дней, протекающих с осложнениями в виде бактериальных инфекций ЛОР-органов и респираторного тракта шесть и более раз в год и требующих антибактериальной терапии.
В группе 2 частота рекуррентных респираторных инфекций составляла 12 и более в год с продолжительностью заболевания 14–21 дней и более, которые зачастую осложнялись присоединением вторичной бактериальной инфекции верхних и нижних дыхательных путей, ЛОР-органов – восемь раз в год и более, обострением хронических заболеваний респираторного тракта и ЛОР-органов. Детям данной группы назначали антибактериальные препараты курсами – восемь раз в год и более, в том числе парентерально.
Клинические проявления ОП у таких пациентов различались, что во многом зависело от наличия дисфункций НГ.
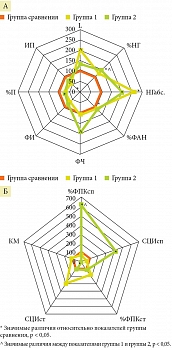
Показано, что у детей с неотграниченным ОП имело место увеличение количества НГ до 12,5 (10,8–19,9) против 6,4 (5,2–7,4) г/л по сравнению с условно здоровыми детьми (р < 0,05). В группе 1 относительно группы сравнения также зафиксировано повышение %ФАН – 60,2 (60,0–74,0)% против 55,3 (50,0–57,0)% (р < 0,05) на фоне снижения показателей переваривающей активности НГ (%П 45,3 (39,8–63,8)% против 62,6 (57,9–62,9)%, ИП 0,9 (0,7–1,2) против 1,6 (1,3–1,9); р1, 2 < 0,05). При этом показатели NADPH-оксидаз – %ФПКсп, СЦИсп находились на том же уровне, что и в группе сравнения (р1, 2 > 0,05), и отмечалась лишь незначительная тенденция к увеличению при стимуляции S. aureus в стимулированном NBT-тесте (р1, 2 > 0,05), что свидетельствовало о низкой микробицидной активности. В группе 2 выявлена блокада ответа со стороны НГ на тяжелый инфекционно-воспалительный процесс: отсутствие увеличения количества циркулирующих НГ в ПК, а также адекватного ответа на дополнительную бактериальную антигенную нагрузку (S. aureus), поскольку значения, отражающие фагоцитарную способность НГ, были аналогичными показателям группы сравнения. Вместе с тем в отличие от группы сравнения активность NADPH-оксидаз значимо увеличилась в спонтанном тесте (%ФПКсп и СЦИсп – 12,5 (3,8–21,0) и 0,37 (0,12–0,62) против 2,0 (1,0–3,7) и 0,09 (0,06–0,11); р1, 2 < 0,05) и резко снизилась при дополнительной стимуляции БАГ (%ФПКст и СЦИст – 4,0 (1,5–14,0) и 0,12 (0,06–0,40) против 2,0 (1,0–3,7) и 0,09 (0,06–0,11); р1 ,2 < 0,05), что свидетельствовало о напряженности и отсутствии резервного микробицидного потенциала НГ (рис. 1).
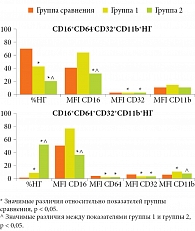
В основе нарушений функциональной активности НГ лежит изменение доли функционально-значимых субпопуляций НГ с негативно трансформированным фенотипом. Так, в группе 1 в отличие от группы сравнения выявлено изменение фенотипов изучаемых субпопуляций за счет перераспределения плотности экспресии: снижения уровня MFI CD32 в обеих субпопуляциях на 62,8 и 26,2% соответственно (р1, 2 < 0,05), снижения уровня MFI СD64 на 56,9% (р < 0,05) и повышения уровня MFI CD11b на 97,9% (р < 0,05) в субпопуляции CD16+CD64+CD32+CD11b+НГ. Кроме того, доля субпопуляции CD16+CD64+CD32+CD11b+НГ увеличилась более чем в 40 раз (p < 0,05) за счет снижения содержания субпопуляции CD16+CD64-CD32+CD11b+НГ на 24% (р < 0,05) (рис. 2, табл. 2 и 3).
При анализе субпопуляционного состава НГ в группе 2 также установлено перераспределение изучаемых субпопуляций: снижение на 69,7% субпопуляции CD16+CD64-CD32+CD11b+НГ (р < 0,05), в группе сравнения повышение с 0,6 (0,3–0,7) до 60,7 (39,5–81,0) субпопуляции CD16+CD64+CD32+CD11b+НГ и изменение их фенотипов CD16dimСD64-CD32dimCD11bmid и CD16dimСD64dimCD32midCD11bdim, что свидетельствовало о снижении способности НГ реализовывать эффекторные функции, быстро элиминировать БАГ и ограничивать воспалительную реакцию на местном уровне и было сопоставимо с тяжестью разлитого ОП (см. рис. 2).
После проведенного стационарного лечения у детей с различными формами ОП, получавших только традиционную терапию (ТТ), были отмечены позитивные клинические эффекты, свидетельствующие об улучшении течения заболевания, однако не нормализовалось функционирование НГ, что в дальнейшем может приводить к развитию послеоперационных осложнений и часто рецидивирующим ГВЗ. Так, в группе 1 ТТ количество активно фагоцитирующих НГ (%ФАН) относительно показателей до лечения снизилось на 34,2% (p < 0,05) с сохранением дефекта переваривающей активности (%П и ИП; р1, 2 > 0,05), микробицидная активность НГ при дополнительной стимуляции БАГ (%ФПКст) – на 86,7%, СЦИст – на 82,6% (p1, 2 < 0,05) с истощением мобилизационного резервного потенциала (р > 0,05). Аналогичное сохранение дефектов НГ было отмечено в группе 2 ТТ. При сравнении с показателями группы 2 также отмечалось снижение активно фагоцитирующих НГ (на 33,9%; p < 0,05), процессов захвата (ФЧ на 52%; p < 0,05 и ФИ на 11%; р > 0,05) и истощение NADPH-оксидазной микробицидной активности. Выявленные сохраняющиеся нарушения микробицидного потенциала НГ были наглядно продемонстрированы и подтверждены при изучении функционально-значимых субпопуляций CD16+CD64-CD32+CD11b+НГ
и CD16+CD64+CD32+CD11b+НГ, содержание которых и фенотипические характеристики не отличались от показателей до лечения в группах 1 и 2 соответственно (p > 0,05) (см. табл. 2 и 3).
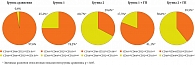
В связи с этим возникла необходимость разработки таргетной иммунокоррекции, направленной на восстановление системы НГ. Поэтому в закрытой системе in vitro было проведено исследование эффектов иммунотропной субстанции ГП в ПК у детей с местным неотграниченным и разлитым ОП и определен его модулирующий эффект. Под влиянием ГП отмечалось увеличение содержания субпопуляции CD16+СD64-CD32+CD11b+НГ и восстановление ее фенотипических характеристик за счет усиления плотности экспрессии CD16- и CD32-рецепторов – CD16midСD64-CD32midCD11bmid в обеих группах до показателей группы сравнения. В субпопуляции CD16+СD64+CD32+CD11b+НГ также наблюдались не только количественные (в группе 1 доля данной субпопуляции снизилась на 30,5%, в группе 2 – на 16,6% относительно соответствующих показателей НГ групп до инкубации; p1, 2 > 0,05), но и фенотипические изменения. В последнем случае речь, в частности, идет о трансформации фенотипа CD16midСD64dimCD32midCD11bmid при местном неотграниченном ОП и CD16dimСD64dimCD32midCD11bdim при разлитом ОП (рис. 3). Разнонаправленные реорганизации трансформированного фенотипа НГ под воздействием ГП способствовали восстановлению процессов захвата и переваривания в обеих группах. При этом в группе 1 было отмечено усиление микробицидной активности, в группе 2 – снижение напряженности NADPH-оксидаз в спонтанном NBT-тесте и сохранение резервного потенциала НГ при дополнительной стимуляции БАГ. Выявленные эффекты ГП послужили основанием выбора препарата Имунофан, № Р N000106/04, основной действующей субстанцией которого является ГП, для коррекции дисфункций НГ у детей с различными ГВЗ.
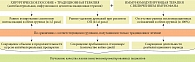
С учетом глубины выявленных дефектов и тяжести течения инфекционного процесса у детей с различными формами ОП нами были разработаны программы таргетной иммуномодулирующей терапии (ИТ), включенные в комплексную послеоперационную терапию (рис. 4).
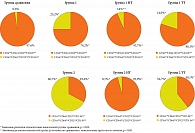
У детей с местным неотграниченным и разлитым ОП, получавших комплексное послеоперационное лечение с Имунофаном, отмечалась компенсация иммунологических нарушений, чего не наблюдалось в соответствующих группах, находившихся на ТТ. В группе 1 ИТ уровень субпопуляции CD16+СD64-CD32+CD11b+НГ достиг значений группы сравнения (p < 0,05), а фенотип субпопуляции характеризовался снижением уровня MFI CD32 на 25% (p < 0,05), тенденцией к увеличению уровня MFI CD16 (p > 0,05) и изменением фенотипического профиля CD16brightСD64-CD32dimCD11bmid
относительно показателей группы 1 (см. табл. 2 и рис. 5). В группе 1 уровень субпопуляции CD16+СD64+CD32+CD11b+НГ снизился на 94,4% от показателей до лечения, а также наблюдалась реорганизация фенотипа CD16brightСD64dimCD32midCD11bmid с повышением на 49,0% уровня MFI CD16, на 35,7% уровня MFI CD64 на фоне снижения на 16,5% уровня MFI CD11b (p1–3 < 0,05) (см. табл. 3 и рис. 5).
У детей с разлитым ОП с глубокими дефектами системы НГ после курса комплексной послеоперационной терапии с Имунофаном также наблюдалось количественное восстановление субпопуляции CD16+СD64-CD32+CD11b+ до значений у условно здоровых детей (p > 0,05) за счет снижения на 98,8% содержания субпопуляции CD16+СD64+CD32+CD11b+НГ (p < 0,05) по сравнению с показателями до лечения и появление новых фенотипических профилей CD16midСD64-CD32dimCD11bbright (см. табл. 2 и рис. 5) и CD16brightСD64dimCD32midCD11bbright (см. табл. 3 и рис. 5).
При комплексной оценке функциональных возможностей НГ также установлено восстановление процессов захвата и переваривания, нормализация спонтанной и индуцированной NADPH-оксидазной активности с сохранением (в группе 1) или восстановлением (в группе 2) резервных микробицидных возможностей НГ.
Использование в комплексном лечении детей с местным неотграниченным и разлитым ОП иммуномодулирующей терапии с Имунофаном обеспечивало высокую клиническую эффективность. Так, в группе 1 ИТ субфебрильная температура тела отмечалась в течение 2,0 (1,0–2,5) дня в послеоперационном периоде, тогда как в группе 1 ТТ – на 2–3 дня дольше, то есть в течение 5,0 (4,5–5,0) дня. Другие проявления интоксикационного синдрома (бледность кожных покровов, тошнота, слабость, головокружение) в группе 1 ИТ регрессировали через 3,5 (3,0–5,0) дня. В группе 1 ТТ продолжительность интоксикационного синдрома составила 5,5 (5,0–7,0) дня. В группе 1 ИТ ранних осложнений послеоперационного периода в виде нагноения швов не зарегистрировано. В группе 1 ТТ не обнаружено восстановления адекватного функционирования НГ. Как следствие, в послеоперационном периоде нагноение швов отмечалось у всех детей данной группы с продолжительностью выделений гнойного характера из послеоперационной раны до 4,0 (3,5–4,0) дня, однако это не требовало дополнительного хирургического пособия (рис. 6).
В группе 2 ИТ в послеоперационном периоде подъем температуры тела до субфебрильных цифр с литическим снижением наблюдался в течение 4,0 (3,0–4,5) дня, тогда как в группе 2 ТТ нормализация субфебрильной температуры зафиксирована только к 6,0 (5,5–6,5) дню. Выраженный интоксикационный синдром после операции в группе 2 ИТ регистрировался в более ранние сроки, чем в группе 2 ТТ, – через 5,0 (4,5–5,5) и 7,5 (6,5–8,0) дня соответственно. Сократилось в два раза количество койко-дней, проведенных в отделении реанимации, у получавших ИТ с первых послеоперационных суток. Так, в группе 2 ИТ количество койко-дней составило 2,0 (1,0–2,5), в группе 2 ТТ – 4,0 (3,5–4,0). Дренирование брюшной полости в группе 2 ТТ было продолжительным и составило 5,0 (4,5–5,0) дня, в группе 2 ИТ – 3,0 (2,0–3,0) дня с последующим удалением дренажа, что существенно снижает риск вторичного инфицирования. Следует отметить, что в группе 2 ИТ не наблюдалось нарушения нормальной моторики желудочно-кишечного тракта, тогда как в группе 2 ТТ в 80% случаев встречался парез кишечника, являющийся дополнительным источником интоксикации, симптомы которого купировались через шесть дней после операции (см. рис. 6).
Полученные результаты в отношении положительных клинико-иммунологических эффектов Имунофана при добавлении к комплексному лечению детей с различными формами нетипично протекающих ОП согласуются с данными литературы о положительном влиянии препарата в составе комплексной терапии различных иммунозависимых заболеваний, таких как туберкулез, гепатит, псориаз, дифтерия, хронический бруцеллез, злокачественных заболеваний, оппортунистических инфекций, тяжелых ГВЗ [14, 15, 18–20].
Заключение
Сравнение иммунопатогенетически обоснованного использования Имунофана в комплексном лечении детей с нетипично протекающими местным неотграниченным и разлитым ОП с традиционной терапией показало выраженную клинико-иммунологическую эффективность первого метода. Восстановление соотношения функционально-значимых субпопуляций НГ, ремоделирование их негативно трансформированных фенотипов и, как следствие, полноценное восстановление микробицидных функций в 100% случаев позволило избежать ранних послеоперационных осложнений. Несмотря на позитивные клинические эффекты, при использовании только традиционной терапии не отмечалось восстановления дефектов системы НГ, что проявлялось в виде нагноения швов (у 100% детей с местным неотграниченным ОП) и пареза кишечника (у 80% детей с разлитым ОП). Как следствие, требовалась дополнительная симптоматическая терапия.
Оптимизация лечения с помощью Имунофана на фоне восстановления дисфункций НГ повлияла на клинические проявления различных форм ОП. В частности, наблюдалось уменьшение длительности лихорадочного периода в 2,5 и 1,5 раза в группах с местным неотграниченным и разлитым ОП соответственно, выраженности интоксикационного синдрома в 1,5 раза в обеих группах, в 1,6 раза случаев дренирования брюшной полости, в 2 раза сроков пребывания в реанимационном отделении (при разлитом ОП).
Таким образом, использование разработанных дифференцированных программ, учитывающих тяжесть течения воспалительного процесса и глубину дефектов функционирования НГ, в составе комплексного послеоперационного лечения детей с различными формами нетипично протекающих ОП не только эффективно, но и целесообразно.
Финансирование
Исследование выполнено в рамках государственного задания Министерства здравоохранения Российской Федерации № 121031000071-4.
I.V. Nesterova, MD, PhD, Prof., G.A. Chudilova, MD, PhD, Prof., V.N. Chapurina, S.V. Kovaleva, MD, PhD, L.V. Lomtatidze, PhD, N.K. Barova, PhD, V.A. Tarakanov, MD, PhD, Prof.
Kuban State Medical University
Peoples' Friendship University of Russia
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
The prevalence of acute peritonitis (AP) in children dictates the need to search for tactics in the treatment of these patients. Considering that the immunopathogenesis of AP is based on the dysfunction of neutrophil granulocytes (NG), programs are needed to restore their functioning, contributing to the optimization of treatment and prevention of postoperative complications. Of particular interest is a synthetic hexapeptide (HP): arginyl-alpha-aspartyl-lysyl-valyl-tyrosyl-arginine, the active ingredient of the pharmaceutical Imunophan, which has a regulatory effect on the immune system, and in particular on NG.
Aim – to conduct a comparative clinical and immunological study of the effectiveness of the developed immunomodulatory therapy programs using Imunofan included in complex postoperative treatment with traditional methods of postoperative treatment of children with various forms of atypically occurring acute peritonitis.
Material and methods. A study of immunocompromised children aged 5–12 years with various forms of AP, who are on traditional therapy and complex therapy with the inclusion of Imunofan: group 1 – children with local non-delimited AP, group 2 – children with spilled AP. Subsets of NG CD16+CD64-CD32+CD11b+ and CD16+CD64+CD32+CD11b+, phenotype by receptor expression density (MFI) (FC 500 ‘Beckman Coulter’, USA), phagocytic and NADHP oxidase activity before and after treatment were determined.
Results. The clinical and immunological effectiveness of the developed immunomodulatory therapy programs included in the complex postoperative treatment of children with various forms of AP is shown: absence of postoperative complications, rapid regression of intoxication symptoms, early removal of drains against the background of restoration of adequate functioning of NG associated with the reorganization of negatively transformed subpopulations of NG in comparison with the corresponding groups who received only traditional treatment.
Conclusion. The positive clinical and immunological effects of the developed programs with the use of Imunofan determine the expediency of their use in immunocompromised children with OP, which contributes to reducing the courses of antibacterial drugs, reducing the days of the patient's stay in the hospital, the duration of the rehabilitation period and improving the quality of life of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.