Таргетная иммунокоррекция двух негативно трансформированных субпопуляций нейтрофильных гранулоцитов при острой деструктивной пневмонии у детей раннего возраста
- Аннотация
- Статья
- Ссылки
- English
Цель – разработать программу иммуномодулирующей терапии в лечении иммунокомпрометированных детей с острой деструктивной пневмонией с последующей оценкой ее клинико-иммунологической эффективности.
Материал и методы. Группа исследования – 10 иммунокомпрометированных детей двух – четырех лет с ОДП. Группа сравнения – 16 условно-здоровых детей двух – четырех лет. Проведена оценка содержания субпопуляций НГ CD64-CD16+CD32+CD11b+ и CD64+CD16+CD32+CD11b+ и фенотипа по плотности экспрессии рецепторов (MFI) (FC 500 Beckman Coulter, США), фагоцитарной и НАДФ-оксидазной микробицидной функции до и после комплексного лечения, включающего хирургическое пособие и терапевтическую тактику с использованием Имунофана (гексапептид (ГП) – аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин).
Результаты. Выявлены изменения содержания и трансформация фенотипа субпопуляций НГ, ассоциируемые с нарушениями эффекторных свойств НГ. С учетом клинико-иммунологических особенностей ОДП разработана программа таргетной иммуномодулирующей терапии для детей с ОДП с включением ГП 45 мг/мл 1 мл в/м ежедневно пять дней подряд, далее через день, на курс восемь инъекций в стандарты послеоперационного лечения. Показана клинико-иммунологическая эффективность разработанной программы: отсутствие послеоперационных осложнений, быстрая регрессия симптомов интоксикации и дыхательной недостаточности, сокращение объема антибиотикотерапии на фоне восстановления адекватного функционирования НГ, связанного с реорганизацией негативно трансформированных субпопуляций НГ.
Заключение. Позитивные клинико-иммунологические эффекты разработанной программы таргетной иммуномодулирующей терапии с включением ГП определяют целесообразность ее использования в послеоперационном периоде у иммунокомпрометированных детей раннего возраста с ОДП, что способствует уменьшению продолжительности курсов приема антибактериальных препаратов, сокращению дней пребывания пациента в стационаре и длительности реабилитационного периода.
Цель – разработать программу иммуномодулирующей терапии в лечении иммунокомпрометированных детей с острой деструктивной пневмонией с последующей оценкой ее клинико-иммунологической эффективности.
Материал и методы. Группа исследования – 10 иммунокомпрометированных детей двух – четырех лет с ОДП. Группа сравнения – 16 условно-здоровых детей двух – четырех лет. Проведена оценка содержания субпопуляций НГ CD64-CD16+CD32+CD11b+ и CD64+CD16+CD32+CD11b+ и фенотипа по плотности экспрессии рецепторов (MFI) (FC 500 Beckman Coulter, США), фагоцитарной и НАДФ-оксидазной микробицидной функции до и после комплексного лечения, включающего хирургическое пособие и терапевтическую тактику с использованием Имунофана (гексапептид (ГП) – аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин).
Результаты. Выявлены изменения содержания и трансформация фенотипа субпопуляций НГ, ассоциируемые с нарушениями эффекторных свойств НГ. С учетом клинико-иммунологических особенностей ОДП разработана программа таргетной иммуномодулирующей терапии для детей с ОДП с включением ГП 45 мг/мл 1 мл в/м ежедневно пять дней подряд, далее через день, на курс восемь инъекций в стандарты послеоперационного лечения. Показана клинико-иммунологическая эффективность разработанной программы: отсутствие послеоперационных осложнений, быстрая регрессия симптомов интоксикации и дыхательной недостаточности, сокращение объема антибиотикотерапии на фоне восстановления адекватного функционирования НГ, связанного с реорганизацией негативно трансформированных субпопуляций НГ.
Заключение. Позитивные клинико-иммунологические эффекты разработанной программы таргетной иммуномодулирующей терапии с включением ГП определяют целесообразность ее использования в послеоперационном периоде у иммунокомпрометированных детей раннего возраста с ОДП, что способствует уменьшению продолжительности курсов приема антибактериальных препаратов, сокращению дней пребывания пациента в стационаре и длительности реабилитационного периода.





Введение
Гнойно-воспалительные заболевания (ГВЗ) остаются одной из первостепенных и серьезных проблем здравоохранения, так как количество пациентов с ГВЗ не имеет тенденции к снижению как среди взрослого, так и среди детского населения и составляет 35–40% случаев среди всех хирургических заболеваний [1, 2]. На долю различных форм острой деструктивной пневмонии (ОДП) приходится от 10 до 15% от общего количества пневмоний у детей [3, 4]. Чаще всего ОДП встречается в раннем детском возрасте (1–3 года – 47,48%) и характеризуется высоким процентом летальных случаев (от 2 до 13%) или переходом в хронические формы (от 5 до 30%) [3]. Формы ОДП и клинические варианты течения болезни находятся в непосредственной зависимости от вида возбудителя, возраста пациента, иммунологической реактивности организма, что и объясняет высокую тенденцию развития ОДП в раннем детском возрасте, для которого характерны изменения в иммунном ответе, связанные с незрелостью иммунной системы (ИС) [5]. В настоящее время все чаще в практическом здравоохранении фиксируются заболевания с измененным клиническим течением, возрастает число заболеваний, вызванных условно-патогенными микроорганизмами, не отвечающих на стандартизированную терапию, что обусловлено дисбалансом функционирования ИС и в первую очередь дисфункциями нейтрофильных гранулоцитов (НГ) [6].
Нейтрофильные гранулоциты инициируют противобактериальную, противовирусную и противогрибковую защиту, запуская каскад реакций для реализации полноценного иммунного ответа организма. НГ – уникальная популяция многофункциональных клеток, которая осуществляет разнообразные функции: фагоцитоз, дегрануляцию, продукцию активных форм кислорода (АФК), образование внеклеточных нейтрофильных экстрацеллюлярных сетей, регуляцию клеток адаптивного иммунитета. Благодаря мощному рецепторному аппарату НГ моментально отвечают на малейшие изменения в их микроокружении перестройкой фенотипа и, как следствие, модификацией функциональной активности. Такая пластичность НГ позволяет регулировать и предопределять дальнейшее течение и исход бактериального воспалительного процесса. Разнообразные фенотипические профили субпопуляций НГ способствуют проявлению различных функциональных возможностей НГ: от состояния «полной неотвечаемости» при блокаде ответа на антиген, характеризующегося неспособностью осуществлять полноценную противомикробную защиту, до гиперактивации НГ с повреждающим действием на клетки, ткани и органы, с развитием иммунотромбозов и системного воспаления [7–10]. Основой иммунопатогенеза ГВЗ, не отвечающих на стандартизированные терапевтические тактики, является неполноценное функционирование НГ в реализации иммунного ответа. Известны различные изолированные или комбинированные дефекты НГ, обусловленные нарушениями рецепторного аппарата НГ, микробицидной и фагоцитарной активности НГ [8, 11].
У детей с дисфункциями НГ, как правило, отмечаются критериальные клинические признаки иммунокомпрометированности: частые, до 10–15 раз в год, острые респираторно-вирусные инфекции, осложняющиеся присоединением бактериальных инфекций респираторного тракта и ЛОР-органов; латентные и рецидивирующие моно- или микст-герпесвирусные инфекции с частыми обострениями хронических очагов инфекций, развитием тяжелых острых и рецидивирующих бактериальных инфекций различных органов и систем. В лечении таких пациентов используются частые (6–8 раз в год) и продолжительные курсы препаратов антибактериальной направленности как перорально, так и парентерально [6]. При ГВЗ на фоне имеющихся дефектов функционирования ИС, в частности дисфункций НГ и влияний хирургических вмешательств, агрессивное воздействие антибактериальных препаратов приводит к еще большему снижению защитных функциональных возможностей организма.
Ведутся активные научные исследования, целью которых являются поиск причин и исследование механизмов развития различных дисфункций НГ в иммунопатогенезе нетипично протекающих ГВЗ. Установлено дифференциально-диагностическое значение определения CD64-CD16+CD32+CD11b+- и CD64+CD16+CD32+CD11b+- субпопуляций НГ при неонатальном сепсисе и врожденной пневмонии, выявлена взаимосвязь количества и фенотипической оснащенности этих субпопуляций у детей с ГВЗ мягких тканей и с острыми перитонитами различного течения, ассоциированными с несостоятельностью эффекторных и микробицидных функциональных механизмов НГ [13, 14].
Согласно литературным данным, использование в лечении ГВЗ иммунотропных препаратов (Ронколейкин, Бестим, Галавит, Полиоксидоний, Ликопид и др.) оказывает позитивный клинический эффект и улучшает исход заболеваний, но наибольшее количество исследований, посвященных проведению иммунотерапии при ГВЗ, проведено у взрослых пациентов и, как правило, направлено на изучение коррекции дефектов функционирования адаптивного звена ИС [15–18]. В связи с этим остается актуальной задачей поиск иммунотропных препаратов, целенаправленно модулирующих дисфункции НГ, с целью восстановления полноценной противобактериальной защиты.
Гексапептид (ГП) – аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин – является синтетическим аналогом активного центра гомона тимуса тимопоэтина, который обладает всеми биологическими свойствами нативного гормона тимуса, и действующим веществом лекарственного препарата Имунофан [19, 20]. Препарат получил широкое применение в лечении различных иммунозависимых заболеваний. ГП отличается способностью проявлять дезинтоксикационные, гепатопротекторные, антиоксидантные и иммунорегуляторные свойства – индуцирует раннюю дифференцировку Т-лимфоцитов, а также может усиливать эффективность антибактериальной терапии и ингибировать множественную лекарственную устойчивость, что является перспективным для его использования в коррекции дефектов функционирования НГ детей с нетипично протекающими ОДП для улучшения эффективности послеоперационного лечения [20, 21].
Цель работы – разработать программу иммуномодулирующей терапии в лечении иммунокомпрометированных детей с острой деструктивной пневмонией с последующей оценкой ее клинико-иммунологической эффективности.
Материал и методы
Проведено проспективное нерандомизированное контролируемое сравнительное исследование. Под нашим наблюдением находились 10 детей двух – четырех лет (шесть мальчиков, четыре девочки) с диагнозом «острая деструктивная пневмония» (группа исследования), поступивших на стационарное лечение в хирургическое отделение № 1 ГБУЗ «Детская краевая клиническая больница» МЗ Краснодарского края. У всех детей собран анамнез для выявления клинических признаков иммунокомпрометированности по программе «Иммунологический анамнез», разработанной И.В. Нестеровой (1992). В послеоперационном лечении детей, вошедших в группу исследования, использовали стандартные терапевтические подходы (антибактериальная, инфузионная и дезинтоксикационная терапия), а также дополнительно применяли разработанную нами программу иммуномодулирующей терапии, включающую ГП. Контрольную группу сравнения составили 16 условно-здоровых детей (восемь мальчиков, восемь девочек), сопоставимых по возрасту.
Иммунологическое исследование периферической крови (ПК) пациентов осуществляли после дренирования плевральной полости и при выписке, после курса комбинированной терапии. Методом проточной цитометрии (FC 500 Beckman Coulter, США) определяли количество (в %) НГ субпопуляций CD64-CD32+CD16+CD11b+, CD64+CD32+CD16+CD11b+ и их фенотип по интенсивности экспрессии (MFI) изучаемых рецепторов. Использованы конъюгаты моноклональных антител: CD64 – FITC, CD32 – PE, CD16 – ECD, CD16 – РE, CD11b – PC5 (Beckman Coulter International S.A., Франция). Изучали фагоцитарную активность НГ с оценкой завершенности фагоцитоза с Staphylococcus аureus (штамм 209) по показателям: количество активно фагоцитирующих НГ (процент функциональной активности нейтрофилов (%ФАН)); процессы захвата (фагоцитарное число (ФЧ), фагоцитарный индекс (ФИ)); переваривающая активность (процент переваривания (%П), индекс переваривания (ИП)); НАДФ-оксидазная активность – по показателям NBT-теста, спонтанного и стимулированного (S. aureus), учитывая процент формазан-позитивных НГ (ФПК), средний цитохимический индекс (СЦИ); по соотношению %ФПКст/%ФПКсп рассчитывался коэффициент мобилизации (КМ) [22].
Исследования проводили с соблюдением требований Хельсинкской декларации Всемирной медицинской ассоциации (WMA Declaration of Helsinki – Ethical Principles for Medical Research Involving Human Subjects, 2013). У всех родителей участвующих в исследовании детей было получено информированное согласие на сбор и обработку анамнестических данных, забор ПК, проведение лабораторных исследований и использование иммуномодулирующих лекарственных препаратов.
Статистическую обработку результатов исследования проводили с использованием компьютерных программ StatPlus (версия 17.0 для Windows, StatSoft Inc, США). В ходе анализа полученных данных оценивали правильность распределения выборки. Использовали методы непараметрической статистики: результаты представляли в виде медианы (Ме) и интерквартильного размаха (Q1; Q3). Для установления значимости различий между количественными показателями независимых групп (исследуемые группы, группа сравнения) использовали непараметрический U-критерий Манна – Уитни. Различия определяли статистически значимыми при p < 0,05.
Результаты исследования
По данным анамнеза, у 100% пациентов, вошедших в группу исследования, выявлялись критериальные признаки иммунокомпрометированности. Дети страдали острыми респираторными вирусными инфекциями длительностью более двух недель от 10 раз в год с частыми осложнениями и присоединением острой или обострением хронической бактериальной инфекции респираторного тракта и ЛОР-органов. У 80% пациентов отмечалось наличие персистирующей герпесвирусной инфекции первого и второго типа лабиальной локализации. При этом у всех детей выявлено снижение чувствительности к проводимой стандартной антибактериальной терапии.
При проведении иммунологического исследования у детей с ОДП на фоне незначительного лейкоцитоза (13,075 (11,1; 16,55) × 109/л против 7,25 (6,67; 8,25) × 109/л в группе сравнения (р < 0,05)) наблюдалось увеличение количества НГ до 70,5 (67,0; 74,0)% против 41,0 (37,0; 47,0)% в группе сравнения (р < 0,05) на фоне повышения доли палочкоядерных форм НГ – 12,5 (7,75; 17,5)%, что свидетельствует о вовлечении в воспалительный процесс незрелых НГ (рис. 1).
При проведении иммунофенотипирования НГ условно-здоровых детей двух – четырех лет определены две функционально значимые субпопуляции: мажорная CD64-CD16+CD32+CD11b+, содержание которой составило 96,01 (95,58; 97,60)%, и минорная CD64+CD16+CD32+CD11b+, на которую приходится 1,75 (1,40; 1,93)% циркулирующих НГ. Субпопуляция CD64-CD16+CD32+CD11b+ имела уровень экспрессии CD16 – 132,5 (119,5; 144,50), CD32 – 5,06 (4,34; 6,18), CD11b – 22,4 (22,18; 25,75) (рис. 2). Субпопуляция CD64+CD16+CD32+CD11b+ имела более низкую MFI CD16 – 91,55 (82,18; 106,48) и не отличалась по уровню экспрессии CD32 – 6,51 (5,02; 8,92) и CD11b – 19,8 (13,40; 26,93) от мажорной субпопуляции, но была дополнительно хорошо оснащена CD64-рецептором (MFI CD64 – 9,35 (9,24; 9,57)) (рис. 3).
При изучении показателей ПК детей с ОДП установлено снижение содержания мажорной субпопуляции НГ в 1,7 раза (до 55,77 (35,24; 74,83), р < 0,05) относительно показателей группы сравнения. При этом отмечалось уменьшение плотности экспрессии CD16 (112,25 (86,15; 115,75), р < 0,05) и CD11b (15,2 (14,7; 15,55), р < 0,05) с неизмененным MFI CD32 (р > 0,05) (рис. 2).
Содержание минорной субпопуляции CD64+CD16+CD32+CD11b+ НГ увеличилось в 30 раз (до 52,6 (41,78; 54,99)) против 1,75 (1,40; 1,93) в группе сравнения (р < 0,05). В данной субпопуляции в группе исследования зарегистрирован сниженный в три раза уровень экспрессии CD64 (3,1 (2,94; 3,43)) по сравнению с показателями условно-здоровых детей (р < 0,05). Напротив, MFI CD11b статистически значимо увеличивался до 31,2 (27,3; 35,2) против 19,8 (13,40; 26,93) в группе сравнения (р < 0,05), в отношении уровня экспрессии рецепторов CD16 и СD32 выявлена тенденция к увеличению (р1,2 > 0,05) (рис. 3).
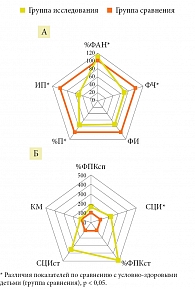
Изменения соотношения содержания функционально значимых субпопуляций и негативная трансформация их фенотипа отразились на способности НГ полноценно осуществлять эффекторные функции. Так, при оценке фагоцитарной функции НГ при ОДП выявлено неадекватное повышение активно фагоцитирующих НГ (%ФАН 60,0 (47,0; 67,0)% против 55,3 (54,0; 57,0)%, р < 0,05) у условно-здоровых детей. При этом были снижены показатели поглотительной способности НГ: ФЧ – 2,9 (2,7; 3,3) против 4,1 (3,7; 5,7), р < 0,05; ФИ – 1,8 (1,3; 1,9) против 2,5 (1,8; 3,3) в группе сравнения (р > 0,05). Также выявлено снижение процессов переваривания: %П – 46,9 (40,7; 49,9)% против 61,62 (57,9; 62,9)% и ИП – 0,8 (0,3; 1,03) против 1,57 (1,37; 1,88) в группе сравнения (p1 < 0,05, p2 < 0,05). В то же время в группе с ОДП отмечалось значительное увеличение спонтанной (%ФПКсп – 6,0 (4,5;14,0)% против 3,5 (3,0; 4,0)% у условно-здоровых детей, СЦИсп – 0,15 (0,1; 0,3) относительно 0,07 (0,01; 0,08) у группы сравнения (р1 > 0,05; р2 < 0,05)) и индуцированной активности НАДФ-оксидаз (%ФПКст – 19,5 (5,0; 36,8)% против 4,5 (4,0; 7,0)%) у условно-здоровых детей (СЦИст – 0,6 (0,16; 1,1)) относительно 0,17 (0,1; 0,2) у группы сравнения (р1,2 > 0,05) с сохранением резервного микробицидного потенциала, о чем свидетельствует КМ – 2,1 (2,0; 3,8) (рис. 4).
На основе данных, полученных при сборе анамнеза, и особенностей выявленных дефектов функционирования системы НГ разработана программа таргетной иммуномодулирующей терапии для детей с нетипично протекающей острой деструктивной пневмонией в возрасте от двух до четырех лет, органично включенная в комплексную послеоперационную терапию (рис. 5).
При клиническом анализе использования иммуномодулирующей терапии с включением ГП в комплексном лечении детей двух – четырех лет с нетипично протекающей ОДП были определены положительные эффекты. Так, при поступлении у пациентов преобладали синдромы дыхательной и сердечной недостаточности, а также интоксикационный синдром. В группе исследования нормализация температурной реакции и отсутствие симптомов интоксикации фиксировались к шестым (пятым; седьмым) суткам пребывания в стационаре. Регрессия симптомов дыхательной недостаточности наблюдалась на пятый (четвертый; шестой) день послеоперационного периода, при этом купирование плеврального выпота наблюдалось на восьмые (седьмые; девятые) сутки послеоперационного периода. Наличие послеоперационных осложнений у детей группы исследования не зафиксировано.
Клиническая эффективность проводимой иммуномодулирующей терапии сопровождалась позитивными изменениями иммунологических показателей, характеризующих восстановление эффекторных функций системы НГ. Так, отмечалось увеличение уровня НГ мажорной субпопуляции CD64-CD16+CD32+CD11b+ до 88,9 (87,2; 90,5)% против 55,77 (35,24; 74,83)%, выявляемых до лечения (р < 0,05). Также отмечались увеличение плотности экспрессии CD16 и CD11b (р1,2 < 0,05) и тенденция к увеличению MFI CD32 (р > 0,05). При этом было зафиксировано значительное снижение (в 40 раз) минорной CD64+CD16+CD32+CD11b+-субпопуляции НГ до уровня значений условно-здоровых детей на фоне трансформации фенотипа: выявлено увеличение уровня экспрессии CD64 в 2,3 раза (р < 0,05) и CD32 – в 1,4 раза (р < 0,05), снижение MFI CD11b в 1,3 раза в сравнении с показателями до лечения (р > 0,05) с неизмененным MFI CD16 (табл. 1).
Однако не все исследуемые показатели (уровень мажорной субпопуляции и уровень экспрессии CD64 в минорной субпопуляции) восстановились до показателей группы сравнения. Возможно, глубина дефектов функционирования системы НГ у иммунокомпрометированных пациентов требует более длительного курса иммуномодулирующей терапии для полноценного восстановления функционирования ИС.
Анализ показателей фагоцитарной и микробицидной активности НГ выявил: повышение переваривающей активности %П – 55,4 (50,9; 55,7)% против 46,9 (40,7; 49,9)% до лечения; усиление процессов захвата ФЧ – 3,5 (3,4; 3,7) против 2,9 (2,7; 3,3) до лечения (р < 0,05); ФИ – 2,1 (1,7; 2,3) против 1,8 (1,3; 1,9) (р > 0,05) до лечения при неизменяющемся количестве активно фагоцитирующих НГ (%ФАН – 64,0 (61,0; 67,0)% против 60,0 (47,0; 67,0)% до лечения, р > 0,05). При этом восстанавливался баланс НАДФ-оксидаз, регистрируемый в спонтанном NBT-тесте, отмечалось снижение %ФПКсп (3,0 (2,0; 4,0)%, р < 0,05) и СЦИсп (0,11 (0,08; 0,130), р < 0,05) до уровня условно-здоровых детей. В стимулированном NBT-тесте наблюдалась тенденция к снижению показателей %ФПКст (11,5 (8,8; 14,2)%, р > 0,05) и СЦИст (0,34 (0,25; 0,42), р > 0,05), регистрируемых до лечения, с сохранением резервного микробицидного потенциала КМ – 4,7 (4,05; 5,3).
Таким образом, получены позитивные клинико-иммунологические эффекты, демонстрирующие целесообразность использования иммуномодулирующей таргетной терапии с включением ГП в комплексном лечении детей с ОДП.
Обсуждение
Позитивные эффекты ГП обусловлены особенностями связывания ГП с разными мембранными рецепторами НГ, что приводит к активации различных механизмов передачи сигнала, в результате которого наблюдаются перестройка негативно трансформированного фенотипа функционально значимых субпопуляций НГ при ОДП и восстановление эффекторных функций НГ.
В частности, доказано векторное действие ГП на клетки ИС, в том числе на НГ, через никотиновые ацетилхолиновые рецепторы (nAChRs) нейронального типа [23, 24]. Показано модулирование функциональной активности НГ при воздействии на nAChRs НГ в условиях эксперимента in vivo на мышах [25]. Кроме того, ГП (аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин) как синтетический аналог активного центра гормона тимопоэтина может аналогично пентапептиду (аргинил-лизил-аспартил-валил-тирозил) гормона тимуса типопоэтина – тимопентина (ТР5) напрямую связываться с молекулами ГКГС второго типа HLA-DR. Возможность такого связывания показана в экспериментальных исследованиях меченого ТР5 (продемонстрировано прямое связывание флуоресцентно меченного TP5 с HLA-DR) и подтверждена ингибированием немеченым TP5 [26]. Молекулярный анализ дополнил это открытие об изменении сайта связывания в бороздке HLA-DR с валином (Val), который играет роль якоря первого типа, необходимого для связывания TP5 с HLA-DR [26]. Приведенные данные доказывают возможность таргетного иммуномодулирующего воздействия ГП на негативно трансформированные субпопуляции НГ и дефектные эффекторные функции НГ при нетипично протекающих ОДП.
Таким образом, нами показано, что ГП демонстрирует мягкие иммуномодулирующие эффекты, восстанавливая эффекторную фагоцитарную функцию НГ и позитивно изменяя количество и фенотип функционально значимых субпопуляций. Подтвержденные иммунорегуляторные и дезинтоксикационные эффекты препарата Имунофан определяют целесообразность его использования у иммунокомпрометированных детей с ОДП, не отвечающих на стандартную терапию.
Заключение
Накопленный опыт и новые диагностические технологии позволяют детально изучать механизмы возникновения дефектов функционирования НГ при различных нетипично протекающих заболеваниях. Многие внутренние и внешние факторы способствуют возникновению дисфункций НГ, приводящих к повышенной заболеваемости и распространенности тяжелых ГВЗ как у взрослых лиц, так и у детей. ОДП – одно из наиболее тяжелых ГВЗ детского возраста, в лечении которого необходимо сочетать различные терапевтические тактики, направленные на ликвидацию возбудителя, дезинтоксикацию организма, восстановление гомеостаза и в том числе целенаправленную регуляцию иммунного ответа.
С нашей точки зрения, определение негативных трансформаций содержания и фенотипов CD64-CD16+CD32+CD11b+- и CD64+CD16+CD32+CD11b+-субпопуляций НГ при различных нетипично протекающих ГВЗ представляет собой новый диагностический метод для определения полноценного или дефектного участия НГ в воспалительном процессе. При этом необходим подбор иммуномодулирующей терапии направленного действия с целью переориентации негативно трансформированных фенотипов различных субпопуляций НГ, которая могла бы быть включена в комплексное послеоперационное лечение ГВЗ.
Разработанная программа таргетной иммуномодулирующей терапии в комплексном лечении детей с нетипично протекающей ОДП проявила свою высокую клинико-иммунологическую эффективность. Использование ГП в послеоперационном лечении позволило реорганизовать негативные трансформации НГ с восстановлением их функциональной активности. Восстановление функциональной активности и эффекторных функций НГ привело к позитивным клиническим эффектам: раннее купирование интоксикационного синдрома, более ранняя регрессия симптомов дыхательной недостаточности и отсутствие послеоперационных осложнений. Такая динамика способствует сокращению дней пребывания пациента на стационарном лечении, уменьшению продолжительности курсов приема антибактериальных препаратов и сокращению длительности реабилитационного периода.
В связи с вышесказанным включение ГП, являющегося активной субстанцией препарата Имунофан, в послеоперационное лечение детей раннего возраста с ОДП на фоне дисфункций НГ клинически и иммунологически обосновано.
Финансирование
Исследование выполнено в рамках государственного задания Министерства здравоохранения Российской Федерации № 121031000071-4.
I.V. Nesterova, PhD, Prof., G.A. Chudilova, PhD, V.N. Chapurina, S.V. Kovaleva, PhD, L.V. Lomtatidze, PhD, Yu.V. Teterin, N.K. Barova, PhD, V.A. Tarakanov, PhD, Prof.
Kuban State Medical University, Krasnodar
Peoples' Friendship University of Russia, Moscow
Contact person: Irina V. Nesterova, inesterova1@yandex.ru
Introduction. Acute destructive pneumonia (АDP) is a severe purulent-inflammatory disease of early childhood associated with defects in the immune system, in particular of neutrophil granulocytes (NG). In the treatment of ADP, it is necessary to combine various surgical and therapeutic tactics aimed at eliminating the pathogen, detoxifying the body and regulating the immune response.
Aim – to develop a program of immunomodulatory therapy in the treatment of immunocompromised children with acute destructive pneumonia, with subsequent evaluation of its clinical and immunological effectiveness.
Material and methods. The study group including of 10 immunocompromised children 2–4 years old with АDP. The comparison group – 16 conditionally healthy children 2–4 years old. The content of CD64-CD16+CD32+CD11b+ and CD64+CD16+CD32+CD11b+ NG subsets and phenotype by receptor expression density (MFI) (FC 500 "Beckman Coulter", USA), phagocytic and NADHP-oxidase microbicidal function before and after complex treatment, including surgical and therapeutic treatment and immunotherapy by Imunofan (Hexapeptide – arginyl-alpha-aspartyl-lysyl-valyl-tyrosyl-arginine; HP).
Results. The defects of NG functioning were revealed: changes in the content and transformation of the phenotype of functionally significant NG subsets associated with violations of the effector and microbicidal properties of NG. Taking into account the clinical and immunological features of ADP, the program of targeted immunomodulatory therapy has been developed for children with ADP: HP 45 mg/ml 1 ml/m daily for 5 consecutive days, then every second day, for a course during – 8 injections. This program was included in the postoperative treatment. The clinical and immunological efficacy of the developed program was shown: there was no postoperative complications, rapid regression of symptoms of intoxication and respiratory failure, a reduction in the volume of antibiotic therapy against the background of the restoration of adequate functioning of NG, associated with reorganization of negatively transformed functionally significant subpopulations of NG.
Conclusion. The positive clinical and immunological effects of the developed program of targeted immunomodulatory therapy with the inclusion of HP determines the expediency of its use in immunocompromised young children with АDP in the postoperative period, which contributes to reducing the duration of courses of taking antibacterial drugs, reducing the days of the patient's inpatient treatment and the duration of the rehabilitation period.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.