Теоретические и практические аспекты выбора генно-инженерных биологических препаратов для терапии пациентов с болезнью Крона
- Аннотация
- Статья
- Ссылки
- English

Введение
Болезнь Крона (БК) до настоящего времени остается одной из серьезных проблем гастроэнтерологии и колопроктологии. Несмотря на значительные достижения в области изучения патогенеза воспалительных заболеваний кишечника (ВЗК), принципиальных сдвигов в понимании их этиологии не произошло. Заболеваемость как язвенным колитом (ЯК), так и БК во всем мире возрастает с каждым годом, причем преимущественно среди трудоспособного контингента населения, что делает ВЗК социально значимыми заболеваниями [1].
БК характеризуется поражением любого отдела желудочно-кишечного тракта (ЖКТ) и не имеет способов полного излечения. Большинство пациентов с БК в течение жизни переносят хотя бы одно оперативное вмешательство на ЖКТ [2].
На протяжении многих лет медикаментозная терапия БК была ограничена глюкокортикостероидами (ГКС) и иммуномодуляторами, а единственной альтернативой являлось хирургическое лечение. Появление биологических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-α), повлияло на ход истории заболевания и расширило терапевтические возможности для контроля над его активностью [3, 4].
С каждым годом увеличивается число лекарственных средств из ряда генно-инженерных биологических препаратов (ГИБП) с различными механизмами действия. Однако доступные на сегодня подходы к терапии не вызывают стойкую ремиссию более чем у 50% пациентов с ВЗК, имеющими хроническое течение, что делает актуальными вопросы оптимизации и смены ГИБП [5]. Кроме того, по данным реальной клинической практики, на терапии ингибиторами ФНО-α у 15–30% пациентов развивается первичная неэффективность, у 46% пациентов отмечается потеря ответа (вторичная неэффективность) ежегодно [6, 7]. По данным ряда исследований, клинический ответ на первый ингибитор ФНО-α снижается с течением времени: 20% пациентов с ВЗК теряют ответ в течение 12 месяцев, а более 60% пациентов с ЯК и около 50% пациентов с БК имеют минимум один показатель недостаточной эффективности терапии через два года [8–11].
В этой связи постоянный мониторинг эффективности биологической терапии у больных БК в настоящее время позволяет значительно улучшить качество жизни пациентов благодаря своевременной оптимизации или смене ГИБП. Кроме того, одним из основных этапов ведения данной группы больных является четкая маршрутизация, которая позволяет сократить время на каждом этапе и наиболее быстро оказать помощь пациенту.
Клиническое наблюдение
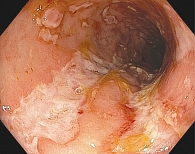
Пациент Ш., наблюдается в МКНЦ им. А.С. Логинова с марта 2017 г. Из анамнеза известно, что в апреле 2016 г. пациент отметил появление вздутия, урчания в животе, диарею до четырех раз в сутки без патологических примесей, появление болей в коленных суставах, которые купировались самостоятельно. В феврале 2017 г. после употребления в пищу рыбы отметил повышение температуры тела, диарею до четырех раз в сутки, припухлость в области правого коленного сустава, левого голеностопного сустава, сопровождающуюся болью. Самостоятельно принимал обезболивающие препараты с минимальным положительным эффектом. В связи с выраженным болевым синдромом госпитализирован по каналу скорой медицинской помощи (СМП) в ревматологическое отделение. При обследовании в клиническом анализе крови отмечалось снижение уровня гемоглобина до 113 г/л, лейкоцитоз – 12 тыс., тромбоцитоз – до 639 тыс. В биохимическом анализе крови: повышение С-реактивного белка до 20,1 мг/л, снижение сывороточного железа до 2,7 мкмоль/л, снижение калия до 3,3 ммоль/л. Анализ кала на скрытую кровь положительный. Выполнено иммунологическое исследование крови на антитела к иерсиниям – титр составил 1:50. Состояние расценивалось как острый реактивный олигоартрит иерсиниозной этиологии. Проводилось консервативное лечение антибактериальными препаратами, препаратами 5-АСК, полиэлектролитными и витаминными растворами внутривенно капельно. На фоне проводимой терапии отмечалась положительная динамика в виде купирования суставного синдрома, однако сохранялись тошнота, периодическая рвота, диарея до пяти раз в сутки с примесью крови, лихорадка до 39,5 °С. Пациент был переведен в инфекционную больницу г. Москвы, где при обследовании в клиническом анализе крови сохранялись лейкоцитоз, тромбоцитоз, анемия. В биохимическом анализе крови обращало на себя внимание снижение общего белка до 49 г/л. Повторно выполнено иммунологическое исследование на кишечные инфекции (шигеллез, сальмонеллез, иерсиниоз) – антитела не обнаружены. При ректосигмоскопии – эндоскопическая картина БК выраженной степени активности (рис. 1).
Проведено консервативное лечение препаратами 5-аминосалициловой кислоты (5-АСК), антибактериальными препаратами, полиэлектролитными растворами, назначена терапия системными ГКС в дозе 60 мг в сутки перорально с незначительным положительным эффектом – сохранялись субфебрильная лихорадка, боли в животе, диарея до 10–15 раз в сутки с примесью крови, тошнота.
По каналу СМП пациент переведен в МКНЦ им. А.С. Логинова. При ультразвуковом исследовании (УЗИ) органов брюшной полости и кишечника выявлены увеличение печени, эхопризнаки колита, тотальное поражение, активность процесса выражена. При мультиспиральной компьютерной томографии (МСКТ) и энтерографии брюшной полости контрастным усилением: МСКТ-картина воспалительных изменений терминального отдела подвздошной кишки, нисходящей ободочной и сигмовидной кишки (илеоколит), вероятно, проявление БК, небольшое количество жидкости в малом тазу.
Для выявления признаков и степени тяжести белково-энергетической недостаточности у пациента исследовали его нутриционный статус с последующей консультацией нутрициолога. Диагностирована белково-энергетическая недостаточность второй степени. Дефицит циркулирующего белка первой-второй степени. Показатели крови в отношении нутриционного статуса (табл. 1) имели отклонения в виде гипокалиемии (минимальное значение 2,28 ммоль/л), снижения уровня белка до 49 г/л, снижения гемоглобина до 11,1 г/дл.
Таким образом, с учетом снижения веса в течение шести месяцев, признаков белкового дефицита, проявляющихся лимфоцитопенией, отклонений нутриционного статуса (соответствовали белково-энергетической недостаточности первой-второй степени тяжести с явлениями гипокалиемии, гипохромной анемии легкой степени тяжести), дегидратации были назначены альбумин внутривенно капельно, парентеральное введение аминокислотных растворов с антиоксидантами и повышенным уровнем калия, препараты железа. Для исключения латентного туберкулеза пациенту были проведены диаскин-тест (результат отрицательный) и консультация фтизиатра, в результате которой противопоказаний к проведению биологической терапии выявлено не было.
На основании проведенных исследований был установлен диагноз: «болезнь Крона в форме илеоколита, впервые выявленная, тяжелой степени, высокой активности, гормонорезистентная форма с метаболическими нарушениями в виде гипопротеинемии, гипоальбуминемии, гипокалиемии, гипокальциемии. Хроническая железодефицитная анемия легкой степени тяжести». С учетом гормонорезистентной формы БК у пациента начат индукционный курс ГИБП адалимумабом (Хумира). На фоне проводимой терапии больной отмечал улучшение состояния в виде купирования лихорадки, болевого синдрома, урежения стула до двух раз в сутки, полуоформленного, без патологических примесей.
В дальнейшем пациент продолжал инъекции препарата адалимумаб (Хумира) 40 мг п/к каждые две недели.
В июле 2018 г. пациент отметил ухудшение состояния в виде учащения стула до трех-пяти раз в сутки с примесью крови, общей слабости, периодических болей и вздутия живота, полиартралгии и был вновь госпитализирован в МКНЦ им. А.С. Логинова. При обследовании, по данным колоноскопии (КС), отмечалась умеренная активность БК (множественные афты в терминальном отделе подвздошной кишки и на всем протяжении толстой кишки). По данным лабораторных исследований, отмечалось наличие железодефицитной анемии легкой степени, повышение уровня СРБ до 23,8 мг/л (табл. 1).
С учетом сохраняющейся активности БК по клиническим и лабораторно-инструментальным данным был сделан вывод об «ускользании» эффекта от терапии адалимумабом, в связи с чем проведена оптимизация антицитокиновой терапии с уменьшением интервала введений (по 40 мг п/к каждые семь дней). Состояние пациента улучшилось: болевой синдром купирован, стул уредился до одного-двух раз в сутки без примеси крови и слизи.
Однако в марте 2019 г. пациент повторно госпитализирован в стационар с жалобами на кашицеобразный стул с примесью крови и слизи, боли в нижних отделах живота, общую слабость. По результатам проведенных клинико-инструментальных исследований, у пациента сохраняются эндоскопические признаки высокой активности БК (тотальное поражение толстой кишки, наличие продольных язв до 1 см в диаметре, выраженная активность в сигмовидной и прямой кишке), снижение уровня сывороточного железа до 4,8 мкмоль/л, повышение СРБ до 54,04 мг/л, тромбоцитоз – 631 тыс.
С учетом сохраняющейся активности БК, по данным КС, у больного зарегистрирована вторичная неэффективность адалимумаба, в связи с чем рекомендована смена ГИБП на цертолизумаба пэгол (Симзия) по стандартной схеме: одно введение 400 мг подкожно, далее через две недели 400 мг подкожно, а затем по 400 мг ежемесячно подкожно. Также к терапии добавлен азатиоприн из расчета 2 мг/кг перорально. На фоне проводимой терапии больной отмечал улучшение состояния в виде урежения стула до двух раз в сутки, оформленного, без примесей.
Через три месяца от начала терапии цертолизумаба пэголом проведено контрольное обследование в МКНЦ им. А.С. Логинова, при котором, по данным эндоскопического исследования, отмечалась ремиссия БК (визуализировались две афты размерами 5 × 3 и 6 × 5 мм в подвздошной кишке, остальные отделы толстой кишки – без патологических изменений). По данным лабораторных исследований, признаков воспаления отмечено не было (СРБ – 2,9 мг/л, СОЭ – 13 мм/час, лейкоциты – 6 тыс.). Решено продолжить биологическую терапию препаратом цертолизумаба пэгол в комбинации с азатиоприном в дозе 150 мг в сутки (из расчета 2 мг/кг).
Ухудшение состояния отмечено в июле 2019 г., когда больной вновь отметил диарею до шести раз в сутки, появление постоянной примеси крови в кале, боли в нижних отделах живота, появление болей в коленных суставах и пояснице. По данным КС, сохранялись эндоскопические признаки высокой активности БК (в терминальном отделе подвздошной кишки и на всем протяжении толстой кишки визуализировались множественные язвенные дефекты). По данным лабораторных исследований: СРБ – 16,63 мг/л, тромбоцитоз – 439 тыс. С учетом рецидива БК, по данным обследования, отмечено «ускользание» эффекта от терапии препаратом цертолизумаба пэгол, в связи с чем рекомендовано сократить интервалы введения: 400 мг п/к каждые 14 дней. Несмотря на это состояние пациента не улучшалось, и в октябре 2019 г. в связи с сохранением активности БК, по данным лабораторно-инструментальных исследований и клинической картины, зарегистрирована вторичная неэффективность цертолизумаба пэгола. Рекомендовано назначить пациенту ГИБП с другим механизмом действия. Назначен курс системных ГКС (метилпреднизолон), азатиоприна в суточной дозе 150 мг, препаратов 5-АСК с положительным эффектом. Однако при снижении дозы метилпреднизолона до 16 мг пациент отметил учащение стула, развилась угревая сыпь на коже лица. В последующем самочувствие постепенно ухудшилось, появились боли в животе.
В феврале 2020 г. пациент вновь госпитализирован в МКНЦ им. А.С. Логинова. Принято решение о назначении ГИБП с другим механизмом действия – устекинумаба, и 20 февраля 2020 г. выполнена первая инфузия устекинумаба – 390 мг в/в капельно – без осложнений. Уже после первого введения устекинумаба состояние пациента улучшилось: стул уредился до трех раз в сутки, исчезла примесь крови. Далее амбулаторно устекинумаб вводили в дозе 90 мг п/к каждые 12 недель.
В ноябре 2020 г. пациент проходил контрольное обследование в МКНЦ им. А.С. Логинова. Боли в животе пациента не беспокоили, стул – один-два раза в день, без патологических примесей. При обследовании, по данным МСКТ-энтерографии с контрастным усилением, выявлена картина поствоспалительных хронических изменений стенок терминального отдела подвздошной кишки, а также правых и левых отделов толстой кишки. При КС – эндоскопическая ремиссия БК. Было принято решение продолжить терапию препаратами 5-АСК в дозе 3 г в сутки, азатиоприном 150 мг в сутки, устекинумабом 90 мг п/к каждые 12 недель.
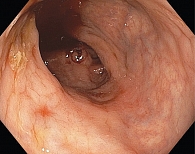
Ухудшение состояния отмечено в конце января 2021 г., когда вновь появились боли в правой подвздошной области, примесь крови в стуле. Значимое ухудшение – с апреля 2021 г. в виде учащения стула до 10 раз в сутки с примесью крови, снижение веса на 13 кг за пять месяцев, боли в суставах. При КС выявлен рецидив БК: в поперечном отделе определяются множественные белесоватые рубцы, в левых отделах слизистая гиперемирована, отечна, с множественными плоскими эрозиями до 0,2 см в диаметре и язвами до 1,0 см в диаметре, с глубоким дном (рис. 2).
Таким образом, зарегистрировано «ускользание» эффекта от терапии устекинумабом. Проведена оптимизация терапии устекинумабом: введение подкожно по 90 мг каждые восемь недель, к терапии добавлены системные ГКС по схеме.
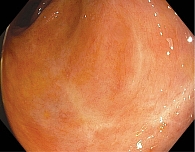
Последняя госпитализация пациента была в апреле 2022 г. По данным КС, эндоскопическая картина минимальной активности воспалительного процесса в прямой кишке, в остальных отделах ободочной кишки – картина ранее перенесенного воспаления слизистой оболочки (рис. 3). Признаков анемии, белково-энергетической недостаточности, электролитных нарушений у пациента не отмечено. По лабораторным данным, признаков воспаления не отмечалось (СРБ, СОЭ, лейкоциты, тромбоциты в пределах референсных значений). В дальнейшем пациент чувствовал себя хорошо, соблюдал рекомендации. Контрольное обследование было запланировано через шесть месяцев.
Обсуждение
Болезнь Крона – прогрессирующее заболевание, требующее регулярного контроля воспалительной активности с помощью клинических данных, лабораторных показателей (СРБ, СОЭ, кальпротектин кала) и оценки эндоскопической активности заболевания для выявления неэффективности ГИБП и проведения своевременной оптимизации или смены ГИБП.
По современным представлениям, первичная неэффективность ГИБП – это отсутствие эффекта от терапии через 8–12 недель от момента начала биологической терапии (после окончания индукционной фазы терапии). Вторичная неэффективность ГИБП – это потеря эффекта от ранее успешно проводимой терапии по клиническим, лабораторным, эндоскопическим, рентгенологическим данным. Понятие «ускользание эффекта» от терапии ГИБП демонстрируется отсутствием достижения ремиссии или сохраняющейся минимальной или умеренной активностью ВЗК по клиническим, лабораторным, эндоскопическим, рентгенологическим данным [12].
Согласно клиническим рекомендациям Европейского общества по изучению ЯК и БК (ЕССО), при развитии неэффективности у двух ГИБП из группы ингибиторов ФНО-α рекомендуется переход на биологический препарат с другим механизмом действия.
В 2019 г. в России для лечения больных БК, а в 2020 г. для лечения пациентов с ЯК зарегистрирован препарат устекинумаб. Препарат представляет собой полностью человеческое моноклональное антитело IgG1κ, которое специфично связывается с общей единицей белка p40 интерлейкина 12 (ИЛ-12) и ИЛ-23 человека. Устекинумаб ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание p40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. Устекинумаб не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Связывая общую субъединицу p40 ИЛ-12 и ИЛ-23, может влиять на клиническое течение БК и ЯК посредством прерывания пути выработки цитокинов Th1 и Th17, которые играют центральную роль в патогенезе этих заболеваний. У пациентов с БК и ЯК в результате терапии препаратом устекинумаб отмечалось значимое снижение уровней маркеров воспаления, в том числе СРБ и фекального кальпротектина [13].
Данный клинический случай демонстрирует раннее назначение биологической терапии, а также в дальнейшем своевременную диагностику потери эффекта от биологической терапии, оптимизацию лечения ГИБП, а также смену ГИБП на биологический препарат с другим механизмом действия (ингибитор интерлейкинов 12/23 – устекинумаб) у пациента с БК.
Несмотря на прогрессирующее, трудно контролируемое течение заболевания, развитие вторичной неэффективности двух ГИБП из группы ингибиторов ФНО-α, использование устекинумаба у данного пациента продемонстрировало развитие быстрого клинического ответа и высокую эффективность терапии, что сопоставимо с данными предшествующих многоцентровых исследований, проводимых в мире [14–16].
Согласно данным нашего, опубликованного в 2021 г. исследования, у пациентов, получавших ранее один или несколько анти-ФНО-α-препаратов, зарегистрирована тенденция в необходимости уменьшения интервала введения устекинумаба до восьми недель с целью повышения эффективности проводимой терапии. Данный клинический пример полностью демонстрирует эту тенденцию [17].
Заключение
Раннее назначение ГИБП и своевременная оптимизация терапии у данного пациента позволили на протяжении пяти лет избежать развития хирургических осложнений и приостановить прогрессирование заболевания.
Важно подчеркнуть, что динамическое наблюдение пациентов с ВЗК каждые три месяца с оценкой клинических симптомов, лабораторных показателей (СРБ, СОЭ, лейкоциты в крови, кальпротектин кала), проведением УЗИ кишечника (оценка толщины стенки) и проведением КС при необходимости позволяет оказать своевременную и высокотехнологичную помощь с применением современных ГИБП и возможностью смены биологических препаратов по показаниям.
N.A. Fadeeva, PhD, E.I. Aliev, O.V. Knyazev, PhD, Prof., D.S. Bordin, PhD, Prof., K.A. Nikolskaya, PhD
A.S. Loginov Moscow Clinical Scientific Center
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Ryzhikh National Medical Research Centre for Coloproctology
Contact person: Nina A. Fadeeva, n.fadeeva@mknc.ru
Presented the clinical case of Crohn's disease (CD) complicated course in a young patient. The article reflects the features of diagnosis, tactics of CD conservative treatment, discusses the problem of loss of response to biological therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.