Тромбоэмболия легочной артерии у пациента со стабильной гемодинамикой
- Аннотация
- Статья
- Ссылки
- English



Тромбоэмболия легочной артерии (ТЭЛА) является распространенной патологией и занимает третье место в структуре сердечно-сосудистой смертности [1]. Клиническая диагностика ТЭЛА нередко осложняется из-за отсутствия явных предвестников, наличия неспецифичных симптомов, недостаточной информативности рутинных диагностических методик. В течение последних двух лет были опубликованы подробные клинические рекомендации американских, европейских и российских обществ [1–3] с учетом последних важнейших достижений в области диагностики и терапии данной патологии.
История болезни
Пациент К., 65 лет, обратился к кардиологу с жалобами на внезапное возникновение одышки при минимальной физической нагрузке в течение прошедших двух суток. За это время одышка прогрессировала.
Объективно – состояние средней тяжести. Пульс ритмичный – 84 удара в минуту, аускультация без особенностей. Артериальное давление (АД) – 170/90 мм рт. ст. Частота дыхательных движений – 20 в минуту. Хрипы в легких отсутствуют, дыхание проводится во всех отделах. Акроцианоза нет. Умеренная отечность стоп и голеней, в большей степени слева. Варикозное расширение вен нижних конечностей. Индекс массы тела – 33 кг/м2. По другим органам и системам без особенностей.
Анамнез: длительно страдает артериальной гипертензией, регулярного лечения не получает. Бросил курить год назад (курил в течение 40 лет по одной пачке в день). Ранее жалоб со стороны сердца не предъявлял. В остальном анамнез не отягощен.
После приема кардиолога пациент был экстренно госпитализирован с диагнозом при поступлении: ишемическая болезнь сердца (ИБС); впервые возникшая стенокардия(?).
Диагностика
Результаты электрокардиограммы при поступлении: синусовый ритм, частота сердечных сокращений (ЧСС) – 79 в минуту. Неполная блокада правой ножки пучка Гиса (НПГ). Блокада передне-верхнего разветвления левой НПГ. Изменения ST/T недиагностические. Клинический анализ крови без особенностей. Креатинин – 114 мкмоль/л (скорость клубочковой фильтрации по MDRD – 59 мл/мин/1,73 м2). Общий холестерин – 5,4 ммоль/л. Тропонин I – 0,02 нг/мл (в пределах нормы).
С целью дифференциальной диагностики была экстренно выполнена эхокардиография (эхоКГ). Очаговых нарушений сократимости не выявлено, глобальная функция левого желудочка сохранена.
Таким образом, при первичном инструментальном и лабораторном обследовании данных, которые подтвердили бы диагноз острого коронарного синдрома (ОКС), не получено. В то же время установлено снижение сатурации капиллярной крови по данным пульсоксиметрии – 89% при дыхании воздухом и 93% на фоне ингаляции 100%-ным O2. Указанные данные в отсутствие достоверного подтверждения ОКС, в сочетании с признаками напряжения компенсации гемодинамики (тенденция к тахикардии и тахипноэ), асимметричной отечностью нижних конечностей, отсутствием признаков патологии левых камер сердца при эхоКГ и физикальных признаков патологии легких позволили предположить альтернативный диагноз – ТЭЛА.
Отметим, что на момент поступления явных факторов высокого риска ТЭЛА у пациента не было. Факторы риска ТЭЛА в формулировке, приведенной в рекомендациях Европейского общества кардиологов (European Society of Cardiology – ESC) 2014 г. [1], отражены в табл. 1. Между тем у пациента наблюдалось сочетание нескольких факторов низкого риска (артериальная гипертензия, пожилой возраст, ожирение, варикозное расширение вен нижних конечностей), влияние которых суммируется. Следовательно, можно говорить о существующем умеренном риске ТЭЛА.
Необходимо обратить внимание на то, что факторы низкого риска ТЭЛА, впервые обозначенные в последних рекомендациях ESC, являются привычными традиционными факторами риска сердечно-сосудистых заболеваний атеросклеротического генеза. Действительно, расчетный суммарный сердечно-сосудистый риск пациента по шкале SCORE – 13% (очень высокий). Это подтверждает точку зрения о патогенетическом сходстве артериального и венозного тромбоза, которому ранее придавали меньшее значение.
При клиническом подозрении на ТЭЛА эксперты требуют в обязательном порядке применять формализованные шкалы клинической вероятности этого заболевания. Такое требование связано с неспецифичностью клинической картины и необходимостью оценки предтестовой вероятности ТЭЛА. Это позволяет принять корректное решение о последующем диагностическом алгоритме.
Для оценки клинической вероятности ТЭЛА в новых рекомендациях приводятся упрощенные клинические алгоритмы – Женевский и алгоритм Wells (табл. 2).
В отличие от оригинальных версий в упрощенных алгоритмах каждому показателю присваивается 1 балл. Кроме того, предложена бинарная трактовка результатов для Женевского алгоритма: 0–3 балла – низкая, > 3 баллов – высокая вероятность ТЭЛА. Предложенные упрощенные алгоритмы клинической вероятности наиболее удобны для использования в реальной клинической практике. Надо признать, что применение оригинальных версий этих шкал в нашей стране мало распространено. Эффективность двух алгоритмов примерно равноценна.
При расчете риска по упрощенному Женевскому алгоритму получено 2 балла (односторонний отек нижней конечности, пульс в диапазоне 75–94 уд/мин). По упрощенному алгоритму Wells – 1 или 2 балла (альтернативный диагноз менее вероятен, чем диагноз ТЭЛА + тромбоз глубоких вен(?)). В первом случае вероятность ТЭЛА низкая, во втором – низкая или высокая в зависимости от интерпретации.
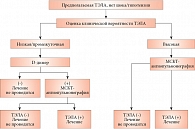
Тактика дальнейшего обследования выбрана исходя из диагностического алгоритма, рекомендуемого для пациентов с нормальной гемодинамикой [1] (рис. 1).
Поскольку вероятность ТЭЛА по шкалам оценивалась скорее как низкая, был выполнен анализ на D-димер [4].
Как известно, повышение D-димера неспецифично и наблюдается как при ТЭЛА, так и при инфаркте миокарда, опухолях, инфекциях, травмах, расслаивающей аневризме аорты. Пороговое значение нормы – 500 нг/мл, однако у лиц старше 50 лет нормальные значения могут быть выше [5]. Именно поэтому в рекомендациях ESС для лиц старше 50 лет используется формула: возраст × 10 нг/мл. Для нашего пациента этот показатель равен 650 нг/мл.
Результат анализа 8250 нг/мл продиктовал необходимость проведения мультиспиральной компьютерной ангиографии системы легочной артерии (МСКТ-ангиопульмонография) (рис. 1). Она является методом выбора для подтверждения диагноза ТЭЛА в отсутствие явных противопоказаний (аллергия на контраст, нежелательность облучения, выраженная почечная недостаточность). Перед МСКТ пациент прошел вспомогательное уточняющее исследование, преимущества которого заключаются в неинвазивности и мобильности оборудования, – ультразвуковое исследование (УЗИ) вен нижних конечностей с помощью компактного УЗИ-сканера. Выявлены гетерогенный тромб в подколенной вене левой нижней конечности (вероятно, флотирующий) и интерстициальный отек обеих нижних конечностей, более выраженный слева.
МСКТ-ангиопульмонография: визуализированы множественные тромбы в сегментарных и более дистальных ветвях легочной артерии с двух сторон с полным и частичным нарушением их проходимости.
Таким образом, подтверждено наличие ТЭЛА, а также тромбоза глубоких вен левой нижней конечности. Источником ТЭЛА, как правило, служит система нижней полой вены, причем 70–80% тромбов локализуются в проксимальных венах нижней конечности, главным образом в подколенной и поверхностной бедренной. Относительно малый калибр пораженных артерий легочного русла обусловил стабильность гемодинамики пациента.
Выбор тактики лечения
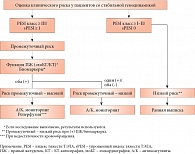
Тактика лечения ТЭЛА зависит от риска внутригоспитальной смерти. При стабильной гемодинамике этот риск первично определяется как невысокий. Согласно обновленному стандарту ESС, пациентам проводится дополнительная стратификация риска с расчетом индекса тяжести ТЭЛА по оригинальной шкале (PESI) или по ее упрощенной версии (sPESI) [6] (табл. 3); в зависимости от результатов меняется и лечебная тактика (рис. 2).
Если индекс PESI > 85 баллов (классы риска III–V) или индекс sPESI ≥ 1, риск считается промежуточным и пациенту выполняют исследование функции правого желудочка (эхоКГ) и биомаркеров повреждения миокарда (тропонин). В противном случае риск смерти низкий и пациент не нуждается в медикаментозной терапии ТЭЛА.
У нашего пациента балл PESI составил 95, sPESI – 1 (возраст, мужской пол, SaO2 < 90%). Соответственно риск промежуточный. Дилатации правого желудочка при эхоКГ не выявлено, однако отмечалось высокое систолическое давление в легочной артерии (54 мм рт. ст.), что в отсутствие альтернативной причины можно объяснить наличием ТЭЛА. Поскольку уровень тропонина не повышен, согласно алгоритму, риск промежуточный – низкий. Это означает, что пациент нуждается в антикоагулянтной терапии.
Лечение
Антикоагуляция – основа терапии ТЭЛА невысокого риска. Альтернативное лечение сводится к парентеральному назначению низкомолекулярного гепарина (НМГ) или фондапаринукса с последующим переходом на варфарин или прямой ингибитор тромбина. С первых суток назначаются оральные ингибиторы фактора Ха.
В исследовании EINSTEIN PE [7] у пациентов с ТЭЛА невысокого риска в сочетании с тромбозом глубоких вен (ТГВ) или без него эффективность ингибитора фактора Ха ривароксабана (Ксарелто) в отношении защиты от рецидивов ТЭЛА была не хуже стандартной терапии (эноксапарин + антагонисты витамина K), а снижение относительного риска больших кровотечений на фоне применения Ксарелто составило -51%. Аналогичный результат наблюдался у лиц старшего возраста (> 75 лет), с низкой массой тела (≤ 50 кг) или нарушением функции почек. В результате ривароксабан был рекомендован для лечения острой ТЭЛА со стабильной гемодинамикой широкому кругу пациентов, включая пожилых, лиц с нарушением функции почек или экстремальными значениями массы тела, в фиксированной дозе (в отличие от его назначения при фибрилляции предсердий). Режим дозирования ривароксабана при ТЭЛА (15 мг два раза в день первые три недели, затем в рамках вторичной профилактики 20 мг один раз в день независимо от возраста и клиренса креатинина) учитывает тот факт, что максимальный риск рецидива наблюдается в течение первых трех недель после первичного эпизода [8]. Применение данного препарата считается выгодной альтернативой долгосрочной терапии варфарином с учетом равной эффективности в предотвращении рецидива венозных тромбоэмболий (ВТЭ) и существенно лучшей безопасности, а также отсутствия необходимости лабораторного контроля. Это особенно актуально, поскольку даже пациенты, включенные в исследование EINSTEIN и получавшие варфарин, находились в целевом диапазоне международного нормализованного отношения лишь 58% времени [7]. Очевидно, в реальной практике этот показатель еще ниже.
Пациенту назначили Ксарелто 15 мг два раза в сутки. Через 11 суток пациент был выписан с улучшением. Рекомендована антигипертензивная терапия, статин и ривароксабан в прежней дозе с переходом на 20 мг/сут однократно с 22-го дня от начала заболевания.
Длительность вторичной антикоагулянтной профилактики
С учетом идиопатического характера ТЭЛА применение антикоагулянта у данного пациента должно быть неопределенно долгим с периодической оценкой пользы и риска развития кровотечения.
Эффект длительной вторичной профилактики ривароксабаном оценивали в исследовании EINSTEIN-EXTENSION [9]. Эффективность и безопасность этого препарата в дозе 20 мг/сут сравнивали с таковыми плацебо при его применении в течение 6–12 месяцев у пациентов, завершивших 6–12-месячный курс вторичной профилактики по поводу эпизода острой ВТЭ. Частота ВТЭ в группе Ксарелто составила 1,3%, в группе плацебо – 7,1% (р < 0,001), что соответствовало 82%-ному относительному снижению риска рецидива ВТЭ в целом независимо от клинической ситуации. Частота кровотечений в группе Ксарелто была ожидаемо выше, чем в группе плацебо, но абсолютное число кровотечений было невысоким. Длительное применение Ксарелто позволило предотвратить 34 эпизода повторной ВТЭ за счет развития четырех больших кровотечений.
Таким образом, длительное использование ривароксабана способно обеспечить дополнительную защиту от рецидива ТЭЛА без существенного повышения риска кровотечения. Его применение оправдано у лиц, имеющих очевидные показания к долгосрочной антикоагулянтной терапии после эпизода ТЭЛА (как в рассматриваемом случае). Отметим, что начиная с третьей недели препарат применяется один раз в день. Это повышает приверженность пациентов лечению.
Заключение
Высокая распространенность, высокая летальность, диагностические сложности определяют значимость клинической проблемы ТЭЛА. Использование в реальной практике основанных на доказательствах международных клинических рекомендаций во многих случаях обеспечивают успех диагностики и адекватность лечения этого серьезного заболевания.
L.L. Bershteyn
North-West State Medical University named after I.I. Mechnikov
Contact person: Leonid Lyvovich Bershteyn, l_berstein@yahoo.com
The clinical significance of pulmonary embolism (PE) is determined by its high prevalence, high mortality and diagnostic difficulties. The case presented in this paper is devoted to the diagnosis and treatment of PE in a hemodynamically stable patient in light of the updates that have appeared in 2014 European clinical Guidelines.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.