Участие интерлейкина 6 в формировании патогенетических механизмов иммуновоспалительных заболеваний
- Аннотация
- Статья
- Ссылки
- English
Биологическая активность ИЛ-6 определяется его способностью активировать гены-мишени, регулирующие дифференцировку, апоптоз и пролиферацию иммунокомпетентных клеток.
Применение гуманизированного моноклонального антитела к рецептору ИЛ-6α (тоцилизумаба) является одним из наиболее перспективных направлений в лечении ревматоидного артрита, системной красной волчанки, системной склеродермии, васкулитов крупных артерий – аортоартериита, темпорального артериита, ювенильного идиопатического артрита, синдрома макрофагальной активации и др.
В настоящее время тоцилизумаб включен в проект рекомендаций по лечению ИВЗ в условиях COVID-19, разработанных общероссийской общественной организацией «Ассоциация ревматологов России».
Результаты международных и отечественных исследований, а также собственный клинический опыт свидетельствуют о том, что тоцилизумаб является высокоэффективным и безопасным генно-инженерным биологическим препаратом (ГИБП) при лечении ИВЗ. Его применение приводит к снижению клинико-иммунологической активности и улучшению жизненного прогноза, в том числе у пациентов, у которых другие ГИБП и базисные противовоспалительные средства оказались неэффективными.
Биологическая активность ИЛ-6 определяется его способностью активировать гены-мишени, регулирующие дифференцировку, апоптоз и пролиферацию иммунокомпетентных клеток.
Применение гуманизированного моноклонального антитела к рецептору ИЛ-6α (тоцилизумаба) является одним из наиболее перспективных направлений в лечении ревматоидного артрита, системной красной волчанки, системной склеродермии, васкулитов крупных артерий – аортоартериита, темпорального артериита, ювенильного идиопатического артрита, синдрома макрофагальной активации и др.
В настоящее время тоцилизумаб включен в проект рекомендаций по лечению ИВЗ в условиях COVID-19, разработанных общероссийской общественной организацией «Ассоциация ревматологов России».
Результаты международных и отечественных исследований, а также собственный клинический опыт свидетельствуют о том, что тоцилизумаб является высокоэффективным и безопасным генно-инженерным биологическим препаратом (ГИБП) при лечении ИВЗ. Его применение приводит к снижению клинико-иммунологической активности и улучшению жизненного прогноза, в том числе у пациентов, у которых другие ГИБП и базисные противовоспалительные средства оказались неэффективными.
Введение
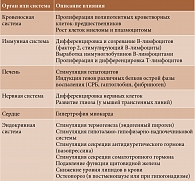
Среди цитокинов, ассоциирующихся с прогрессированием иммуновоспалительных заболеваний (ИВЗ), одну из центральных ролей играет интерлейкин 6 (ИЛ-6) [1–3]. Установлено, что ИЛ-6 функционирует как аутокринный, паракринный и гормоноподобный регулятор нормальных и патологических биологических процессов, которые условно можно разделить на иммуновоспалительные и системные. К иммуновоспалительным эффектам ИЛ-6 относят регуляцию острофазового ответа (синтез белков острой фазы воспаления, лихорадка), дифференцировку иммунных клеток, участвующих в антиинфекционном ответе, переключение с врожденного на приобретенный иммунный ответ (активация Т-хелперов (Th) 17 и Т-фолликулярных Тh, подавление образования Т-регуляторных клеток), синтез антител В-клетками (в комбинации с ИЛ-21), стимуляцию гемопоэза (созревание миелоидных предшественников и мегакариоцитов, ведущее к нейтрофилии и тромбоцитозу), неоангиогенез, остеокластоопосредованное ремоделирование костной ткани [4, 5].
Эффекты ИЛ-6 на разные органы и системы представлены в табл. 1 [2].
Системное действие ИЛ-6 сопряжено с регуляцией нейроэндокринной системы (циркадные ритмы, когнитивные и эмоциональные нарушения, депрессия, боль, бессонница, усталость), эмбриогенеза, миогенеза, регенерации клеток печени, поджелудочной железы и кишечника (барьерная функция эпителиальных клеток), сосудистого эндотелия, транспорта железа (анемия хронического воспаления), метаболизма глюкозы и липидов и др. Гиперпродукция ИЛ-6 также ассоциируется с туморогенезом, метастазированием, раковой кахексией, резистентностью к противораковой терапии [6].
Рассмотренные эффекты ИЛ-6 свидетельствуют о его влиянии на функциональную активность различных органов и систем и демонстрируют патогенетическое участие в формировании ИВЗ.
Интерлейкин 6 представляет собой малый полипептид, имеющий четыре α-спирали, стабилизированные внутримолекулярными дисульфидными связями. Уникальность ИЛ-6 обусловлена механизмом активации клеток. Передача сигнала через ИЛ-6 и его мембранный рецептор осуществляется с помощью субъединицы трансдукции сигнала – гликопротеина 130 (gp130). Этот способ активации известен как классический сигнальный путь. Ранее полагали, что клетки, не экспрессирующие мембранные рецепторы ИЛ-6, не способны отвечать на ИЛ-6. Однако существует и другой сигнальный каскад, в котором задействованы растворимые рецепторы ИЛ-6, образующиеся при протеолитическом расщеплении мембранных рецепторов ИЛ-6 в результате воздействия металлопротеиназ или альтернативного сплайсинга. Растворимый комплекс «растворимые рецепторы ИЛ-6/ИЛ-6» взаимодействует с молекулой gp130, представленной на многих типах клеток, и индуцирует сигнализацию. Этот уникальный механизм активации клеток известен как транссигнализация, или транссигнальный путь. Необходимо отметить, что основные сигнальные пути интерлейкина 6 и фактора некроза опухоли α (ФНО-α) различны: JAK/STAT – для ИЛ-6, NF-κB – для ФНО-α [7–10].
Роль интерлейкина 6α в развитии иммуновоспалительных заболеваний
При ревматоидном артрите системные эффекты ИЛ-6 приводят к развитию острофазового ответа, характеризующегося выработкой белков острой фазы, в частности С-реактивного белка (СРБ). Рассматриваемый цитокин стимулирует рост гепатоцитов и продукцию гепсидина, играющего важную роль в формировании анемии. Гепсидин ингибирует высвобождение железа из макрофагов, а также угнетает абсорбцию алиментарного железа в кишечнике. Поэтому у пациентов с ИВЗ высока частота встречаемости анемий, которые практически не корригируются препаратами железа. ИЛ-6 способен влиять на метаболизм костной ткани, поскольку сигнал, переданный через растворимые рецепторы ИЛ-6, вызывает дифференцировку и активацию остеокластов. Повышенная сигнализация ИЛ-6 нарушает баланс формирования костной ткани, как следствие, усиливается костная резорбция. Показано, что у трансгенных мышей с гиперэкспрессией ИЛ-6 увеличиваются количество остеокластов и их активность, за счет чего изменяется микроархитектоника губчатой костной ткани [11].
ИЛ-6 играет важную роль в развитии и прогрессировании системной красной волчанки. Этот цитокин принимает участие в дифференцировке CD4/CD8-T-лимфоцитов, Т-регуляторных клеток, продукции аутоантител В-лимфоцитами, повышает выживаемость плазмобластов. По некоторым данным, при системной красной волчанке отмечается повышенное содержание сывороточного ИЛ-6, что коррелирует с активностью заболевания и количеством антител к двуспиральной ДНК. Установлено увеличение мочевой экскреции ИЛ-6 при волчаночном нефрите, а также числа мононуклеарных клеток, синтезирующих ИЛ-6, при системной красной волчанке [12, 13].
Избыточная экспрессия ИЛ-6 обнаружена в мононуклеарных клетках периферической крови, макрофагах легочной ткани и в фибробластах кожи больных системной склеродермией [14]. Известно, что при данной патологии ИЛ-6 оказывает ряд важных эффектов на фибробласты, соединяясь с рецепторами на поверхности склеродермических фибробластов и приводя к увеличению функциональной активности. Этот феномен может лежать в основе формирования и поддержания склеродермического фенотипа фибробластов. ИЛ-6 стимулирует продукцию коллагена фибробластами, выделенными из пораженной кожи пациентов с системной склеродермией. Наряду с активацией фибробластов и эндотелия ИЛ-6 воздействует на разные субпопуляции клеток иммунной системы. Так, он индуцирует Т-клеточную активацию и поликлональную активацию В-лимфоцитов, что может объяснять поликлональную экспансию В-клеток и гипергаммаглобулинемию, которая нередко наблюдается при системных ревматических заболеваниях, в частности системной склеродермии [15].
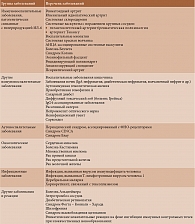
Участие ИЛ-6 также отмечено в развитии неспецифического аортоартериита и гигантоклеточного артериита. Так, значение ИЛ-6 как потенциальной мишени для лечения гигантоклеточного артериита подтверждается выраженной экспрессией РНК ИЛ-6, продукцией ИЛ-6 в пораженных сосудах и повышением в сыворотке крови концентрации его растворимого рецептора. Показано, что уровень сывороточного ИЛ-6 коррелирует с активностью гигантоклеточного артериита [16].
Заболевания, патогенетически связанные с гиперпродукцией ИЛ-6, представлены в табл. 2 [7].
Применение блокатора рецептора интерлейкина 6 в терапии иммуновоспалительных заболеваний
Тоцилизумаб (ТЦЗ) – моноклональное антитело к человеческому рецептору ИЛ-6, одобренное для лечения ревматоидного артрита. Данные антитела связываются как с мембранными, так и с растворимыми рецепторами цитокина. В результате блокируются классический и транссигнальный пути активации ИЛ-6 [17–22].
В рекомендациях экспертов Европейской антиревматической лиги 2016 г. указано, что в отсутствие адекватного ответа у пациентов с ревматоидным артритом на терапию метотрексатом (МТ) должна быть рассмотрена возможность добавления к базисной терапии препаратов второй линии. Это могут быть ингибиторы ФНО-α, абатацепт, ингибиторы ИЛ-6, анти-В-клеточная терапия, ингибиторы янус-киназ. При этом не уточняется разница между имеющимися биологическими болезнь-модифицирующими антиревматическими препаратами (бБМАРП) и таргетными синтетическими БМАРП (тсБМАРП). Однако отмечается, что бБМАРП и тсБМАРП необходимо комбинировать с обычными синтетическими БМАРП (сБМАРП). Согласно указанным рекомендациям, у пациентов, которые не могут принимать сБМАРП в качестве сопутствующего препарата, ингибиторы ИЛ-6 и тсБМАРП имеют преимущество перед другими бБМАРП [8, 23].
Следует подчеркнуть, что ТЦЗ имеет более высокую эффективность при монотерапии, чем ингибиторы ФНО-α [9, 17].
В исследованиях последних лет показано, что применение ТЦЗ у пациентов с тяжелым течением болезни Стилла взрослых приводит к снижению клинико-лабораторной активности процесса [20].
Ниже представлены данные собственной клинической практики применения ТЦЗ.
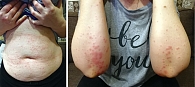
Пациентка С., 1979 г.р. В дебюте заболевания (ноябрь 2015 г.) лихорадка до 39 ºС, макулопапулезная сыпь на коже туловища и верхних конечностей (рисунок). В начале декабря 2015 г. зафиксировано присоединение воспалительного суставного синдрома. Перорально принимала нестероидные противовоспалительные препараты (НПВП) с незначительным эффектом. Стационарное лечение проводилось в отделении ревматологии при Северо-Западном государственном медицинском университете им. И.И. Мечникова с 15 по 30 декабря 2015 г.
Для исключения инфекционных и онкологических заболеваний было проведено комплексное обследование.
В отсутствие эрозивных изменений по результатам рентгенографии кистей, стоп, сакроилиита по данным магнитно-резонансной томографии крестцово-подвздошных суставов и на основании результатов иммунологического обследования (серонегативность по ревматоидному фактору (РФ), отсутствие в сыворотке крови антител к цитруллинированному пептиду (АЦЦП), антител к виментину, антинуклеарного фактора (АНФ), антител к двуспиральной ДНК, антител к фосфолипидам, антинейтрофильных цитоплазматических антител (АНЦА)) убедительных данных за определенную нозологическую форму не получено.
Поставлен рабочий диагноз: недифференцированный артрит, активность 3, функциональная недостаточность суставов 2.
Проведен курс противовоспалительной терапии (в/м дексаметазон, дозы не указаны), начат прием преднизолона в дозе 15 мг/сут, аминохинолиновых препаратов (гидроксихлорохин в дозе 200 мг два раза в день).
После выписки отмечались периодическое повышение температуры до фебрильных значений, рецидив суставного синдрома, кожные высыпания, боли в горле.
Повторная госпитализация в отделение ревматологии при Северо-Западном государственном медицинском университете им. И.И. Мечникова с 25 апреля по 12 мая 2016 г.
С учетом лихорадки, наличия макулопапулезной сыпи на коже конечностей и живота без зуда, артралгий, болей в горле, отрицательных значений РФ и АНФ, верифицирован диагноз: болезнь Стилла взрослых, активность средняя, функциональный класс II.
В качестве базисной терапии назначен МТ в дозе 15 мг/нед в комбинации с гидроксихлорохином в дозе 200 мг/сут, увеличена доза преднизолона до 25 мг/сут, что привело к положительной клинико-лабораторной динамике.
После выписки пациентка продолжила прием МТ с эскалацией дозы до 25 мг/нед, гидроксихлорохина в дозе 200 мг/сут. К октябрю 2016 г. доза преднизолона постепенно снизилась до 15 мг/сут.
На фоне уменьшения дозы преднизолона зафиксировано нарастание суставного синдрома.
С 22 февраля 2017 г. инициирована терапия ритуксимабом в дозе 500 мг в режиме две инфузии с перерывом две недели. Больная отмечала инфузионные реакции: после первой инфузии – заложенность носа, после второй – першение в горле, которые купировались самостоятельно. Повторное введение ритуксимаба по аналогичной схеме в сентябре 2017 г. эффекта не оказало.
В ноябре 2017 г. и январе 2018 г. в связи с высокой клинико-лабораторной активностью проводилась пульс-терапия метилпреднизолоном в дозе 1000 мг (три процедуры), циклофосфаном в дозе 1000 мг (одна процедура) с частичным эффектом.
После выписки больная продолжила прием МТ в дозе 25 мг/нед, преднизолона в дозе 20 мг/сут.
Вследствие неэффективности проводимой терапии с 18 мая 2018 г. начата терапия ТЦЗ в дозе 8 мг/кг один раз в четыре недели. После трех инфузий ТЦЗ купировалась лихорадка, регрессировала сыпь, снизилась интенсивность суставного синдрома, произошла стойкая нормализация острофазовых показателей.
Длительность регулярной терапии ТЦЗ составила 1 год 8 месяцев, переносимость лечения была хорошей. Побочных эффектов не отмечено.
В настоящее время пациентка получает комбинированную терапию МТ в дозе 25 мг/нед и ТЦЗ в дозе 8 мг/кг один раз в четыре недели. Потребность в НПВП минимальная, отменен преднизолон, сохраняется низкая активность заболевания (DAS-28 ESR – 3,19 балла).
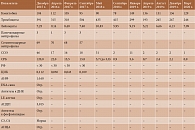
Таким образом, назначение ТЦЗ пациентке с торпидным течением болезни Стилла взрослых в отсутствие значимого эффекта от терапии глюкокортикоидами (ГК), циклофосфаном и ритуксимабом привело к стойкой клинико-лабораторной ремиссии и полной отмене преднизолона. Динамика лабораторных показателей в процессе наблюдения за пациенткой представлена в табл. 3.
Согласно российским рекомендациям, у пациентов с ревматоидным артритом ТЦЗ может быть эффективен при развитии АА-амилоидоза [5].
В подтверждение ниже приведены данные собственного клинического наблюдения.
Больная Е., наблюдается в клинической ревматологической больнице № 25 Санкт-Петербурга с 1997 г.
Диагноз «ревматоидный артрит» верифицирован в 1998 г., дебют с поражения крупных суставов, в последующем развитие полиартрита.
С 1998 по 2013 г. проводилась пероральная терапия МТ в дозе 10 мг/нед, отмечалась плохая переносимость более высоких доз – повышение печеночных ферментов более трех верхних границ нормы, тошнота, недомогание, частые ОРВИ.
С 2005 г. получала преднизолон в дозе 5–10 мг/сут, однако эффект был недостаточным, сохранялись боли, преимущественно в коленных, локтевых, лучезапястных суставах, мелких суставах кистей и стоп, отмечено постепенное формирование ульнарной девиации кистей. Обращали на себя внимание выраженная генерализованная амиотрофия, дефицит массы тела (индекс массы тела – 16,1 кг/м2).
С 2010 г. зафиксировано снижение скорости клубочковой фильтрации (СКФ) до 50 мл/мин/1,73м2 (хроническая болезнь почек С3а). Периодически выявлялись умеренная протеинурия (до 0,5 г/сут), гиперхолестеринемия (8,2 ммоль/л), гипопротеинемия (60 г/л).
В 2013 г. начата терапия лефлуномидом в дозе 20 мг/сут в сочетании с преднизолоном перорально в дозе 5–10 мг/сут, при этом сохранялся стойкий суставной синдром (DAS-28 – 5,3 балла). Повышение скорости оседания эритроцитов (СОЭ) (31 мм/ч), СРБ (28 мг/л), четырехкратное увеличение РФ, шестикратное – АЦЦП, двухкратное – циркулирующих иммунных комплексов (ЦИК). Устойчивое снижение СКФ – с 63 до 43 мл/мин/1,73м2, протеинурия – до 1 г/сут.
В 2015 г. к терапии добавлен колхицин в дозе 1 мг/сут, с кратковременным снижением выраженности клинико-лабораторной активности, но с прогрессированием снижения СКФ до 23 мл/мин/1,73м2. Терапия колхицином и лефлуномидом была отменена.
В 2017 г. проведена нефробиопсия, морфологически подтвержден диагноз «АА-амилоидоз».
Пациентке была назначена терапия этанерцептом в дозе 50 мг/нед подкожно. На этом фоне незначительно уменьшилась выраженность суставного синдрома, сохранялась повышенная СОЭ (41 мм/ч), уровень СРБ (25 мг/л), серопозитивность по РФ, СКФ снизилась до 11 мл/мин1,73м2 (определялась по формуле Кокрофта – Голта), протеинурия – 1,1 г/сут, диурез – 1 л/сут.
Пациентка осмотрена нефрологом – показания к экстренному проведению заместительной почечной терапии отсутствовали.
Длительность терапии этанерцептом составила три месяца в связи с его отменой в отсутствие эффекта. Комиссионно по согласованию с нефрологами назначена терапия ТЦЗ в дозе 8 мг/кг (280 мг) внутривенно каждые четыре недели, при этом пациентка продолжала прием преднизолона в дозе 10 мг/сут. В течение первых четырех недель терапии зафиксировано отчетливое снижение суставного синдрома (DAS-28 – 7,3 → 4,5 балла), уровня острофазовых показателей – СРБ (4,5 мг/л), СОЭ (25 мм/ч). Поэтому доза преднизолона была уменьшена до 5 мг/сут. В течение последующих 18 месяцев пациентка получала терапию ТЦЗ в дозе 280 мг каждые четыре недели, с достижением клинической ремиссии к 12-му месяцу лечения. Нежелательных явлений, а также значимых инфекционных осложнений на фоне данной терапии не зафиксировано.
Протеинурия снизилась с 1,1 до 0,7 г/сут, диурез оставался на уровне 1,0–1,5 л/сут при устойчиво низких значениях СКФ (10–16 мл/мин/1,73м2 (по формуле Кокрофта – Голта)).
Через полтора года терапии сохранялась устойчиво низкая лабораторная активность болезни (СРБ – 3,4 мг/л, СОЭ – 18 мм/ч).
Данное клиническое наблюдение подтверждает, что применение ТЦЗ у пациентов с ревматоидным артритом и вторичным амилоидозом почек в качестве второй линии терапии генно-инженерными биологическими препаратами (ГИБП) после неэффективности блокаторов ФНО-α способствует устойчивому снижению клинико-лабораторной активности ревматоидного артрита, а также замедлению прогрессирования амилоидоза.
В настоящее время накоплен клинический опыт применения ТЦЗ при системной красной волчанке, системной склеродермии, системном ювенильном идиопатическом артрите, осложненном синдромом макрофагальной активации, системных васкулитах с поражением сосудов крупного калибра (гигантоклеточном артериите, неспецифическом аортоартериите).
Следует отметить, что применение ТЦЗ при системной красной волчанке может быть эффективно при высокой воспалительной активности, сопровождающейся лихорадкой, полиартритом, полисерозитом, поражением кожи и гемолитической анемией. ТЦЗ в стандартной дозе 8 мг/кг/мес способствует быстрому купированию внепочечных проявлений патологии, нормализации уровня СРБ, снижению ежедневной дозы преднизолона. Феномен снижения иммунологической активности системной красной волчанки, нормализация уровня антител к ДНК и повышение содержания фракций комплемента требуют дальнейшего изучения, в частности возможного механизма блокирования функции антител-продуцирующих клеток. ТЦЗ отличается удовлетворительным профилем безопасности и может рассматриваться как альтернатива при недостаточном эффекте ГК, цитостатиков и ритуксимаба.
Роль и место ТЦЗ в алгоритмах терапии системной красной волчанки должны быть уточнены в последующих открытых и контролируемых клинических исследованиях [12, 13, 24].
Были проведены клинические исследования эффективности ТЦЗ и при системной склеродермии. Согласно предварительным данным двойного слепого плацебо-контролируемого клинического исследования фазы II и III, в котором 43 больных в течение 48 недель еженедельно получали 162 мг TЦЗ подкожно и 44 – плацебо, у значительно большей части применявших ТЦЗ было отмечено улучшение состояния, оцениваемого по опроснику оценки состояния здоровья (индекс инвалидизации), – 28 против 7% (р = 0,01) [14, 15, 25]. На 48-й неделе нежелательные реакции и серьезные нежелательные реакции зарегистрированы у 98 и 33% соответственно в группе ТЦЗ и у 91 и 34% соответственно в группе плацебо. Серьезные инфекционные осложнения чаще регистрировались в группе ТЦЗ, чем в группе плацебо, – у семи и двух больных соответственно.
В настоящее время исследование эффективности и переносимости ТЦЗ при системной склеродермии продолжается [26].
Тоцилизумаб подтвердил свою эффективность и в лечении васкулитов крупных артерий (гигантоклеточного артериита в сочетании с ревматической полимиалгией и неспецифическим аортоартериитом) [27, 28].
Результаты рандомизированных плацебо-контролируемых исследований GiACTA фазы III свидетельствуют о том, что применение ТЦЗ у больных гигантоклеточным артериитом (первые шесть месяцев в сочетании с ГК с постепенным снижением дозы) обеспечивало значительное увеличение частоты достижения устойчивой ремиссии через год от начала терапии по сравнению с монотерапией ГК – 56 и 14% соответственно.
Полученные результаты стали основанием для официальной регистрации ТЦЗ при лечении гигантоклеточного артериита [29, 30].
Опубликованы результаты открытого исследования фазы IIA у больных ревматической полимиалгией, в котором показана эффективность курсов ТЦЗ со средней продолжительностью 3,9 ± 0,9 месяца [31].
На фоне лечения ТЦЗ ремиссия или улучшение наблюдались у 85% больных неспецифическим аортоартериитом, в том числе рефрактерного течения.
Согласно результатам рандомизированных плацебоконтролируемых исследований, отсутствие рецидивов через шесть месяцев поддерживающего лечения ТЦЗ отмечалось чаще, чем при использовании плацебо, – 51 и 23% соответственно, однако различия не достигли статистической значимости (р = 0,0596). В связи с возможностью рецидива у пациентов с неспецифическим аортоартериитом, получающих лечение ТЦЗ, целесообразно сочетать его с цитостатиками, прежде всего с МТ [32, 33].
За последнее десятилетие с внедрением в клиническую практику ГИБП существенно изменилась парадигма фармакотерапии ювенильного идиопатического артрита. Использование препаратов данной группы позволило улучшить прогноз в отношении деструкции суставов и амилоидоза, однако системный вариант ювенильного идиопатического артрита по-прежнему характеризуется самым высоким риском развития жизнеугрожающих состояний, в первую очередь из-за синдрома активации макрофагов. Синдром активации макрофагов является одним из гистиоцитарных заболеваний, развивающихся из клеток макрофагального ряда, – гемофагоцитарным лимфогистиоцитозом. В настоящее время описаны случаи успешного применения ТЦЗ при тяжелом системном варианте ювенильного идиопатического артрита с развитием вторичного синдрома активации макрофагов. Лечение ТЦЗ в короткие сроки обеспечивало снижение клинических и лабораторных показателей активности болезни, повышение качества жизни, ремиссию системного ювенильного идиопатического артрита и гемофагоцитарного синдрома [34].
Изучение эффективности тоцилизумаба при остром респираторном дистресс-синдроме вследствие COVID-19
В развитии острого респираторного дистресс-синдрома вследствие COVID-19 основную роль играет избыточный ответ иммунной системы со стремительно развивающимся фатальным цитокиновым штормом.
Проведенные исследования показали, что смертность при COVID-19 ассоциирована в том числе с повышением уровня ИЛ-6.
У пациентов с COVID-19 изучена эффективность ТЦЗ. Препарат применялся при тяжелом респираторном дистресс-синдроме с признаками цитокинового шторма и в большинстве случаев позволял достигать нормализации температуры тела, снижения выраженности клинических симптомов и потребности в кислороде уже после однократного введения (400 мг внутривенно капельно).
В марте 2020 г. эксперты Управления по контролю качества пищевых продуктов и лекарственных средств США одобрили проведение клинических испытаний ТЦЗ в качестве терапии для взрослых пациентов с COVID-19.
Важно отметить, что ТЦЗ включен в проект рекомендаций по лечению ИВЗ в условиях новой коронавирусной инфекции, разработанных Ассоциацией ревматологов России [35].
Заключение
Ингибирование ИЛ-6 является патогенетически обоснованным при ИВЗ. Представленные данные международных и отечественных исследований, а также собственный клинический опыт дают основания полагать, что тоцилизумаб – гуманизированное моноклональное антитело к рецептору ИЛ-6 является высокоэффективным и безопасным ГИБП при ИВЗ, в том числе в период пандемии COVID-19. Он приводит к снижению клинико- иммунологической активности процесса и улучшению жизненного прогноза как при назначении в качестве ГИБП первой линии, так и при назначении в качестве второй линии (после неэффективности других ГИБП и базисных противовоспалительных средств).
V.I. Mazurov, MD, PhD, Prof., Academician of the RASci., I.B. Belyayeva, MD, PhD, Prof., R.R. Samigullina, A.L. Chudinov, A.M. Dadalova1
North-Western State Medical University named after I.I. Mechnikov
Clinical Rheumatology Hospital No. 25, St. Petersburg
Contact person: Irina B. Belyayeva, belib@mail.ru
The article discusses the participation of interleukin 6 (IL-6) in the formation of pathogenetic mechanisms of immuno-inflammatory diseases (IID).
The biological activity of IL-6 is determined by its ability to activate target genes that regulate differentiation, apoptosis and proliferation of immunocompetent cells.
Currently, the use of a humanized monoclonal antibody to the IL-6α receptor (tocilizumab) is one of the most promising directions in the treatment of rheumatoid arthritis, systemic lupus erythematosus, systemic scleroderma, large arterial vasculitis – aortoarteritis, temporal arteritis.
The use of tocilizumab is included in the draft recommendations for the treatment of IVS in conditions of coronavirus disease 2019 (COVID-19) developed by the All-Russian public organization “Association of Rheumatologists of Russia”.
The presented data from international and domestic studies, as well as our own clinical experience, suggest that tocilizumab (Actemra) is a highly effective and safe genetic engineering biological drug in the treatment of IID, and its use leads to a decrease in clinical and immunological activity and helps to improve life prognosis including the ineffectiveness of other biological drugs and basic anti-inflammatory drugs in this category of patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.