Устекинумаб при болезни Крона с перианальными проявлениями и псориазоподобными изменениями кожи, индуцированными анти-ФНО-терапией
- Аннотация
- Статья
- Ссылки
- English


Введение
Болезнь Крона (БК) – хроническое, рецидивирующее заболевание желудочно-кишечного тракта (ЖКТ) неясной этиологии, характеризующееся трансмуральным, сегментарным, гранулематозным воспалением с развитием местных и системных осложнений [1]. По разным данным, перианальные проявления регистрируются в 25–54% случаев и нередко требуют более агрессивной консервативной терапии в сочетании с хирургическими методами [2–4]. Одним из наиболее эффективных методов консервативного лечения пациентов с перианальной БК считается биологическая терапия с применением ингибиторов фактора некроза опухоли (ФНО) альфа [4, 5]. Однако их назначение сопряжено с риском развития нежелательных явлений, в частности псориаза или псориазоподобных изменений кожи. Возникновение таких реакций требует коррекции терапии, обычно в виде отмены препарата, и усложняет дальнейший выбор схемы адекватного лечения обоих состояний – БК и псориаза [6].
Препарат устекинумаб показал долгосрочную эффективность и безопасность у пациентов не только с псориазом, псориатическим артритом, но и с БК [7–9]. На текущий момент достаточных данных в отношении эффективности устекинумаба при перианальных проявлениях БК нет.
Клинический случай
Пациентка Я., 21 год, в феврале 2018 г. отметила появление болей в животе. Данные эзофагогастродуоденоскопии (ЭГДС): острые эрозии антрального отдела желудка, поверхностный гастрит. Пациентка принимала препарат висмута и ингибитор протонной помпы (ИПП) с клиническим улучшением. В дальнейшем симптомы абдоминальной боли стали нарастать, появились запоры и, как следствие, отеки геморроидальных узлов. Назначенная проктологом терапия диосмином существенного улучшения самочувствия не дала. Пациентка повторно обратилась за медицинской помощью. При осмотре был установлен диагноз острого заднего подковообразного парапроктита.
19 апреля 2018 г. выполнена операция в объеме вскрытия и дренирования абсцесса, некрэктомии. В анализах крови обращало на себя внимание снижение уровня гемоглобина до 108 г/л. В послеоперационном периоде беспокоили боли в области операционной раны, незаживающая рана. Боль в животе не прекращалась, и 28 мая 2018 г. была выполнена контрольная ЭГДС: картина эрозий желудка и эзофагита. Повторно назначена терапия ИПП и препаратом висмута. По поводу длительно незаживающей раны промежности пациентка была направлена в ФГБУ «ГНЦК им. А.Н. Рыжих» Минздрава России для решения вопроса о дальнейшей тактике лечения.
Илеоколоноскопия, проведенная в центре 16 июля 2018 г., показала единичные эрозии терминального отдела подвздошной кишки. Во всех отделах толстой кишки грубой органической патологии не выявлено.
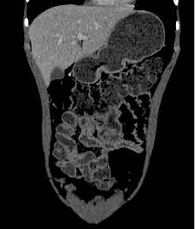
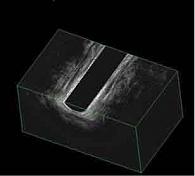
20 июля 2018 г. выполнена компьютерная томография тонкой кишки (КТ-энтерография): картина БК с сегментарным поражением тонкой кишки, фаза активного воспалительного процесса (рис. 1).
В связи с поражением тощей и подвздошной кишок, наличием перианальных проявлений, с учетом фертильного возраста пациентке назначили цертолизумаба пэгол 400 мг подкожно в стандартном режиме введения. 13 августа 2018 г. выполнено первое введение индукционного курса биологического препарата.
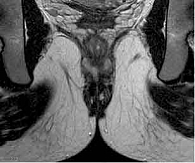
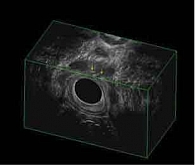
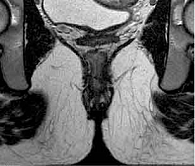
При контрольном обследовании в феврале 2019 г. констатирована медикаментозная ремиссия в тонкой кишке, по данным илеоколоноскопии и магнитно-резонансного исследования тонкой кишки (МР-энтерографии), на фоне проводимой терапии биологическим препаратом цертолизумаба пэгол 400 мг. Однако, по данным магнитно-резонансной томографии (МРТ) малого таза, на уровне верхней трети анального канала на 6 часах по условному циферблату определены внутреннее свищевое отверстие и отходящий от него подслизистый затек в стенке прямой кишки на 3 часах размером 0,5 см. Визуализируются ретроректальный затек на уровне пуборектальной петли на 3–9 часах шириной 0,5 см, транссфинктерный затек на 5–6 часах размером 0,6 см (рис. 2). Трансректальное ультразвуковое исследование (УЗИ) показало УЗ-признаки высокого заднего неполного подковообразного свища прямой кишки с подслизистым затеком (рис. 3).
Пациентка была направлена на консультацию колопроктолога. При осмотре перианальная область по задней полуокружности деформирована, определен подковообразный послеоперационный рубец. Пальцевое ректальное исследование умеренно болезненное, палец свободно проходим, тонус сфинктера и волевые усилия удовлетворительные. На 7 часах по условному циферблату определяется воронкообразное углубление, справа и слева (на 8 и 4–5 часах) – затеки. С учетом данных МРТ органов малого таза и трансректального УЗИ показаний к хирургическому лечению нет. Рекомендовано продолжить консервативную терапию с добавлением суппозиториев с метронидазолом и оценкой эффективности терапии через два-три месяца.
Пациентка продолжила биологическую терапию цертолизумаба пэголом 400 мг подкожно каждые четыре недели.
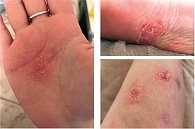
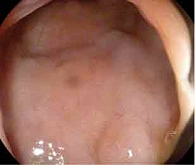
В июне 2019 г. на фоне введения препарата появились высыпания на коже верхних и нижних конечностей (рис. 4).
Пациентку направили на лечение в дерматологический стационар. В связи с развитием кожных изменений на фоне терапии анти-ФНО-препаратом рекомендовано биологический препарат заменить препаратом другого класса – устекинумабом.
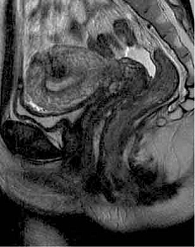
В июле 2019 г. в условиях ФГБУ «ГНЦК им. А.Н. Рыжих» проведено контрольное обследование. Илеоколоноскопия показала афты терминального отдела подвздошной кишки. КТ-энтерография: картина БК в форме илеита с поражением терминального отдела подвздошной кишки, фаза минимальной степени активности воспалительного процесса. МРТ малого таза: на уровне верхней трети анального канала на 6 часах – внутреннее свищевое отверстие, от которого отходят подслизистый затек в стенке прямой кишки на 3 часах размером 0,5 см и ретроректальный затек на уровне пуборектальной петли на 2–10 часах шириной 0,5 см (рис. 5). Трансректальное УЗИ: УЗ-признаки высокого заднего неполного внутреннего подковообразного свища прямой кишки с затеками по ходу ножек леватора, без отрицательной динамики по сравнению с предыдущим исследованием (рис. 6).
С учетом адекватного дренирования свищевых ходов хирургическое лечение не показано. Противопоказаний к проведению биологической терапии устекинумабом нет.
В августе 2019 г. выполнено первое и второе введение индукционного курса (в дозе, рекомендованной для лечения псориаза, – 45 мг подкожно на нулевой и четвертой неделях и далее каждые 12 недель) с выраженным положительным эффектом в виде исчезновения всех кожных изменений после второго введения. Однако пациентка отметила увеличение объема слизисто-гнойного отделяемого из прямой кишки.
В ноябре 2019 г. повторно проведено обследование в условиях центра. Илеоколоноскопия: единичные афты в терминальном отделе подвздошной кишки (рис. 7). МР-энтерография: признаков активности воспаления в тонкой кишке не выявлено. МРТ малого таза: рубцовые изменения анального канала и прямой кишки (рис. 8). Трансректальное УЗИ: УЗ-признаки заднего высокого неполного внутреннего свища прямой кишки с наличием спавшегося облитерированного затека (рис. 9).
Рекомендовано продолжить терапию устекинумабом, но дозу оптимизировать до адекватной для лечения БК – 90 мг каждые 12 недель.
На фоне проводимой терапии состояние пациентки оставалось стабильно удовлетворительным, жалобы отсутствовали.
Контрольное обследование проведено в феврале 2020 г. КТ-энтерография: во всех отделах тонкой кишки участков утолщения кишечной стенки и повышенного накопления контрастного вещества не выявлено. МРТ малого таза: рубцовые изменения анального канала и прямой кишки. УЗИ кишечника и трансректальное УЗИ: петли тонкой кишки не расширены, прослеживается ритмичная перистальтика. Стенка терминального отдела подвздошной кишки не утолщена – 1,8 мм, структура не нарушена, при энергетической допплерографии – без патологической васкуляризации. Стенки тонкой кишки на остальных доступных для осмотра участках не утолщены, структура сохранна. Ободочная кишка не расширена, до правого изгиба представлена гаустрами длиной до 18 мм, пневматизирована. Стенки ободочной кишки не утолщены, 2–3 мм, структура не нарушена, при допплерографии патологическая васкуляризация не определена. Ректальный датчик частотой 10 мГц введен на расстояние 10 см от края ануса. Стенка не утолщена – 2–3 мм за счет всех слоев, более выражен подслизистый, структура не нарушена, при энергетической допплерографии – без патологической васкуляризации. В параректальной клетчатке увеличенные лимфоузлы не визуализируются. Хирургическая длина анального канала – 40 мм. Дифференцируется внутренний сфинктер толщиной 2 мм на 6 часах условного циферблата, склеротически измененный, наружный – 9 мм. Эпителий-подэпителиальная выстилка не утолщена, средней эхогенности. Определяемая ранее полость на текущий момент не дифференцируется. УЗ-признаков активности воспалительного процесса в тонкой и толстой кишках во время исследования не выявлено. Определяемая ранее ишиоанальная полость более не дифференцируется (рис. 10). Илеоколоноскопия: колоноскоп проведен в купол слепой кишки и далее в тонкую кишку на 10 см. Просвет осмотренной части тонкой кишки не изменен, складки мелкие, перистальтика прослеживается, слизистая оболочка розовая, бархатистая. Просвет толстой кишки во всех отделах не изменен, складки выражены, тонус кишки нормальный, перистальтика активная. Слизистая оболочка слепой, восходящей, поперечной ободочной, нисходящей, сигмовидной и прямой кишок розовая, сосудистый рисунок четкий.
С учетом выраженной положительной динамики со стороны перианальных проявлений за период наблюдения (с марта 2019 г.) пациентка в хирургическом лечении не нуждается. Рекомендовано продолжить консервативную терапию устекинумабом 90 мг подкожно каждые 12 недель.
Обсуждение
Развитие перианальных явлений на фоне БК усложняет ведение пациентов. С одной стороны, свищи плохо поддаются базисной терапии иммуносупрессорами и требуют более агрессивного лечения. С другой, для проведения необходимой консервативной терапии требуется хирургическое вмешательство для обеспечения адекватного дренирования гнойных затеков, если таковые имеются [3–5]. В сочетании с хирургией или без нее наиболее эффективным считается применение ингибиторов ФНО-альфа [7]. Однако в публикациях все чаще встречается информация о кожных побочных эффектах, обусловленных применением препаратов анти-ФНО-альфа. В частности, псориаз и псориазоподобные поражения вызывают особую озабоченность, поскольку ингибиторы ФНО-альфа также используются при лечении псориаза [6]. Частота встречаемости этого явления, по данным литературы, варьируется от 1,7 до 10% [8–12]. Ведение пациентов с такими кожными поражениями усложняется из-за необходимости отмены анти-ФНО-альфа и недостатка других терапевтических вариантов. Не случайно оптимизация современных местных и системных методов терапии и включение в схему лечения новых терапевтических агентов представляют большой интерес.
Ранее в отсутствие других классов биологических препаратов при псориазоподобных поражениях использовали только местные (глюкокортикостероиды (ГКС), ингибиторы кальциневрина и антибиотики) или системные препараты (фототерапия, ацитретин, ГКС и антибиотики) [6]. С появлением в арсенале врачей устекинумаба, недавно одобренного для лечения БК, терапевтические опции для пациентов с непереносимостью ингибиторов ФНО-альфа расширились. Одно из преимуществ данного препарата – эффективность при псориазе и БК [13].
В многоцентровом исследовании с участием 70 пациентов с воспалительными заболеваниями кишечника и сочетанным псориазом или псориатическим артритом эффективность устекинумаба в достижении клинической ремиссии составила 84,7% через шесть месяцев терапии [14].
В рассмотренном клиническом случае при выборе терапии возникли сложности по двум направлениям. Во-первых, имела место недостаточная эффективность в отношении ремиссии БК (сохранялись минимальная активность в тонкой кишке, свищи прямой кишки). Во-вторых, развилось нежелательное явление на цертолизумаба пэгол в виде псориазоподобного поражения кожи. Как известно, назначение второго анти-ФНО-препарата при неэффективности первого менее эффективно, чем смена препарата одного класса на препарат другого класса [15]. Кроме того, кожные проявления, индуцированные одним ингибитором ФНО-альфа, препятствуют назначению другого, поскольку данная парадоксальная реакция касается не конкретного биологического препарата, а всего класса препаратов. Из других классов биологических препаратов на сегодняшний день для лечения БК зарегистрированы ведолизумаб и устекинумаб. Однако ведолизумаб считается селективным препаратом и не показан при псориазе. На фоне терапии ведолизумабом положительная динамика в отношении кожных проявлений возможна [16], но скорее всего она связана с прекращением воздействия ингибитора ФНО-альфа и зависит от степени выраженности кожных проявлений. При выборе препарата для пациентки Я. учитывалась активная перианальная БК. В отношении обоих препаратов данные об эффективности заживления свищей ограниченны. Недавний метаанализ, посвященный оценке терапии перианальных проявлений БК, включал публикации, касающиеся эффективности препаратов анти-ФНО-альфа, и несколько статей по устекинумабу и ведолизумабу [7]. Показано, что кроме препаратов анти-ФНО-альфа как наиболее эффективных при перианальной БК применение ведолизумаба имеет низкую доказательность, применение устекинумаба – среднюю.
Был проведен ряд исследований в небольших когортах пациентов. Например, P. Wils и соавт. (исследование GETAID) описали французскую когорту больных – девять пациентов с перианальными проявлениями. Восемь (89%) из них продемонстрировали клинический ответ через три месяца после лечения устекинумабом [17].
В исследованиях с участием других когорт больных получены аналогичные результаты. Речь, в частности, идет об испанской (61% пациентов с улучшением перианальных проявлений) [18] и двух канадских когортах. Результаты, полученные в этих группах больных, свидетельствуют об эффективности устекинумаба при перианальных свищах с диапазоном показателей от 49 до 69% [19].
В будущем оптимизировать подходы к терапии пациентов с перианальными проявлениями БК позволит накопленный опыт применения разных классов биологических препаратов.
Заключение
Нежелательные реакции в виде псориазоподобного поражения кожи при использовании препаратов анти-ФНО-альфа – явление не редкое. Однако до сих пор подходы к ведению больных с такими нежелательными явлениями ограниченны, особенно когда тяжесть БК не позволяет прекратить биологическую терапию.
В рекомендациях Европейской организации по изучению болезни Крона и язвенного колита указано на возможность применения устекинумаба при медикаментозно индуцированном псориазе на фоне терапии ингибиторами ФНО-альфа [20].
Приведенный клинический случай свидетельствует об оптимальной, с нашей точки зрения, схеме лечения с применением устекинумаба. Препарат продемонстрировал эффективность при сочетанной патологии и хорошую переносимость.
M.V. Shapina, PhD, S.S. Belous
A.N. Ryzhykh National Medical Research Center of Coloproctology
Contact person: Marina V. Shapina, shapina.mv@yandex.ru
Perianal manifestations of Crohn's disease (CD) are the main factors of poor prognosis of the disease further course and often require the prescription of genetically engineered biological drugs due to the ineffectiveness of standard conservative immunosuppressors’ therapy. The greatest proven effectiveness for perianal CD are shown by inhibitors of tumor necrosis factor alpha. However, therapy with these drugs may be accompanied by undesirable phenomena, such as psoriasis or psoriasis-like skin changes, which requires the cancellation of treatment. The article presents the clinical case demonstrating the effectiveness of ustekinumab after the development of these complications in a patient with CD.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.