Эффективность препарата устекинумаб у пациента с язвенным колитом после неудачи терапии блокаторами ФНО-альфа, блокатором янус-киназ и ингибитором альфа-4-бета-7-интегрина
- Аннотация
- Статья
- Ссылки
- English
Введение
Язвенный колит (ЯК) – хроническое заболевание толстой кишки, характеризующееся иммунным воспалением ее слизистой оболочки [1]. Данная патология относится к тяжелым заболеваниям терапевтического профиля из-за сомнительного прогноза, рецидивирующего, иногда непрерывного течения, развития осложнений, требующих хирургического вмешательства [2].
Эпидемиологические исследования последнего десятилетия свидетельствуют о значительном росте заболеваемости ЯК. В экономически развитых странах она превышает 200 человек на 100 тыс. населения. Заболеваемость среди мужчин и женщин сопоставима, причем пик заболеваемости приходится на социально активный возраст от 20 до 40 лет [3].
Выбор консервативного лечения ЯК определяется протяженностью поражения кишки, тяжестью течения заболевания, наличием внекишечных проявлений, длительностью заболевания, эффективностью и безопасностью предыдущей терапии, а также риском развития осложнений ЯК. Для сохранения длительной ремиссии больной ЯК должен пожизненно получать противорецидивную терапию [1, 4]. Тем не менее у половины больных ЯК рецидивирует в течение первого года после установления диагноза, ремиссия в течение 3–7 лет сохраняется лишь у четверти больных, а ежегодные рецидивы наблюдаются у каждого пятого пациента. Только у половины больных после первой атаки ЯК ремиссия сохраняется на протяжении пяти лет. Примерно 20% больных переносят колэктомию в течение десяти лет, 30% – в течение 25 лет. В среднем оперативные вмешательства при ЯК выполняются в 10–20% случаев [5].
Появление генно-инженерных биологических препаратов (ГИБП) существенно повлияло на длительность ремиссии, частоту рецидивов и развитие осложнений ЯК. Внедрение ГИБП в лечебную практику позволило эффективнее преодолевать гормонорезистентность и гормонозависимость ЯК. Кроме того, на фоне применения ГИБП снижаются риск развития рецидива, частота оперативных вмешательств, а также повышается качество жизни больных [6]. Однако часть пациентов с ЯК не отвечают на терапию блокаторами фактора некроза опухоли (ФНО) альфа. У 10–20% пациентов с ЯК отсутствует первичный ответ на терапию блокаторами ФНО-альфа, что расценивается как первичная неэффективность терапии [7, 8]. В 17–22% случаев из-за вторичной потери ответа на терапию или развития нежелательных явлений пациенты, первоначально ответившие на терапию блокаторами ФНО-альфа, прекращают лечение [7, 8]. 19–30% пациентов требуется оптимизация терапии ГИБП [7].
В случае неудачи терапии первым препаратом анти-ФНО-альфа обычно пациента переводят на другой блокатор ФНО-альфа. Ответ на второй блокатор ФНО-альфа после неудовлетворительных результатов лечения препаратом того же класса зависит от ряда факторов. Эффективность терапии вторым блокатором ФНО-альфа напрямую связана с причиной, по которой врач переводит пациента с одного анти-ФНО-альфа-препарата на другой. Подобный перевод может быть обусловлен непереносимостью препарата, первичной или вторичной неэффективностью терапии.
Как показывает анализ объединенных данных, в случае развития нежелательных явлений на фоне применения первого препарата анти-ФНО-альфа ремиссия после перевода пациента на другой препарат анти-ФНО-альфа достигается в 61% случаев. При вторичной неэффективности терапии первым препаратом анти-ФНО-альфа ремиссия при использовании второго анти-ФНО-альфа достигается в 45% случаев. При первичной неэффективности терапии ремиссия на фоне применения второго препарата анти-ФНО-альфа достигается в 30% случаев [7]. Не следует забывать и о проблеме гормонозависимости и гормонорезистентности, которая имеет место почти у 50% пациентов с ЯК [9].
Таким образом, существует потребность в разработке новых лекарственных препаратов для лечения пациентов с воспалительными заболеваниями кишечника (ВЗК), которые позволили бы добиться быстрой индукции клинической ремиссии, снизить риск иммуногенности и иных побочных эффектов [10] и характеризовались бы минимальным количеством побочных эффектов [11].
В 2020 г. в России для лечения больных ЯК зарегистрирован новый ингибитор устекинумаб (УСТ). УСТ – полностью человеческое моноклональное антитело, обладающее высокой специфичностью к субъединице р40 интерлейкинов (ИЛ) 12 и 23. УСТ блокирует биологическую активность ИЛ-12 и ИЛ-23, предотвращая связывание р40 с рецептором ИЛ-12R-бета-1, экспрессируемым на поверхности иммунных клеток [12].
Рассмотрим ключевые результаты клинического исследования UNIFI, посвященного оценке эффективности препарата УСТ при ЯК среднетяжелого и тяжелого течения как у бионаивных пациентов, так и у пациентов с предшествующей неудачей терапии блокаторами ФНО-альфа.
Результаты клинического исследования UNIFI
В двух крупных рандомизированных контролируемых исследованиях III фазы (первое исследование – индукция ремиссии на фоне терапии УСТ внутривенно, второе – поддерживающая терапия УСТ подкожно с рандомизированной отменой препарата), проводимых по одному протоколу (UNIFI, ClinicalTrials.gov Identifier: NCT02407236), пациенты старше 18 лет со средними и тяжелыми формами ЯК получали УСТ в течение года и более [13]. После индукционной терапии УСТ клиническая ремиссия (индекс Мейо ≤ 2 баллов, отдельных показателей > 1 не зафиксировано) у пациентов, принимавших УСТ, отмечалась чаще, чем у тех, кто получал плацебо, как после индукционной внутривенной терапии, так и на 44-й неделе поддерживающей терапии УСТ. Профиль безопасности УСТ был сопоставим при ЯК и псориазе [12, 13].
На начальном этапе индукционной терапии (нулевая неделя) пациенты случайным образом в соотношении 1 : 1 : 1 были распределены на группы и получали внутривенно:
- УСТ 130 мг (~2 мг/кг);
- дозу УСТ в зависимости от диапазона веса ~6 мг/кг (260 мг (≤ 55 кг), 390 мг (> 55 кг, ≤ 85 кг) или 520 мг (> 85 кг));
- плацебо.
Клинический ответ регистрировался на восьмой неделе индукционной терапии, далее определялась тактика лечения. Пациенты, достигшие клинического ответа (≥ 30% и ≥ 3-балльное снижение от исходного индекса Мейо, ≥ 1-балльное снижение или значение 0/1 в подкатегории ректального кровотечения) на восьмой неделе, а также пациенты, не ответившие на терапию плацебо, получившие индукционную терапию внутривенным УСТ (~6 мг/кг) на восьмой неделе и достигшие клинического ответа на 16-й неделе, были случайным образом распределены в соотношении 1 : 1 : 1 на группы поддерживающей терапии (нулевая неделя) для получения УСТ подкожно:
- УСТ 90 мг каждые 12 недель;
- УСТ 90 мг каждые восемь недель;
- плацебо до 40-й недели.
Эти пациенты представляли рандомизированную популяционную группу для первичного анализа в зависимости от назначенного лечения. Пациенты, не достигшие клинического ответа на восьмой неделе индукции, получали 90 мг УСТ подкожно и повторно оценивались на 16-й неделе. Пациенты, достигшие клинического эффекта, начинали получать поддерживающую терапию УСТ подкожно 90 мг каждые восемь недель (получавшие УСТ с задержкой). Пациенты, которые позже ответили на терапию УСТ, а также пациенты на индукционной внутривенной терапии плацебо, которые достигли клинического ответа на восьмой неделе, а затем получали подкожно плацебо, составили нерандомизированную группу поддерживающего лечения. Кроме того, проводилась оценка пациентов с клиническим обострением и утратой ответа на терапию. Доза УСТ не менялась в течение 44 недель поддерживающей терапии.
Основные показатели эффективности, оцениваемые на восьмой неделе индукционной терапии и 44-й неделе поддерживающей терапии, главным образом включали индекс Мейо (клинический ответ/клиническая ремиссия/ эндоскопическое улучшение). Два определения клинической ремиссии применялись в соответствии с международными требованиями (индекс Мейо ≤ 2, без отдельных подкатегорий > 1; подкатегории: количество стула ≤ 3, ректальное кровотечение 0, эндоскопия 0/1). Клинически значимая ремиссия, не требовавшая эндоскопии, определялась по подкатегориям индекса Мейо: частота стула 0/1, ректальное кровотечение 0. Значение в подкатегории эндоскопии 0/1 трактовалось как улучшение эндоскопической картины. Улучшение гистологической картины оценивали по индексу Гебса: < 5% инфильтрации крипт нейтрофилами, отсутствие разрушения крипт, эрозий, изъязвлений или грануляционной ткани [13]. Оценивали основные показатели маркеров воспаления (сывороточный С-реактивный белок (СРБ)/фекальный кальпротектин (ФКП)/фекальный лактоферрин). Данные о безопасности препарата (инфекции/серьезные инфекции/серьезные нежелательные явления) анализировались на протяжении восьминедельной внутривенной индукционной терапии и 44-недельной подкожной поддерживающей терапии.
В анализе исследований UNIFI (индукционная и поддерживающая терапия), которые на данный момент являются крупнейшими исследованиями УСТ у пациентов с ЯК, показатели фармакокинетики УСТ в целом сопоставимы между ЯК и болезнью Крона (БК). После индукционной дозы пик средней концентрации УСТ был одинаковым как у пациентов с ЯК в исследовании UNIFI, так и у ранее проанализированных пациентов с БК [10], хотя уровень средней концентрации УСТ на восьмой неделе индукционной терапии, а также минимальные уровни средней концентрации УСТ во время поддерживающей терапии у пациентов с ЯК были несколько выше, чем у пациентов с БК. Подобные фармакокинетические характеристики и дозозависимый эффект инфликсимаба, адалимумаба и ведолизумаба подтверждают целесообразность применения схожих доз у пациентов как с БК, так и с ЯК [14–17]. При острой тяжелой форме ЯК, характеризующейся высокой воспалительной реакцией и более быстрым клиренсом препарата, применялись более высокие дозы инфликсимаба [18, 19]. Этот подход не может напрямую применяться к УСТ, поскольку индукционная терапия при ЯК и БК предполагает однократное внутривенное введение. При использовании инфликсимаба коррекция дозы после утраты ответа на препарат у пациентов с ЯК проводится чаще, чем у пациентов с БК [20, 21]. Вместе с тем коррекция дозы после утраты ответа на препарат не оценивалась при поддерживающей терапии в исследовании UNIFI. Анализ зависимости «доза – ответ» в данном исследовании, включая особенности фармакокинетики у пациентов с ЯК и утратой ответа на терапию, в сочетании с сообщавшимися ранее данными о коррекции дозы УСТ у пациентов с БК [22] подразумевает, что сокращение интервала дозирования с 12 до восьми недель способно восстановить клинический ответ после его утраты. То, что данные о корректировке дозы у пациентов с БК могут применяться к пациентам с ЯК, дополнительно подтверждается схожей фармакокинетикой УСТ у пациентов с ЯК или БК, а также сходным влиянием на среднюю концентрацию УСТ. Сходная фармакокинетика биологических препаратов у пациентов с ЯК и БК также может указывать на нецелесообразность дальнейших исследований, направленных на поиск различий в их фармакокинетике и дозировании, подчеркивая возможность экстраполяции и применения этих результатов в отношении не только указанных препаратов, но и более эффективных новых биологических препаратов для лечения ВЗК.
Установлена связь между средней концентрацией УСТ и критериями эффективности (клинические/гистологические/воспалительные биомаркеры) [22]. При анализе мультивариабельной логистической регрессии на восьмой неделе индукционной терапии средняя концентрация УСТ, нормализация СРБ (≤ 3,0 мг/л), фекальный лактоферрин (≤ 7,2 мкг/г) наиболее тесно связаны с клиническим ответом на восьмой неделе. Идентификация нормализации СРБ на восьмой неделе (по сравнению с исходным уровнем) и фекального лактоферрина в качестве факторов, связанных с клиническим ответом на восьмой неделе, согласуется с анализами средней концентрации УСТ. В этом анализе заслуживает внимания нормализация фекального лактоферрина, а не кальпротектина при индукционной терапии, поскольку последний более широко изучается при ВЗК [23, 24]. Тем не менее оба маркера сильно коррелируют с активностью воспаления слизистой оболочки толстой кишки.
Оптимальное минимальное значение средней концентрации УСТ поддерживающей терапии может оцениваться при достижении равновесной концентрации, которая, как правило, достигается с помощью второго поддерживающего подкожного введения УСТ. Связь между статусом ремиссии в начале поддерживающей терапии и клинической ремиссией на 44-й неделе сочеталась с более выраженным значением «доза – эффект» у пациентов, у которых не наблюдалось выраженного ответа на индукционную терапию. Разница между значениями «доза – эффект» во время поддерживающей терапии говорит о том, что если дозирование УСТ 90 мг каждые восемь недель эффективно для всех пациентов, то дозирование 90 мг каждые 12 недель может быть эффективным у пациентов, достигших положительного эффекта на индукционной терапии.
Был сделан еще один важный вывод: неэффективность терапии иммуномодуляторами (6-меркаптопурин/азатиоприн/метотрексат) или биологической терапии в анамнезе не повлияла на среднюю концентрацию УСТ у пациентов с ЯК. Эти данные свидетельствуют о том, что любое потенциальное влияние сопутствующих иммуномодуляторов на эффективность УСТ при ЯК скорее всего не ассоциируется с изменениями значений средней концентрации УСТ, как установлено для анти-ФНО-альфа [25].
Пациенты с ЯК, получавшие УСТ, продемонстрировали низкую иммуногенность (5,7%). У пациентов с антителами к препарату устекинумаб (ADA+) антитела были преходящими у 44% пациентов, у 72% пациентов они не были нейтрализующими. Не обнаружено связи между средней концентрацией УСТ и частотой инфекционных осложнений или серьезных побочных эффектов, что совпадает с данными при БК [22]. Таким образом, безопасность УСТ, видимо, не зависит от уровня доз в исследовании.
Можно сказать, что фармакокинетика УСТ у пациентов с БК и пациентов с ЯК совпадает. При ЯК значения средней концентрации УСТ были пропорциональны вводимой дозе, на которую не повлиял предшествующий прием биологических препаратов или сопутствующая терапия иммуномодуляторами; ассоциированная с клиническими, гистологическими и нормализованными улучшениями и нормализацией воспалительных маркеров и не связанная с побочными явлениями. Помимо средней концентрации УСТ нормализация показателей СРБ, фекального лактоферрина на восьмой неделе была связана с клинической эффективностью на восьмой неделе. Ремиссия, достигнутая до начала поддерживающей терапии, ассоциировалась с устойчивой ремиссией на 44-й неделе. Фармакокинетика и зависимость между дозой и ответом указывают на целесообразность использования индукционной терапии в дозе ~6 мг/кг с последующей поддерживающей терапией в дозе 90 мг каждые восемь недель. В то же время поддерживающая терапия 90 мг каждые 12 недель также продемонстрировала эффективность у пациентов, достигших устойчивой ремиссии после индукционной терапии. Хотя предлагаемые целевые значения средней концентрации УСТ (индукционная доза ≥ 3,7 мкг/мл, доза поддерживающей терапии ≥ 1,3 мкг/мл) требуют подтверждения, большое исследование фармакокинетики УСТ при ЯК предоставляет важные и полезные данные для оценки эффективности УСТ у пациентов с ЯК.
Таким образом, УСТ продемонстрировал высокую эффективность и безопасность в качестве препарата для индукции и поддержания ремиссии у пациентов с ЯК среднетяжелого и тяжелого течения после неудачной терапии блокаторами ФНО-альфа или традиционными иммуносупрессорами.
В настоящее время опыт применения УСТ у больных ЯК в реальной клинической практике невелик.
Клиническое наблюдение
Пациент Л. 1984 г.р. в 2011 г. впервые заметил примесь алой крови в оформленном стуле, в связи с чем обратился к проктологу по месту жительства. Амбулаторно проведена фиброколоноскопия (ФКС). Патологии не выявлено, состояние расценивалось как обострение хронического геморроя. Проведена местная терапия с положительным эффектом.
Весной 2016 г. в стуле вновь обнаружилась примесь алой крови, появилась боль в животе. Пациента госпитализировали в городскую клиническую больницу № 51, где диагностировали тромбоз наружного геморроидального узла. В экстренном порядке в июне 2016 г. выполнена геморроидэктомия. Через неделю стул участился до десяти раз в день, отмечалась обильная примесь крови, усилился болевой абдоминальный синдром, повысилась температура тела (до 37,5 °С). ФКС выявила эндоскопические признаки ЯК, тотальное поражение, что подтверждено гистологически – в биопсийном материале фрагменты грануляций и фиброзной ткани с выраженным хроническим воспалением и некрозом по краю. Таким образом, установлен диагноз: язвенный колит, тотальное поражение, впервые выявленный, средней тяжести. Пациенту назначены кишечные антисептики, месалазин 3 г/сут перорально, свечи с месалазином 500 мг/сут, спазмолитики, микроклизмы с гидрокортизоном 125 мг два раза в сутки, перорально глюкокортикостероиды (ГКС) (преднизолон 60 мг/сут). Больной выписан с улучшением, амбулаторно рекомендации соблюдал.
При достижении дозы преднизолона 40 мг симптомы заболевания возобновились, пациент госпитализирован в отделение лечения ВЗК Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова.
Данные ультразвукового исследования (УЗИ) органов брюшной полости (ОБП) и толстой кишки: эхопризнаки колита, тотальное поражение, активность процесса выражена – толщина стенки толстой кишки до 6–7 мм, с гиперэхогенными включениями (язвы). ФКС: язвенный колит, тотальное поражение, высокая активность процесса (множественные сливные эрозии и язвы во всех отделах толстой кишки).
Назначены антибактериальная и противовоспалительная терапия преднизолоном 120 мг/сут, микроклизмы с преднизолоном.
Из-за развития гормональной зависимости для достижения бесстероидной ремиссии больному начали индукционный курс антицитокиновой терапии адалимумабом 160 мг подкожно в комбинации с азатиоприном 100 мг/сут. По результатам контрольного УЗИ ОБП отмечались уменьшение толщины стенки толстой кишки до 4 мм, появление дифференцировки на слои, уменьшение количества гиперэхогенных включений (язвенных дефектов).
Больной выписан с улучшением. После выписки он продолжил прием месалазина 4 г/сут, азатиоприна 100 мг/сут. Преднизолон был отменен по стандартной схеме (уменьшение дозы на 5 мг в неделю). Выполнены инъекции адалимумаба 40 мг один раз в 14 дней. Спустя три месяца после завершения приема ГКС, несмотря на проводимую противовоспалительную терапию, стул приобрел кашицеобразную консистенцию, частота – четыре-пять раз в сутки, примесь крови.
В мае 2017 г. пациент повторно госпитализирован в МКНЦ им. А.С. Логинова. УЗИ ОБП: эхопризнаки колита, обострение. ФКС: аппарат проведен в среднюю треть сигмовидной кишки. Дальнейшее исследование прекращено из-за высокого риска ятрогении. Слизистая оболочка сигмовидной и прямой кишки гиперемирована, зерниста, контактно кровоточит, с множественными сливающимися эрозиями, округлыми язвами до 0,6 см в диаметре, покрытыми фибрином. Гаустры сглажены.
С учетом выраженной эндоскопической активности повторно начата терапия преднизолоном 120 мг внутривенно, продолжено лечение месалазином 4 г/сут, антибактериальными препаратами. Выполнены коррекция водно-электролитных нарушений и восполнение дефицита железа. На основании клинических данных и результатов проведенного обследования терапия адалимумабом признана неэффективной. Принято решение о смене ГИБП. С июля 2017 г. начата терапия инфликсимабом по стандартной схеме 5 мг на 1 кг массы тела, по графику индукции «нулевая – вторая – шестая недели», далее – один раз в восемь недель.
В ноябре 2017 г. выполнена контрольная ФКС: осмотр на 20 см в подвздошную кишку, в данном отделе – без особенностей. Слизистая оболочка толстой кишки бледно-розовая, гладкая, блестящая, с единичными поверхностными белесыми рубцами, множественными мелкими псевдополипами. Слизистая оболочка прямой кишки очагово гиперемирована, зерниста, с множественными рубцовыми изменениями, контактно умеренно кровоточит. Сосудистый рисунок не прослеживается либо перестроен. Рекомендовано продолжить лечение месалазином 4 г/сут, азатиоприном 100 мг/сут, месалазин местно. Продолжена терапия инфликсимабом каждые восемь недель. Через две-три недели после каждой инфузии инфликсимаба пациент отмечал незначительную слабость в конечностях, но особого значения этому не придавал, поскольку указанные изменения нивелировались самостоятельно в течение нескольких дней.
В декабре 2017 г., через три недели после очередной инфузии инфликсимаба, пациент отметил прогрессирующую слабость в конечностях, преимущественно в руках, болезненность в мышцах верхнего плечевого пояса при движениях. При госпитализации исключен инфекционный генез заболевания. Впоследствии пациент наблюдался совместно с неврологом. Игольчатая электронейромиография (ЭНМГ) показала вялотекущий (преимущественно компенсированный) процесс на мышечном или невральном уровне. Данные стимуляционной ЭНМГ указывали на незначительно выраженный демиелинизирующий характер процесса. Изменения расценивались как демиелинизирующее поражение периферических нервов на фоне антицитокиновой терапии инфликсимабом. После его отмены слабость в мышцах верхних конечностей постепенно регрессировала, препарат заменили ингибитором альфа-4-бета-7-интегрина ведолизумабом.
В сентябре 2018 г. проведена контрольная колоноскопия: эндоскопическая ремиссия ЯК сохранялась. Продолжена биологическая терапия ведолизумабом.
В феврале 2020 г. на фоне общего благополучия участился стул – свыше десяти раз в сутки с примесью крови и слизи. Больной был госпитализирован в отделение лечения ВЗК МКНЦ им. А.С. Логинова. При поступлении в анализах крови обращали на себя внимание железодефицитная анемия легкой степени (гемоглобин – 100 г/л, эритроциты – 3,1 × 1012/л, сывороточное железо – 2 мкм/л), лейкоцитоз до 16 × 109/л с палочкоядерным сдвигом до 20%, повышение СРБ до 230 мг/л, снижение общего белка до 49 г/л, альбумина до 24 г/л.
УЗИ толстой кишки: стенки левых отделов толщиной до 6–7 мм, подслизистый слой более выражен, местами прерывистый, отечный, визуализируются единичные гиперэхогенные включения. ФКС: осмотр до левого изгиба ободочной кишки, дальнейшее исследование прекращено в связи с высоким риском ятрогении. Слизистая оболочка нисходящей ободочной, сигмовидной и прямой кишок гиперемирована, зерниста, представлена преимущественно островками между глубокими полиморфными язвенными дефектами, кровоточит. Гаустры сглажены. Сосудистый рисунок не прослеживается. Внутренние геморроидальные узлы умеренно выражены, без признаков воспаления и кровотечения. Заключение: язвенный колит осмотренных отделов толстой кишки, высокая активность.
Течение заболевания осложнено присоединившейся клостридиальной инфекцией, ассоциированной с токсинами А и B Clostridioides difficile. Проведены терапия преднизолоном 150 мг внутривенно с постепенным снижением дозы, антибактериальная терапия, в том числе ванкомицином 2 г/сут, коррекция водно-электролитных и белковых нарушений.
Оптимизирована терапия ведолизумабом 300 мг один раз в четыре недели. На фоне лечения достигнуто клиническое и лабораторное улучшение в виде сокращения частоты стула до трех-четырех раз в сутки со скудными прожилками крови. Боли в животе не беспокоили, лабораторные показатели нормализовались.
Данные УЗИ толстой кишки в динамике показали уменьшение толщины кишечной стенки в левых отделах до 3–4,3 мм. Подслизистый слой стал более выражен, визуализировались единичные гиперэхогенные включения. При исследовании в режиме цветного (цветового) допплеровского картирования (ЦДК) васкуляризация выражена незначительно. Свободной жидкости в межпетельном пространстве не выявлено. УЗ-картина соответствовала умеренно выраженным воспалительным изменениям левых отделов толстой кишки. После выписки пациент придерживался назначенной терапии, регулярно принимал преднизолон 75 мг с постепенным снижением дозы, азатиоприн 100 мг/сут, метронидазол 1 г/сут, препараты кальция, ингибиторы протонной помпы.
При достижении дозы преднизолона 40 мг/сут в апреле 2020 г. симптомы заболевания возобновились: вновь участился стул с примесью крови и слизи, появились боли в животе. Пациента вновь госпитализировали в отделение лечения ВЗК МКНЦ им. А.С. Логинова. При поступлении выполнена обзорная рентгенография ОБП: воспалительные изменения толстой кишки, преимущественно в левых отделах. УЗИ ОБП: с середины поперечно-ободочного отдела, а также начальной части прямой кишки стенки толщиной до 6 мм, подслизистый слой местами прерывистый, отечный. Дифференциация слоев отсутствует. Визуализируются множественные гиперэхогенные включения. Эхопризнаки выраженных воспалительных изменений толстой кишки. Лабораторно железодефицитная анемия легкой степени, повышение СРБ – 120 мг/л, умеренный лейкоцитоз – до 14 × 109/л, повышение скорости оседания эритроцитов (СОЭ) до 67 мм/ч, ФКП > 1800 мкг/г.
Пациенту предложили хирургическое лечение, от которого он категорически отказался. Проведены активная инфузионная терапия, антибактериальная терапия, коррекция анемии препаратами железа, назначены системные ГКС 150 мг/сут с постепенным снижением дозы. На этом фоне зарегистрирована положительная динамика в виде урежения стула со скудной примесью крови, купирования болевого абдоминального синдрома. С учетом вторичной неэффективности терапии ведолизумабом рекомендована терапия ингибитором янус-киназ тофацитинибом.
Во время амбулаторного лечения месалазином 4 г/сут, тофацитинибом 10 мг два раза в сутки, при снижении дозы преднизолона до 10 мг/сут отмечалось обострение ЯК. Пациент госпитализирован в МКНЦ им. А.С. Логинова в мае 2020 г.
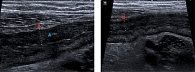
УЗИ ОБП: с середины поперечно-ободочного отдела, а также начальной части прямой кишки стенки толщиной до 6 мм, подслизистый слой местами прерывистый, отечный. Дифференциация слоев отсутствует. Визуализируются множественные гиперэхогенные включения. По данным ЦДК, зарегистрирована выраженная васкуляризация. Окружающая клетчатка повышенной эхогенности, отечна. Мезентериальная лимфаденопатия. Заключение: эхопризнаки выраженных воспалительных изменений толстой кишки (рис. 1).
Рентгенологических данных об острой кишечной непроходимости, перфорации полого органа, дилятации кишечника не получено. Картина воспалительных изменений толстой кишки. Данные лабораторного исследования: уровень сывороточного железа снизился до 8,6 мкм/л, СРБ – 187 мг/л, общий белок – 57,7 г/л, СОЭ – 39 мм/ч, гемоглобин – 98 г/л; лейкоцитоз – 12 × 109/л, ФКП > 1800 мкг/г. Назначено лечение: преднизолон внутривенно, месалазин ММХ 4,8 г/сут, метронидазол 1,5 г/сут, омепразол 40 мг/сут, цефтриаксон 1 г два раза в сутки, микроклизмы с преднизолоном. На фоне проводимой терапии частота стула сократилась до четырех-пяти раз в сутки, однако примесь слизи и крови сохранялась. Проведен консилиум с участием хирургов-колопроктологов. Предложено хирургическое лечение в объеме тотальной колопроктэктомии ввиду непрерывного тяжелого течения заболевания, развития гормональной зависимости, неэффективности ГИБП и синтетического таргетного иммуносупрессора. Пациент категорически отказался (в письменной форме) от оперативного лечения. Сформулирован диагноз: язвенный колит, тотальное поражение, хроническое рецидивирующее течение тяжелой степени высокой активности. Гормонорезистентная форма. Антицитокиновая терапия адалимумабом с 8 сентября 2017 г. по июнь 2018 г. Вторичная потеря ответа на терапию адалимумабом от 1 июня 2018 г. Антицитокиновая терапия инфликсимабом с 3 июля 2018 г. Нежелательные явления на инфликсимаб в декабре 2018 г.: демиелинизирующая сенсомоторная полиневропатия. Вялый тетрапарез до 3,5 балла по MRC. Биологическая терапия ведолизумабом от 5 февраля 2019 г. Вторичная неэффективность ведолизумаба в апреле 2020 г. Таргетная терапия синтетическим селективным иммуносупрессором тофацитинибом с 28 апреля 2020 г. Первичная неэффективность тофацитиниба в августе 2020 г. Железодефицитная анемия легкой степени. Решением консилиума начата терапия УСТ.
В мае 2020 г. проведена первая внутривенная инфузия индукционного курса препаратом УСТ 390 мг. Ранних и поздних осложнений не выявлено. Амбулаторно пациент завершил прием системных ГКС в течение 12 недель, продолжал лечение месалазином ММХ 4,8 г/сут, получал местную терапию месалазином. Через восемь недель выполнено второе введение УСТ 90 мг подкожно.
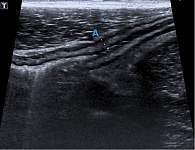
Пациент расценивал самочувствие как удовлетворительное, стул не более трех раз в сутки со скудной примесью слизи. УЗИ ОБП: толщина стенки толстой кишки 3,5 мм, утолщена за счет подслизистого слоя, дифференцировка на слои прослеживается (рис. 2).
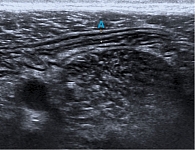
В октябре 2020 г. пациент получил третью инъекцию УСТ 90 мг. На фоне терапии достигнута клиническая ремиссия, что подтверждено данными УЗИ ОБП: стенка толстой кишки на всем протяжении до 2,5–3 мм, четко прослеживается дифференцировка на слои (рис. 3). Лабораторные маркеры воспаления в пределах нормы, ФКП – 120 мкг/г.
Заключение
Представленное клиническое наблюдение демонстрирует сложности ведения пациентов с ВЗК, в частности с ЯК. Несмотря на полный объем медикаментозной терапии, проводимой в соответствии с рекомендуемым алгоритмом [1], пациенты утрачивают ответ на терапию ГИБП. Последующее назначение ГИБП с аналогичным (анти-ФНО-альфа) и иным механизмом действия (блокатор анти-альфа-4-бета-7-интегрина, блокатор янус-киназ) менее эффективно, чем первое. Тем не менее на фоне прогрессирующего, трудно контролируемого течения заболевания, развития редкого осложнения, связанного с применением анти-ФНО-альфа-терапии, УСТ продемонстрировал высокую эффективность у пациента с резистентностью к препаратам анти-ФНО-альфа, анти-альфа-4-бета-7-интегрина и блокатора янус-киназ, позволил добиться клинического ответа в соответствии с современной концепцией терапии ЯК [26].
O.V. Knyazev, PhD, A.V. Kagramanova, PhD, M.Yu. Zvyaglova, A.A. Lishchinskaya, PhD, N.A. Fadeeva, PhD, N.G. Samsonova, PhD, I.A. Li, PhD, A.I. Parfyonov, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
A.N. Ryzhykh National Medical Research Center of Coloproctology
Research Institute of Health Organization and Medical Management
Contact person: Oleg V. Knyazev, oleg7@bk.ru
On specific examples the article demonstrates the clinical efficacy of ustekinumab in severe ulcerative colitis after failure of therapy with tumor necrosis factor alpha blockers, Janus kinase blockers, and alpha-4-beta-7-integrin inhibitors.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.