Эндотелиальная дисфункция как связующее звено климактерического синдрома и сердечно-сосудистых заболеваний
- Аннотация
- Статья
- Ссылки
- English
Сердечно-сосудистые заболевания: межгендерные различия
Вопреки мнению широкой аудитории и большинства медиков, ежегодно от сердечно-сосудистых заболеваний умирает больше женщин, чем мужчин [1], а потому вопросы своевременной диагностики и профилактики в женской популяции стоят гораздо острее, чем в мужской. Атеросклероз коронарных артерий, ведущий к инфаркту миокарда [2], имеет гендерные особенности, поэтому использование статинов не оправдало себя в качестве первичной профилактики среди женщин.
Острый инфаркт миокарда у мужчин и женщин также протекает по-разному. Для женщин характерны продромальные симптомы в виде необычной усталости, расстройств сна и одышки. Вместо боли за грудиной они могут испытывать боль в подложечной области или другие боли за пределами грудной клетки [3, 4]. Это затрудняет клиническую диагностику сердечно-сосудистой патологии, и, несмотря на то что эффективность существующих инструментальных методик для женщин столь же высока, как и для мужчин [5], а тесты с физической нагрузкой в женской популяции даже более чувствительны и специфичны [6–8], немало случаев ишемической болезни сердца остаются нераспознанными. В результате за последние десятилетия распространенность инфаркта миокарда среди женщин выросла, тогда как среди мужчин, наоборот, снизилась [9].
Не лучше обстоят дела и с цереброваскулярной патологией. Инсульт у женщин протекает тяжелее, чем у мужчин, к тому же сопутствующие заболевания (например, артрит, деменция) могут существенно влиять на постинсультный статус [10]. Одно из объяснений текущей сердечно-сосудистой и цереброваскулярной заболеваемости и смертности – отсутствие должного внимания к отличиям фундаментальных детерминант женского и мужского старения при планировании программ профилактики сердечно-сосудистых заболеваний [11].
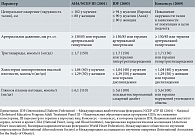
Факторы риска сердечно-сосудистых заболеваний включают курение (отношение шансов (ОШ) 2,87; 99%-ный доверительный интервал (ДИ) 2,58–3,19) и кластер метаболического синдрома (табл. 1) [12]: абдоминальное ожирение (ОШ 1,62; 99% ДИ 1,45–1,80), артериальную гипертензию (ОШ 1,91; 99% ДИ 1,74–2,10), дислипидемию (ОШ 3,25; 99% ДИ 2,81–3,76), нарушение углеводного обмена (ОШ 2,37; 99% ДИ 2,07–2,71) [13]. Межгендерные различия касаются прежде всего значимости тех или иных факторов в развитии сердечно-сосудистой и цереброваскулярной патологии, их качественных и количественных характеристик [12].
У женщин есть дополнительные специфические факторы сердечно-сосудистого риска и укорочения общей продолжительности жизни, связанные с репродуктивной системой [14, 15]. Причинно-следственная связь менопаузы и сердечно-сосудистых заболеваний далеко не так очевидна, как эпидемиологическая, и требует тщательного изучения механизмов, объединяющих эндокринную и сердечно-сосудистую системы. Один из важных, если не самый главный такой механизм – эндотелиальная дисфункция, под которой понимают нарушение соотношения между противоположными по действию молекулами, вырабатываемыми клетками эндотелия.
Причины эндотелиальной дисфункции у женщин
Эндотелий – однослойный пласт плоских клеток мезенхимы, выстилающий изнутри кровеносные, лимфатические сосуды и полости сердца. По современным представлениям, эндотелий не просто полупроницаемая мембрана, а активный орган, продуцирующий биологически активные вещества, необходимые для поддержания гомеостаза. Таким способом эндотелий выполняет важные для организма барьерную, секреторную, гемостатическую, вазотоническую функции, играет роль в процессах воспаления и ремоделирования сосудистой стенки (табл. 2).
Антикоагулянтная и антитромботическая способность эндотелия преобладает над его прокоагулянтными свойствами, но под действием повреждающих факторов фенотип эндотелиоцитов меняется, проявляя прокоагулянтную и протромботическую активность. В качестве повреждающих (активирующих) факторов могут выступать механическая травма сосудов, провоспалительные цитокины, эндотоксины и другие компоненты клеточной стенки бактерий, иммунные комплексы, атерогенные стимулы, гомоцистеин, изменения гормонального баланса и даже внешние стрессовые факторы, включая техногенный шум, загрязнение воздуха, умственное перенапряжение [16, 17]. Активированные эндотелиоциты продуцируют гликопротеины экстрацеллюлярного матрикса с прокоагулянтной активностью, в том числе эндотелин 1, фактор Виллебранда и тромбомодулин. Одновременно нарушение целостности гликокаликса приводит к угнетению синтеза оксида азота (NO), участвующего в поддержании сосудистого тонуса и обладающего выраженными антиагрегантными свойствами, росту воспалительных реакций и адгезии тромбоцитов, дисрегуляции градиента осмотического давления и транспорта липидов [18]. Генерализованное нарушение функций эндотелия сопровождается расстройством регуляции сосудистого тонуса и проницаемости сосудов, снижением синтеза антикоагулянтов, антиагрегантов, активаторов фибринолиза и повышением продукции эндотелиальным слоем тромбогенных факторов. Но и субклиническая эндотелиальная дисфункция, выявляемая только по результатам лабораторного исследования, демонстрирует сильную корреляцию с факторами риска сердечно-сосудистых заболеваний.
Среди эндогенных молекул, оказывающих существенное регуляторное влияние на функции эндотелия, для женщин особенно важны эстрогены. Их вазопротективное действие опосредуется высвобождением из клеток эндотелия сосудорасширяющих молекул и ростом эндотелиоцитов. Один из основных механизмов вазодилатации под действием эстрадиола – экспрессия NO-синтазы [19, 20], осуществляемая геномными и негеномными путями. Эффекты эстрогенов связаны со снижением уровней Е-селектина, гомоцистеина и других маркеров эндотелиальной дисфункции [21], а также усиленным образованием простагландина I2, редукцией синтеза эндотелина и блокадой кальциевых каналов [22]. В целом эстрогены улучшают кровоток и повышают микроциркуляцию в тканях [23].
В репарации поврежденного эндотелиального слоя критическую роль играют циркулирующие прогениторные клетки эндотелия. Эстрадиол селективно индуцирует адгезию прогениторных клеток к сосудистой стенке, рост и дифференцировку их колонии [24]. Данный эффект, как и другие пролиферативные эффекты гормона, реализуется через рецептор эстрадиола альфа. Протективное действие эстрогенов обусловлено также повышением биогенеза митохондрий [25] и подавлением митохондриальной продукции свободных радикалов в клетках эндотелия, что уменьшает выраженность окислительного стресса [26].
Очевидно, что утрата эстрогеновых влияний ухудшает функцию эндотелия и повышает риск сердечно-сосудистых заболеваний. Это ярко демонстрирует преждевременная недостаточность яичников и особенно хирургическая менопауза в возрасте до 40 лет [27, 28]. Эндотелиальная дисфункция у таких женщин практически неизбежна, и отсутствие приливов жара не должно вводить клинициста в заблуждение: молодые структуры головного мозга со стабильными нейрогуморальными связями вполне могут справиться с депривацией эстрогенов, но это не означает, что аналогичную стойкость проявит эндотелий. При этом субклиническая, исподволь развивающаяся эндотелиальная дисфункция может протекать бессимптомно и сразу проявиться сердечно-сосудистой патологией.
Естественная менопауза, напротив, может подавать очевидные сигналы неблагополучия, свидетельствующие как о нейрогуморальной дисрегуляции, так и о дисфункции эндотелия. Этими сигналами являются вазомоторные симптомы, в особенности приливы жара и ночная потливость, которые обусловлены сосудистой нестабильностью, возникающей в результате нейровегетативной дисрегуляции на фоне дефицита эстрогенов.
Наблюдательные исследования и клинические испытания демонстрируют связь между вазомоторными симптомами и сердечно-сосудистым риском [29–31]. Фактически у женщин с приливами жара обнаруживаются субклинические формы сердечно-сосудистых заболеваний. Толщина интима-медиа общей сонной артерии (ТИМ ОСА) прямо коррелирует с сердечно-сосудистыми факторами риска, атеросклерозом, повышенной распространенностью сердечно-сосудистых заболеваний, частотой инфаркта миокарда и инсульта. Исследование SWAN показало, что после исключения традиционных факторов риска у женщин, отмечавших приливы жара в течение шести и более дней за предшествующие две недели, ТИМ ОСА была выше, чем у женщин с редкими приливами или вовсе их не испытывавшими [32]. Курение, ожирение и менопауза увеличивали силу корреляции ТИМ ОСА с приливами жара. Кроме того, у пациенток с клинически значимыми приливами чаще имели место такие признаки субклинических сердечно-сосудистых заболеваний, как кальцификация аорты и недостаточная поток-опосредованная дилатация. Эти симптомы сосудистых нарушений и одновременно эндотелиальной дисфункции объединяют субклинические сердечно-сосудистые заболевания и приливы жара, позволяя считать последние маркером сердечно-сосудистого риска [33].
Однако классические факторы сердечно-сосудистого риска, включая метаболический синдром, усугубляют патологическое течение климактерия. Одним из связующих механизмов выступает эндотелиальная дисфункция. Например, курение усиливает развитие не только атеросклероза, но и пристеночного тромбоза, влияя на эндотелий прямо и опосредованно, через окислительный стресс, воспаление, тромбоцитарное звено гемостаза и приводя к хроническому эндотелиозу с нарушением сосудодвигательных функций, фибринолиза и структуры сосудистой стенки. Вместе с тем известно, что у курильщиц менопауза наступает в среднем на полтора года раньше, чем у некурящих женщин, и характеризуется более частыми и тяжелыми приливами жара [34, 35]. Таким образом, будучи мощным фактором сердечно-сосудистого и цереброваскулярного риска, курение выступает и как фактор риска патологического течения климактерия.
У женщин ишемическая болезнь сердца коррелирует с пониженным уровнем холестерина липопротеинов высокой плотности, повышенным уровнем холестерина липопротеинов низкой плотности и триглицеридов [36], а эстрогеновый сигнал, передаваемый рецепторами альфа [37], существенно влияет на метаболизм липидов, генетически связанный с развитием атеросклероза и сердечно-сосудистых заболеваний [38]. Утрата эстрогеновых влияний меняет баланс липопротеинов, а в условиях окислительного стресса избыток окисленных липопротеинов низкой плотности негативно влияет не только на функции зрелого эндотелия, редуцируя продукцию NO, но и на пролиферацию, подвижность и функции эндотелиальных стволовых клеток, без которых невозможно восстановление поврежденных атеросклерозом областей сосудистой выстилки [39]. Повышенные значения окисленных липопротеинов низкой плотности связаны с увеличением риска будущих сердечно-сосудистых событий и метаболического синдрома [40]. Это приобретает особую значимость при эстрогенном дефиците, который не только меняет баланс липопротеинов в сторону липопротеинов низкой плотности, но и независимо от последних снижает продукцию NO и увеличивает уровень окислительного стресса.
Гиперлипидемия у женщин, однако, уступает по значимости в развитии сердечно-сосудистых заболеваний таким факторам, как артериальная гипертензия и сахарный диабет. Нарушение толерантности к углеводам гораздо важнее для женской, нежели мужской популяции. Например, постпрандиальный уровень глюкозы служит более сильным предиктором сердечно-сосудистых заболеваний, а уровень гликированного гемоглобина – предиктором инсульта у женщин с сахарным диабетом [41]. Сочетание артериальной гипертензии и сахарного диабета повышает риск смертности в большей степени у женщин, чем у мужчин [42, 43]. Объяснить этот феномен можно более выраженными нарушениями липидного обмена у женщин с сахарным диабетом, различиями концентраций провоспалительных маркеров, а также низкой приверженностью к терапии, характерной в большей степени для женщин [42–46]. Однако не последнюю роль в смещении значимости факторов риска играют гормональные эффекты.
Падение уровня эстрадиола приводит к вазомоторной нестабильности сосудов, обусловленной эндотелиальной дисфункцией, в частности снижением синтеза NO [10]. Спонтанные колебания сосудистого тонуса, с одной стороны, провоцируют приливы жара, а с другой стороны, ухудшают системный контроль артериального давления, что проявляется клиническими особенностями артериальной гипертензии у женщин: склонностью к пароксизмальному течению, высоким разбросом значений систолического артериального давления, неадекватной реакцией на антигипертензивную терапию [47].
Приливы жара ассоциируются с повышенной инсулинорезистентностью и уровнем глюкозы вне зависимости от массы тела [48], что подтверждает гипотезу о негативном влиянии дефицита эстрогенов на течение сахарного диабета у женщин в постменопаузе. Одной из причин данного феномена, по-видимому, является уменьшение синтеза метаболита эстрадиола – 2-метоксиэстрадиола, противодействующего нарушению толерантности к углеводам [49]. Следует отметить, что высокий уровень потребления жиров подавляет активность катехол-о-метилтрансферазы – фермента, конвертирующего эстрадиол в 2-метоксиэстрадиол в печени, что ведет к депозиции липидов в печени и аккумуляции макрофагов [49]. Таким образом, порочный круг нарушений жирового и углеводного обменов замыкается эстрогенным дефицитом.
В формировании метаболического синдрома и развитии эндотелиальной дисфункции принимают участие и другие эндогенные стероиды, причем их роль в патогенезе указанных нарушений может быть диаметрально противоположной в зависимости от пола [50]. У женщин к маркерам кардиометаболического риска относится повышенный уровень свободного тестостерона [51, 52]. Было замечено, что у женщин в отличие от мужчин, для которых тестостерон играет защитную роль в отношении эндотелия, гиперандрогенемия связана с эндотелиальной дисфункцией и повышенный уровень свободного тестостерона прямо коррелирует с маркером эндотелиальной дисфункции – уровнем асимметричного диметиларгинина [53, 54]. Условный избыток андрогенов, возникающий в результате утраты эстроген-продуцирующей функции яичников и усугубляемый недостаточной продукцией глобулина, связывающего половые гормоны, у женщин с ожирением и/или инсулинорезистентностью [55], вносит свою лепту в нарушение функций сосудистой стенки и риск сердечно-сосудистых и цереброваскулярных событий.
Медикаментозная профилактика эндотелиальной дисфункции и ее осложнений у женщин в пери- и постменопаузе
Признавая роль эстрогенов в защите эндотелия и их дефицита в формировании эндотелиальной дисфункции, нельзя игнорировать очевидную пользу менопаузальной гормональной терапии для профилактики сердечно-сосудистых заболеваний. Краеугольным камнем грамотного назначения менопаузальной гормональной терапии с точки зрения снижения риска сердечно-сосудистых заболеваний служит выбор правильного момента для инициации терапии, когда эндотелиальная дисфункция уже существует, но клинической манифестации сердечно-сосудистых заболеваний, отражающей глубокие структурные нарушения сосудистой стенки, еще не произошло. Опираясь на возраст как один из маркеров сосудистого старения, международные экспертные организации определили верхний временной предел инициации менопаузальной гормональной терапии. Однако трудно установить преждевременное старение сосудов на фоне длительно действующих факторов эндотелиальной дисфункции, поэтому пациентки, начинающие принимать менопаузальную гормональную терапию в рамках «окна возможностей», могут оказаться в группе риска по развитию венозного и артериального тромбоза. Таким женщинам целесообразно проводить профилактику тромбофилических осложнений.
Предотвращение тромбоэмболических, цереброваскулярных и сердечно-сосудистых событий, связанных с тромбофилией и эндотелиозом, подразумевает использование комплекса мероприятий, включающих прием препаратов для нормализации функций коагуляционного и тромбоцитарного звеньев гемостаза, а также эндотелия [56]. К этим средствам относятся прямые и непрямые антиагреганты, антикоагулянты и, кроме того, препараты с опосредованными эффектами, например глюкокортикостероиды и витамины группы В.
Широко применяемые терапевтами антиагреганты (ацетилсалициловая кислота и дипиридамол) нередко рекомендуются гинекологами как средства защиты от возможного негативного влияния менопаузальной гормональной терапии на сосуды. Низкие дозы ацетилсалициловой кислоты способствуют высвобождению эндотелием простагландина I2, ингибируют циклооксигеназу тромбоцитов и эндотелия сосудов, подавляют образование тромбоксана А2 – мощного индуктора агрегации тромбоцитов и вазоконстрикции. Аспирин в дозе 80–100 мг остается единственно возможным средством профилактики инсультов и инфарктов при синдроме липких тромбоцитов. Предупредить избыточную агрегацию можно также с помощью ингибитора фосфодиэстеразы дипиридамола, использование которого приводит к росту концентрации плазменного аденозина и подавлению функции тромбоцитов. К сожалению, 10–38% лиц в популяции имеют низкую чувствительность (резистентность) тромбоцитов к ацетилсалициловой кислоте. Побочные реакции, возникающие при приеме антиагрегантов, связаны с эрозивно-язвенными поражениями желудочно-кишечного тракта, «аспириновой астмой», развитием тромбоцитопении, геморрагическими осложнениями.
Главное ограничение применения антиагрегантов состоит в их избирательном действии на тромбоцитарное звено гемостаза. Не влияя на внутрисосудистое свертывание, они не обладают достаточным для профилактики венозной тромбоэмболии противотромботическим эффектом. Меняя баланс молекул, продуцируемых эндотелием, антиагреганты предотвращают формирование пристеночного тромба в области атеросклеротической бляшки, но не обеспечивают собственно защиты эндотелия. Поэтому сфера их применения связана с профилактикой тромбообразования в коронарных и церебральных сосудах при состоявшемся атеросклерозе. Клинически манифестированный атеросклероз является противопоказанием к назначению гормональной терапии, следовательно, польза от антиагрегантов в гинекологической практике сомнительна.
Прямые антикоагулянты – гликозаминогликаны синтезируются в эндотелии. Поддержание отрицательного заряда сосудистой стенки, ее селективной проницаемости, регуляция водного обмена, почечной фильтрации, защита эндотелия от повреждения и действия токсических веществ, восстановление поврежденного эндотелия – все это относится к функциям гликозаминогликанов. На гемостаз гликозаминогликаны действуют, стимулируя выделение тканевого активатора плазминогена и липолитического фермента, активируя процессы фибринолиза. Эти соединения оказывают сильнейшее антитромботическое действие, модулируют процессы пролиферации и заживления, восстанавливают проходимость сосудов. Семейство гликозаминогликанов включает несколько молекул синтетического и натурального происхождения.
Нефракционированный гепарин по механизму действия – прямой ингибитор тромбина. Действие гепарина обусловлено тем, что в комплексе с антитромбином III он ускоряет инактивацию тромбина, фактора Ха и в меньшей степени факторов ХIIа, ХIа и IXа. Применение нефракционированного гепарина может приводить к возникновению гепарин-индуцированной тромбоцитопении, а его длительный прием – способствовать развитию остеопороза и истощению антитромбина III, что может вызвать состояние гиперкоагуляции и тромбоз. С целью профилактики сердечно-сосудистых заболеваний нефракционированный гепарин не применяется.
Деполимеризация нефракционированного гепарина позволила синтезировать низкомолекулярные гепарины, которые действуют преимущественно на фактор Ха, мало влияя на фактор IIа, поэтому их эффект более выражен, а требуемая доза ниже, чем у нефракционированного гепарина. Низкомолекулярные гепарины значительно реже вызывают гепарин-индуцированную тромбоцитопению, имеют высокую биодоступность (85 против 30% у нефракционированного гепарина), быстро всасываются при подкожном введении, длительно действуют, обладают более предсказуемым антикоагулянтным эффектом. Преимущественное влияние низкомолекулярных гепаринов на внутрисосудистое свертывание крови определяет точку их приложения: они назначаются с целью профилактики венозной тромбоэмболии [57]. Прямые антикоагулянты в акушерско-гинекологической практике используются главным образом для профилактики послеоперационных тромботических осложнений, а также венозного тромбоза у беременных и родильниц.
Преимущественным действием на эндотелий отличается другой, высокоочищенный гликозаминогликан натурального происхождения, 90% которого абсорбируются сосудистой выстилкой, – сулодексид (Вессел® Дуэ Ф) [58, 59]. Сулодексид представляет собой естественную смесь, состоящую на 80% из быстродвижущей гепариноподобной фракции с высокой аффинностью к антитромбину III и на 20% из дерматансульфата с аффинностью к кофактору гепарина II. Гепариноподобная фракция слабо взаимодействует с фактором IIа посредством антитромбина III, но сильнее и дольше ингибирует фактор Ха и, следовательно, обеспечивает высокий профиль безопасности. Дерматансульфат благодаря высокой степени связывания с кофактором гепарина II ингибирует фибрин-ассоциированный тромбин и обеспечивает антикоагулянтное действие в зоне формирующегося тромба, что является преимуществом по сравнению с системным действием гепаринов. Состав и механизм действия сулодексида позволяют достигать выраженных антитромботического, антикоагулянтного, фибринолитического и вазопротективного эффектов при низком риске развития кровотечения.
Фибринолитическая активность препарата обусловлена широким спектром биологических эффектов и комплексным влиянием на различные звенья системы гемостаза [60]. Среди эффектов сулодексида следует отметить стимуляцию синтеза и секреции простагландина I2, снижение уровней фибриногена, повышение уровней тканевого активатора плазминогена и редукцию ингибитора активатора плазминогена 1 в плазме крови, уменьшение вязкости крови, усиление экспрессии фермента липопротеинлипазы, способствующее снижению уровней липидов в крови. Использование препарата Вессел® Дуэ Ф связано со значительной редукцией агрегационной функции тромбоцитов, уровней маpкеpов эндотелиальной дисфункции – фактора Виллебранда, интерлейкинов 1-бета, 6, 8, матриксных металлопротеиназ 2 и 9 и циркулирующих эндотелиоцитов. Данные свойства позволяют использовать сулодексид в качестве компонента комплексной терапии при различной сердечно-сосудистой патологии, которая является прямым показанием к его назначению [61].
Сулодексид оказывает на эндотелий более выраженное действие по сравнению не только с низкомолекулярными гепаринами, но и с антиагрегантами [59]. Защита эндотелия осуществляется независимо от антитромботического эффекта сулодексида с помощью восстановления поврежденного гликокаликса и внутриклеточного матрикса, а также антипролиферативного, противовоспалительного, антиоксидантного, антипротеолитического и антиишемического эффекта [61]. Действие сулодексида связано и с его способностью повышать отрицательный заряд и антиагрегационную активность эндотелиальных клеток, увеличивая резистентность последних к воздействию гомоцистеина, медиаторов воспаления, цитокинов и лейкоцитарных протеаз, ингибировать адгезию тромбоцитов и лейкоцитов в случае повреждения эндотелия [62, 63]. Исследования на лабораторных животных продемонстрировали положительное влияние сулодексида на гликокаликс [64–66], и этот эффект, как и данные об антиоксидантном действии препарата [67], рассматривается в числе механизмов доказанной в клинической практике ангиопротекции у пациентов с сахарным диабетом.
Существенное преимущество сулодексида по сравнению с нефракционированным гепарином и низкомолекулярными гепаринами состоит не только в преимущественном влиянии на эндотелий, но и в возможности перорального применения: препарат отличается от гепаринов высокой биодоступностью и эффективен при приеме внутрь. При пероральном приеме концентрация сулодексида в крови нарастает медленно и не достигает пика, необходимого для развития антикоагулянтного действия, что приводит к меньшему риску развития кровотечения, следовательно, препарат характеризуется высоким профилем безопасности.
Высокая клиническая эффективность сулодексида в коррекции дисфункции эндотелия и профилактике тромбозов открывает перспективы для его более широкого использования в гинекологической практике у женщин в постменопаузе, имеющих такие хронические заболевания, как артериальная гипертензия, сахарный диабет, ожирение, аутоиммунная патология, тромбофилии и другие состояния, ассоциированные с эндотелиальной дисфункцией. Назначение сулодексида пациенткам с высоким риском осложнений эндотелиальной дисфункции может улучшить результаты менопаузальной гормональной терапии, снизить вероятность развития нежелательных явлений на ее фоне в виде венозного и артериального тромбоза и в целом редуцировать риск венозной тромбоэмболии и сердечно-сосудистых заболеваний.
I.V. Kuznetsova, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Irina V. Kuznetsova, ms.smith.ivk@gmail.com
Cardiovascular morbidity remains the main cause of death among women. Prevention programs significantly reducing the incidence of cardiovascular complications among men were ineffective in the female population, because of the differences in risk factors for cardiovascular disease in men and women. This conditions, on the one hand, the development of gender-oriented cardiological practice, and on the other hand, the gynecologist inclusion in the development and implementation of measures for reducing of cardiovascular morbidity and mortality.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.