Ведение пациентов в восстановительном периоде ишемического инсульта
- Аннотация
- Статья
- Ссылки
- English
Введение
Острые нарушения мозгового кровообращения (ОНМК) являются одной из важнейших медико-социальных проблем. Заболеваемость инсультом составляет 2,5–3 случая на 1000 населения в год, а постинсультная инвалидизация занимает одно из первых мест среди всех причин инвалидности – 3,2 на 10 000 населения [1]. По данным национального регистра, 31% пациентов после инсульта нуждаются в постоянном уходе, а 20% не могут самостоятельно ходить. На прежнюю работу способны вернуться около 20% выживших больных. При этом риск повторного ОНМК после первого инсульта составляет 26 и 39% в течение последующих пяти и десяти лет соответственно [1–3].
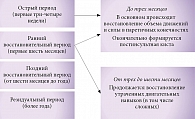
Тактика ведения больных, перенесших ишемический инсульт, в значительной степени определяется особенностями неврологических (двигательных, сенсорных, когнитивных и эмоциональных) нарушений. В зависимости от тяжести имеющихся расстройств некоторым пациентам достаточно диспансерно наблюдаться в поликлинике по месту жительства и соблюдать рекомендации по вторичной профилактике ишемического инсульта, другим больным необходимо проходить реабилитацию на дому, в поликлинике или специализированных центрах. Наиболее активное восстановление двигательных функций происходит в первые три месяца после инсульта, именно поэтому в этот период реабилитационные мероприятия приобретают особое значение (рисунок) [4–6].
Основные принципы реабилитации
Реабилитация включает комплекс мероприятий, направленных на восстановление нарушенных функций. В основе механизмов компенсации нарушенной функции лежит феномен нейропластичности. Под нейропластичностью, по определению Всемирной организации здравоохранения, понимается способность клеток нервной системы регенерироваться, анатомически и функционально изменяться [7, 8]. Реабилитационные программы должны разрабатываться индивидуально для каждого пациента с учетом неврологических расстройств. Последние зависят от локализации и особенностей перенесенного инсульта.
Эффективность восстановительного лечения определяется временем начала реабилитационных мероприятий, их адекватностью, систематичностью и длительностью. Необходим комплексный и междисциплинарный подход, активное включение в процесс реабилитации как самого больного, так и его родственников. Важнейшими факторами, влияющими на результативность реабилитационных мероприятий, являются объем и локализация очага поражения по отношению к функционально значимым церебральным зонам [4–6, 9, 10].
К наиболее частым инвалидизирующим последствиям инсульта относятся двигательные нарушения в виде центральных парезов различной степени выраженности. При наличии двигательных расстройств большое значение имеет ранняя активизация больного. Она позволяет избежать многих осложнений обездвиженности, таких как тромбофлебиты, пролежни, гипостатическая пневмония. Двигательная реабилитация в раннем восстановительном периоде влияет на дальнейшую активизацию больных, позволяет уменьшить спастичность, улучшить функции ходьбы, тренировать устойчивость, повысить толерантность к физическим нагрузкам, овладеть различными бытовыми навыками. Двигательная реабилитация включает кинезиотерапию, лечебную гимнастику, по возможности ежедневные прогулки. При необходимости используются вспомогательные средства (ходунки, трость, инвалидная коляска и др.) [4–6, 11]. В настоящее время активно задействуются новые технологии: биологическая обратная связь с использованием электромиографии, столы-вертикализаторы, тренажеры ходьбы, реабилитационные комплексы для восстановления двигательных функций верхних конечностей [4].
Важным направлением нейрореабилитации является коррекция спастичности, которая развивается более чем у половины пациентов, перенесших инсульт и имеющих двигательные нарушения. Кроме того, используются лечебная гимнастика, избирательный массаж, лечение положением, нервно-мышечная электростимуляция, физиотерапевтические методы, направленные на профилактику образования контрактур. При генерализованной спастичности назначают миорелаксанты (тизанидин, толперизон, баклофен), при локальной – препараты ботулинического токсина.
В постинсультном периоде также часто развиваются различные трофические нарушения: артропатии суставов паретичных конечностей, пролежни, мышечная атрофия. Артропатии могут стать причиной образования контрактур. В результате значительного ограничения объема активных и пассивных движений из-за болезненности в области суставов замедляется восстановление двигательных функций. Для лечения артропатий можно применять теплолечение, вакуумный или турбулентный массаж, лечебную гимнастику.
Необходимо помнить еще об одном частом осложнении острого и раннего восстановительного периодов инсульта – падениях с переломами костей. Медперсонал и родственники должны тщательно наблюдать за пациентами, у которых высок риск падения, не следует назначать таким больным препараты, вызывающие сонливость, снижение концентрации внимания, слабость в паретичной ноге [4–6].
Не менее значимы и распространены постинсультные речевые нарушения, которые разделяют на афазию и дизартрию. Особое значение в терапии речевых расстройств имеют занятия с логопедом-афазиологом. Эффект от этих занятий в большей степени проявляется в ранние сроки после ишемического инсульта, поэтому занятия по восстановлению речи следует начинать уже в первые три недели. На амбулаторном этапе реабилитации занятия проводятся два-три раза в неделю по 45–60 минут. Помимо индивидуальных занятий также весьма эффективны групповые занятия, улучшающие коммуникативную функцию речи [12, 13].
У значительного числа пациентов, перенесших инсульт, выявляются когнитивные нарушения, а у 6–32% пациентов они достигают степени деменции. Для оценки когнитивных функций проводится нейропсихологическое исследование. Когнитивные нарушения могут быть вызваны не только перенесенным ишемическим инсультом, но и предшествующим ОНМК с клиникой инсульта или по типу «немого» инфаркта/кровоизлияния. Доинсультное асимптомное или малосимптомное поражение головного мозга может быть также связано с диффузными изменениями белого вещества головного мозга в результате хронической недостаточности мозгового кровообращения и (или) сопутствующим нейродегенеративным заболеванием, чаще всего болезнью Альцгеймера [14]. Необходимость своевременной диагностики когнитивных нарушений обусловлена тем, что когнитивные нарушения могут значительно снижать эффективность реабилитации, качество и продолжительность жизни пациента, а также отрицательно влиять на приверженность пациента терапии. Пациентам с легкими и умеренными когнитивными нарушениями для улучшения памяти и других когнитивных функций рекомендуется выполнять систематические упражнения по тренировке памяти и внимания (когнитивный тренинг), принимать нейрометаболические и вазотропные препараты. При выраженных когнитивных нарушениях, достигающих степени деменции, применяются ингибиторы церебральной ацетилхолинэстеразы (донепезил, галантамин, ривастигмин) и неконкурентный антагонист NMDA-рецепторов к глутамату мемантин.
Примерно у 30–40% пациентов в постинсультном периоде развивается депрессия, которая также признана фактором риска повторных инсультов, инфаркта миокарда и ассоциирована с увеличением смертности в течение первых десяти лет после инсульта. Наличие депрессии в первые полгода после сосудистой катастрофы является фактором риска возникновения в дальнейшем когнитивных нарушений и деменции [15]. Как и постинсультные когнитивные нарушения, постинсультная депрессия снижает эффективность проводимых реабилитационных мероприятий. Показано, что эмоциональные нарушения наиболее часто развиваются в раннем восстановительном периоде инсульта. Для диагностики депрессии у пациентов, перенесших ишемический инсульт, можно использовать шкалу депрессии Бека, шкалу депрессии Гамильтона, шкалу самооценки депрессии Уэйкфилда и др. Лечение постинсультной депрессии включает индивидуальный подбор антидепрессантов (трициклических, тетрациклических, селективных ингибиторов обратного захвата серотонина) и когнитивную психотерапию [15, 16].
К серьезным последствиям инсульта относится хронический болевой синдром, который только в части случаев носит неврогенный характер и непосредственно связан с поражением центральной нервной системы. В большинстве случаев постинсультная боль обусловлена скелетно-мышечной дисфункцией вследствие недостаточной физической активности и изменения двигательного стереотипа. Немалый вклад в формирование постинсультного болевого синдрома также вносят спастичность и эмоциональные нарушения, о чем уже говорилось выше.
Одним из наиболее опасных осложнений инсульта является дисфагия. Наличие дисфагии может привести к развитию аспирационной пневмонии, а также вызвать нарушения нормального потребления жидкости и пищи. Ранние реабилитационные мероприятия (установка назогастрального зонда, специальные упражнения, внутриглоточная стимуляция) позволяют избежать указанных последствий [4].
Вторичная профилактика ишемического инсульта
Профилактика повторного инсульта играет важную роль для пациентов, перенесших ОНМК. Как известно, максимальный риск повторного ишемического инсульта отмечается в первые дни после ОНМК, поэтому начинать профилактические мероприятия нужно как можно раньше. Профилактика повторного ишемического инсульта включает в себя модификацию образа жизни, применение лекарственных препаратов и при необходимости использование хирургических методов лечения [17, 18].
Рекомендуется отказаться от курения или сократить число выкуриваемых сигарет, что позволяет достоверно снизить риск повторного ишемического инсульта (медленно, в течение двух – четырех лет) и инфаркта миокарда [19]. Прекращение приема алкоголя или значительное уменьшение его количества также уменьшает риск повторных ОНМК.
После ишемического инсульта пациентам важно наращивать физическую активность, в том числе систематически получать аэробную нагрузку (по 30–40 минут три-четыре раза в неделю), что способствует улучшению состояния сердечно-сосудистой системы [17, 18]. При наличии неврологического дефекта, затрудняющего ходьбу, пациенту следует регулярно выполнять комплекс физических упражнений под наблюдением специалиста по лечебной физкультуре.
Для снижения риска повторного развития ишемического инсульта необходимо соблюдать диету с низким содержанием холестерина: уменьшить общее потребление жиров и легкоусвояемых углеводов (сахар, кондитерские изделия), насыщенных жирных кислот (животные жиры, сливочное масло, яйца). Напротив, целесообразно включать в рацион продукты, обогащенные полиненасыщенными жирными кислотами (растительные масла, рыба, морские продукты), клетчаткой и сложными углеводами. При артериальной гипертензии следует сократить употребление поваренной соли до 2,4 г в день, а для более значительного снижения артериального давления – до 1,5 г в сутки [17, 18].
Нормализация артериального давления является одним из наиболее эффективных направлений вторичной профилактики ишемического инсульта. В нескольких крупных исследованиях было показано, что контроль артериального давления не только снижает вероятность повторного инсульта, но и способствует уменьшению выраженности и скорости прогрессирования постинсультных когнитивных нарушений. Выбор гипотензивного препарата зависит от клинических особенностей артериальной гипертензии, индивидуальной переносимости и сопутствующей патологии пациента [18].
Согласно общепринятым рекомендациям целевым является уровень артериального давления менее 140/90 мм рт. ст. Однако снижать артериальное давление необходимо постепенно, с учетом индивидуальной переносимости и особенностей пациента. Как известно, на фоне длительной неконтролируемой артериальной гипертензии реактивность церебральных сосудов изменяется, и быстрое снижение артериального давления может привести к гипоперфузии головного мозга. Риск церебральной гипоперфузии также крайне высок у пациентов с гемодинамически значимым стенозом магистральных артерий головы.
Следует также соблюдать осторожность и в отсутствие непосредственной угрозы для жизни и здоровья пациента воздерживаться от активной антигипертензивной терапии в первые часы и дни после церебрального ишемического события. Это связано с тем, что в острейшем периоде подъем артериального давления может быть компенсаторной реакцией сердечно-сосудистой системы на церебральную ишемию. Снижение артериального давления в таком случае угрожает усугублением неврологической симптоматики.
При сопутствующем сахарном диабете и почечной недостаточности необходим контроль уровня глюкозы в крови, регулярный прием сахароснижающих препаратов. У таких пациентов следует поддерживать давление на уровне менее 130/80 мм рт. ст.
Для коррекции дислипидемии пациентам, перенесшим ишемический инсульт, на длительное время назначают статины под контролем уровня печеночных ферментов и креатинфосфокиназы в крови. Эти препараты достоверно снижают вероятность развития повторного ишемического инсульта и других ишемических событий [17, 18]. Показателем эффективности гиполипидемической терапии является уровень липопротеинов низкой плотности, который у пациентов с ишемическим инсультом в анамнезе должен быть менее 1,8 ммоль/л.
При некардиоэмболическом инсульте доказано уменьшение риска повторного инсульта при назначении антитромбоцитарных средств. Они снижают агрегацию тромбоцитов, препятствуют их фиксации на атеросклеротической бляшке и в итоге предупреждают формирование тромба. Доказанной антиагрегантной активностью обладают ацетилсалициловая кислота (АСК) в дозе 75–325 мг/сут, клопидогрел в дозе 75 мг/сут, комбинация 25 мг АСК и 200 мг дипиридамола замедленного высвобождения. В исследовании CAPRIE показано, что прием 75 мг клопидогрела в большей мере, чем прием 325 мг АСК, снижает частоту инсульта, инфаркта миокарда и острой сосудистой смерти, поэтому клопидогрел считается более эффективным средством, чем АСК [20]. По данным исследований ESPS-2 и ESPRIT, эффективность комбинации 200 мг дипиридамола замедленного высвобождения и 25 мг АСК два раза в сутки была выше по сравнению с таковой АСК и сопоставимой с таковой клопидогрела [21, 22]. Таким образом, данная комбинация может использоваться в качестве альтернативы монотерапии АСК или клопидогрелом у пациентов без сопутствующей ишемической болезни сердца.
При кардиоэмболическом инсульте у пациентов с фибрилляцией предсердий, внутрижелудочковым тромбом, искусственным клапаном или пороками клапанов сердца для вторичной профилактики применяются антикоагулянты. Золотым стандартом антикоагулянтной терапии является антагонист витамина К варфарин. Назначение данного препарата сопряжено с определенными сложностями титрации дозы и ее коррекции в зависимости от международного нормализованного отношения. При приеме варфарина международное нормализованное отношение должно измеряться один раз в две недели и поддерживаться в диапазоне от 2 до 3. В настоящее время у больных с неклапанной фибрилляцией предсердий доказали свою эффективность в отношении профилактики ишемического инсульта новые пероральные антикоагулянты, не требующие контроля международного нормализованного отношения: прямой ингибитор тромбина дабигатран, ингибиторы Xа-фактора ривароксабан и апиксабан [23, 24]. Эти препараты значительно удобнее для применения по сравнению с варфарином и не уступают ему по эффективности в отношении профилактики ишемического инсульта. Следует отметить преимущество этих препаратов по профилю безопасности, поскольку они достоверно реже вызывают внутричерепные кровотечения.
При выраженном стенозе (сужение 70–99% диаметра) внутренней сонной артерии на стороне заинтересованного полушария в ранние сроки (но не позднее шести месяцев с момента ишемического инсульта) рекомендуется хирургическое лечение: каротидная эндартерэктомия или стентирование. Для больных с умеренным (от 50 до 69%) стенозом внутренней сонной артерии хирургическое лечение имеет небольшое преимущество перед консервативными методами [17, 18].
Нейрометаболическая терапия
Как уже было отмечено выше, восстановление неврологических функций после ОНМК обусловлено пластичностью нервной ткани: функциональной перестройкой нейронов с образованием новых дендритов, синапсов и нейрональных сетей. С целью метаболической поддержки указанных процессов широко используются так называемые нейрометаболические препараты (Актовегин, Цераксон, холина альфосцерат и др.). Они способствуют регрессу и когнитивных, и других неврологических расстройств, а также позволяют более эффективно проводить нейрореабилитацию.
В настоящее время имеется положительный клинический опыт использования нейрометаболического препарата Актовегин в восстановительном периоде ишемического инсульта. Актовегин представляет собой высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят. Препарат содержит низкомолекулярные биологически активные соединения: олигопептиды, аминокислоты, нуклеозиды, промежуточные продукты углеводного и жирового обмена, а также микроэлементы (натрий, кальций, фосфор, магний и медь). В эксперименте показано, что использование Актовегина способствует переводу процессов анаэробного гликолиза в энергетически более выгодный аэробный гликолиз. При этом Актовегин не увеличивает потребности клеток в кислороде [25, 26]. Благодаря инсулиноподобному эффекту препарат способствует увеличению трансмембранного транспорта глюкозы внутрь клетки, не влияя при этом на рецепторы инсулина. Предполагается, что он принимает участие в активации имеющихся в мембране носителей глюкозы. Усиление транспорта глюкозы происходит под действием инозитолфосфат-олигосахаридов, входящих в состав Актовегина [25, 26].
Было показано, что Актовегин препятствует образованию активных форм кислорода, тормозя окислительный стресс, и оказывает нейропротективный эффект, повышая выживаемость нейронов и снижая уровень маркеров индукции апоптоза (каспазы 3). Актовегин увеличивает выживаемость первичных нейронов гиппокампа при воздействии на них амилоидного белка.
Осуществление под действием Актовегина гликолиза в ишемизированных тканях обеспечивает работу других метаболических шунтов, в частности аланинового и орнитинового, поскольку и эти, и другие аминокислоты также входят в состав Актовегина. Включение в соответствующие циклы тканевого метаболизма таких незаменимых аминокислот, как пролин, лейцин и орнитин, способствует активации белкового синтеза и выраженному репаративному (заживляющему) действию препарата. Кроме того, пролин, лейцин и орнитин, содержащиеся в Актовегине, корригируют цитокиновый дисбаланс за счет «включения» в соответствующие детоксицирующие циклы [27].
Актовегин также улучшает микроциркуляцию в тканях, положительно воздействуя на эндотелий микрососудов.
Экспериментальными исследованиями доказано, что Актовегин не только помогает нейронам пережить период критической ишемии, но и сокращает отрицательное действие постишемической рециркуляции, способствуя ликвидации отсроченного энергетического дефицита в церебральной коре и гиппокампе взрослых крыс. Принимая во внимание результаты экспериментальных и клинических исследований, можно сказать, что применение данного препарата в раннем восстановительном периоде церебрального инсульта патогенетически обосновано.
А.А. Скоромец и В.В. Ковальчук проанализировали результаты лечения 1920 больных, перенесших инсульт, из них у 1520 пациентов инсульт носил ишемический характер. Средний возраст больных с ишемическим инсультом (846 женщин и 674 мужчины) был 62,3 года (от 36 до 80 лет). Пациенты находились на стационарном лечении в отделении неврологической реабилитации Городской больницы № 38 им. Н.А. Семашко с 2001 по 2005 г. включительно. Все они госпитализировались в отделение трижды: в течение первого, шестого и 11-го месяца от начала заболевания. Определялась степень восстановления различных функций через год после инсульта при помощи индекса Бартел, шкалы Линдмарк и Скандинавской шкалы инсульта. В период реабилитации больные получали различные нейрометаболические препараты: пирацетам, антиоксиданты, антигипоксанты, витамины, альфа-липоевую кислоту и др. (всего 11 лекарственных средств). В наибольшей степени восстановлению нарушенных функций после ишемического инсульта способствовала терапия Актовегином. Так, у 78,3% больных, получавших данный препарат, отмечалось «достаточное» и «полное» восстановление функций [28].
Есть также данные об эффективности Актовегина при постинсультных когнитивных нарушениях. Е.А. Деревянных и соавт. исследовали динамику когнитивных функций у 43 пациентов, перенесших ишемический инсульт и получавших различную нейрометаболическую терапию. На фоне использования Актовегина у них наблюдалось достоверно более выраженное улучшение когнитивных функций в раннем восстановительном периоде инсульта [29].
Учитывая нейропротективный профиль действия Актовегина, наибольший интерес представляет его вероятный профилактический эффект в отношении возникновения и прогрессирования постинсультных когнитивных нарушений. В настоящее время завершено крупное международное рандомизированное плацебоконтролируемое исследование эффективности Актовегина при постинсультных когнитивных нарушениях [30]. Результаты исследования были впервые представлены на I конгрессе Европейской академии неврологии в Берлине в июне 2015 г. Через шесть месяцев лечения в группе Актовегина была получена статистически достоверная разница относительно группы плацебо по первичной конечной точке – изменению по шкале оценки когнитивных функций при болезни Альцгеймера (Alzheimer’s Disease Assessment Scale – Cognitive Subscale – ADAS-cog+). Это подтверждает эффективность препарата в отношении улучшения когнитивных функций у пациентов после инсульта.
Согласно общепринятой схеме, Актовегин обычно назначается в реабилитационном периоде инсульта в зависимости от выраженности неврологического дефицита: в/м 5 мл (200 мг) или в/в 10–20 мл (400–800 мг) в течение 10–20 дней, далее по одной таблетке три раза в день, курс приема не менее одного месяца.
Заключение
Пациент, перенесший ишемический инсульт, нуждается в постоянной профилактике повторного ОНМК. Вторичная профилактика включает модификацию образа жизни, прием лекарственных препаратов (антигипертензивных и антитромботических средств, статинов), корректирующих сосудистые факторы риска, и в некоторых случаях хирургическое вмешательство. В зависимости от вида и тяжести имеющихся неврологических нарушений необходимо индивидуально подбирать различные реабилитационные программы и сочетать их с различными лекарственными средствами (для лечения депрессии, когнитивных нарушений, тазовых нарушений, спастичности).
V.V. Zakharov, D.O. Gromova
Sechenov First Moscow State Medical University
Contact person: Vladimir Vladimirovich Zakharov, zakharovenator@gmail.com
Principles of the secondary prevention for ischemic stroke including lifestyle changes, therapeutic correction of vascular risk factors (administration of anti-hypertensives, anti-thrombotic agents, statins) and surgical intervention in some cases are discussed. It is emphasized that preventive measures need to be provided as soon as possible. Depending on type and severity of neurologic disorders, an individualized selection of various rehabilitation protocols alone or in combination with medicated therapy (for treating depression, cognitive disorders, pelvic impairment, spasticity) is required. Opportunity of using neurometabolic therapy during rehabilitation period and secondary prevention of ischemic stroke are considered by analyzing Actovegin.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.