Вирусассоциированный гломерулонефрит и эффективность терапии Вифероном у детей с первичным гормоночувствительным нефротическим синдромом
- Аннотация
- Статья
- Ссылки
- English

Гломерулонефрит (ГН) – двустороннее диффузное воспаление почек с преимущественным поражением клубочков. Наиболее часто иммунопатогенетическим механизмом развития ГН является иммунокомплексный (70–80% от общего числа больных ГН). В последние десятилетия изменились наши представления о вирусной инфекции в целом и о роли вирусов в патогенезе ГН в частности [1–3]. Вирусассоциированным называется ГН, при котором установлена этиологическая или патогенетическая роль вирусной инфекции.
В подавляющем большинстве случаев ассоциации ГН с вирусом гепатита B (ВГB) отмечается бессимптомное или малосимптомное течение гепатита, проявляющееся преимущественно в виде изолированного повышения активности трансаминаз. Существует зависимость между клинической активностью ГН и титром антител ВГB, сероконверсией антител к НВсAg, а также уровнем специфических циркулирующих иммунных комплексов, содержанием антигенов ВГB в почечной ткани [1, 4, 5].
Хотя по клиническим проявлениям и морфологическим признакам ГН, связанный с ВГB-инфекцией, зачастую не отличается от вариантов ГН, при которых этот вирус не был обнаружен, в то же время многие исследователи [1, 6] отмечают, что для ГН, ассоциированного с ВГB-инфекцией, характерны:
- высокая частота обострений;
- нефротический синдром со смешанным мочевым синдромом у большей части больных;
- преимущественное развитие заболевания у мальчиков в дошкольном возрасте;
- склонность к торпидному течению;
- недостаточный ответ на стероидные и иммуносупрессивные препараты.
В последние 10–15 лет частота выявления маркеров ВГB у детей с ГН снизилась на порядки. Таким образом, в результате проводимой вакцинации роль ВГB как этиопатогенетического фактора при ГН резко уменьшилась.
Однако вирус гепатита C (ВГC) по-прежнему нередко выявляется у детей с тяжелыми формами ГН. После открытия ВГC в 1989 г. и установления тесной связи смешанной криоглобулинемии с ВГC-инфекцией стала активно изучаться роль этого вируса в патогенезе ГН. Частота выявления смешанной криоглобулинемии среди больных с ВГC составляет 34–54% [7–9]. Смешанные криоглобулины состоят из иммуноглобулинов (Ig) разных классов, чаще IgG и IgM, со свойствами ревматоидного фактора – моноклонального IgМ-каппа (II тип) и поликлонального IgМ (III тип). Наиболее высокой нефритогенностью обладает II тип криоглобулинемии [7]. Морфологически ГН, ассоциированный с ВГC, в том числе и протекающий с криоглобулинемией, близок к идиопатическому мезангиокапиллярному ГН. Однако морфологические изменения в почках при криоглобулинемическом мезангиокапиллярном ГН имеют особенности, отличающие его от идиопатического мезангиокапиллярного ГН I типа:
- внутрикапиллярные тромбы, состоящие из преципитатов криоглобулинов и имеющие вид фибриллярных или кристаллоидных структур при электронной микроскопии;
- гиперклеточность клубочков из-за массивной инфильтрации лейкоцитами, главным образом моноцитами;
- выраженное удвоение и утолщение базальной мембраны клубочков почек;
- васкулит с поражением артерий мелкого и среднего калибра с участками фибриноидного некроза и моноцитарной инфильтрацией стенки.
Связь криоглобулинемического мезангиокапиллярного ГН с ВГC-инфекцией была подтверждена в исследованиях, проведенных в Европе (Италия, Франция, Испания), США и Японии. В настоящее время выявляют структурные белки ВГC в иммунных отложениях в клубочке и интерстиции [10]. По данным О.В. Чумаковой [11], небольшая и умеренно выраженная криоглобулинемия (+, ++) выявлялась у 44,4% детей с ГН, ассоциированным с ВГC-инфекцией. Однако исследования проводились в условиях иммуносупрессивной терапии, что не исключает более высоких исходных уровней криоглобулинов у данных пациентов. Клинико-лабораторные проявления ГН в сочетании с ВГC-инфекцией мало отличались от таковых при ВГB-ассоциированном ГН и в большей степени отличались от ГН без поражения печени. При сочетании ГН с ВГC-инфекцией у большинства больных наряду с поражением почек и печени отмечались изменения со стороны других органов и систем (кожная сыпь, суставной синдром, поражение сердца, энцефалопатии, офтальмологические изменения) в разных комбинациях. Резистентность к стероидам была выявлена у всех детей при ГН в сочетании с ВГC [11].
Менее изучен вопрос о роли герпесвирусной инфекции в этиологии и патогенезе ГН. Основная и наиболее характерная особенность этой группы вирусов – их способность к развитию латентной персистенции с присутствием вирусного генома. Инфекционный вирус образуется только в период реактивации инфекции. Вирус обладает тропизмом к эпителиальным и нервным клеткам, кератотропен. Рецидивированию герпесной инфекции способствуют факторы, снижающие иммунную защиту, в частности интеркуррентные инфекции, особенно пневмококковая и вирусная, ультрафиолетовое облучение, гормональные изменения и иммуносупрессивные лекарства. Защита организма против вируса простого герпеса (ВПГ) связана с клеточным иммунитетом, в первую очередь с мононуклеарными клетками, которые участвуют в специфическом бластогенном ответе и антителозависимой цитотоксичности, а также с естественными киллерными клетками. Гуморальный иммунитет не дает защиты против рецидивов инфекции [12].
Герпесвирусы чаще всего выявляют в биологических жидкостях (кровь, моча и/или слюна) методом культуральной диагностики или полимеразной цепной реакции (ПЦР). Для исследования антител классов IgG и IgM к герпесвирусам (цитомегаловирус (ЦМВ), ВПГ, вирус Эпштейна – Барр (ВЭБ)) применяют иммуноферментный анализ (ИФА).
У детей с ГН отмечается высокая инфицированность вирусами, особенно из семейства Herpesviridae. ВПГ I типа определяется у половины больных с острым течением ГН, причем чаще – у детей с нефротическим синдромом (q = 0,64), чем с нефритическим (q = 0,2). Очень редко у детей с остропротекающим ГН определяются ЦМВ и ВПГ II типа. ВПГ I типа чаще выделяется из крови, реже из мочи и лишь в единичных случаях – из слюны [13].
Существенным фактором, способствующим вирусной персистенции у больных ГН, являются нарушения в системе интерферона (ИФН).
Исследования по изучению роли ИФН при ГН у детей редки. Так, на примере небольшой группы детей V. Stefanović и соавт. описывали снижение уровня индуцированной продукции ИФН-гамма клетками периферической крови при рецидиве и на фоне стероидной терапии гормоночувствительного нефротического синдрома (ГЧНС), однако в ремиссии ГЧНС уровни индуцированного ИФН-гамма не отличались от контрольных [14]. Об определенном снижении интерферонообразования у детей, страдающих ГН, неоднократно писали и отечественные исследователи [1, 2, 15]. Так, В.В. Длин [1] выявил достоверное снижение интерферонообразования у 83 детей, страдающих различными формами ГН, причем достоверных различий в зависимости от клинической формы ГН получено не было. Изучение интерферонового статуса в двух группах детей с гормонорезистентным нефротическим синдромом (ГРНС) и ГЧНС показало значительное снижение продукции ИФН-альфа и ИФН-гамма относительно нормативных показателей, при этом уровень сывороточного ИФН был повышен по сравнению с нормой. И хотя изменения были однотипны, в группе детей с ГРНС наблюдались достоверно более выраженные нарушения интерферонового статуса (ИФН-альфа, -гамма и сывороточный), чем у детей с ГЧНС [2].
Предположительно, при участии вирусной инфекции в патогенезе ГН на фоне эффективного использования противовирусной терапии может наблюдаться улучшение течения и уменьшение выраженности клинических проявлений заболевания. Гломерулонефрит, ассоциированный с экстраренальными вирусными инфекциями, обычно инициализируется посредством сложных реакций компонентов иммунной системы. Например, иммуноглобулины циркулирующих иммунных комплексов могут повреждать гломерулярные клетки при активации Fc-рецепторов, но способствуют ли комплексы вирусных нуклеиновых кислот гломерулярному воспалению, неизвестно. Молекулярные патологические механизмы, при помощи которых вирусные инфекции могут вызывать ГН, пока не выявлены [16, 17].
Лечение герпесвирусной инфекции представляет сложную задачу. Все разнообразие методов лечения и профилактики герпесвирусных инфекций в конечном счете сводится к трем основным подходам: иммунотерапии (препараты внутривенных иммуноглобулинов, ИФН и вакцинация), химиотерапии (с применением препаратов аномальных нуклеозидов) либо их комбинации [18, 19]. В литературе трудно найти единое мнение относительно применения противовирусных препаратов в нефрологии, в частности при различных клинико-морфологических вариантах ГН [1, 13, 18, 20]. В целом современная противовирусная терапия эффективно уменьшает клинические проявления герпесвирусной инфекции, однако не предотвращает рецидивов заболевания [18]. В связи с этим предпринимаются попытки непосредственного воздействия на иммунную систему с целью стимуляции ее специфических и неспецифических факторов. Учитывая сказанное выше, можно предположить, что комбинированное применение противовирусных препаратов будет способствовать снижению частоты и интенсивности герпесвирусных инфекций и, как следствие, приведет к положительной динамике течения ГН.
Цель исследования – изучить состояние системы ИФН-альфа и -гамма и оценить эффективность включения рекомбинантного ИФН-альфа-2 (Виферон®) в комплекс лечения первичного ГЧНС у детей.
Материалы и методы
Было обследовано 38 детей, страдающих первичным нефротическим синдромом (НС), в том числе 7 детей с дебютом НС, 8 – с рецидивирующим течением ГЧНС, 23 – с гормонозависимым вариантом нефротической формы ГН. Фильтрационная функция почек у всех пациентов была сохранна. Среди обследованных преобладали мальчики – 29 (76%). Возраст детей был от 2 до 17 лет, средний возраст составил 9,9 ± 0,7 года. Степень активности НС определялась согласно следующим критериям [21, 22]: ΙΙΙ степень – выраженный отечный синдром, вплоть до анасарки, выраженные биохимические признаки НС (гипопротеинемия, гипоальбуминемия < 25 г/л, гиперхолестеринемия), протеинурия нефротического уровня (больше 3 г/сут); ΙΙ степень – отечный синдром отсутствует, биохимические признаки НС минимальны (альбумин крови > 25 г/л), протеинурия < 3 г/сут; Ι степень – отеков нет, биохимические признаки НС отсутствуют (альбумин крови > 30 г/л, возможна остаточная гиперхолестеринемия), протеинурия менее 1 г/сут; 0 степень – клинико-лабораторная ремиссия, отсутствие экстраренальных, биохимических признаков НС и мочевого синдрома (белок в моче отсутствует).
Все пациенты были разделены на 3 группы по степени активности НС: в первую группу вошли 12 детей с активностью НС ΙΙ–ΙΙΙ степени, в том числе 8 (67%) мальчиков и 4 (33%) девочки, средний возраст – 9,9 ± 1,3 года; во вторую группу – 20 детей с активностью гормоночувствительного НС Ι степени, в том числе 16 (80%) мальчиков и 4 (20%) девочки, средний возраст – 10,2 ± 0,9 года; в третью группу – 6 детей с НС в ремиссии более 4 месяцев, в том числе 5 (83%) мальчиков и 1 (17%) девочка, средний возраст – 9,0 ± 1,6 года. Контрольную группу составили 8 практически здоровых детей, в том числе 6 (75%) мальчиков и 2 (25%) девочки, средний возраст – 8,78 ± 0,86 года. Таким образом, изучаемые группы по полу и возрасту достоверно не различались (р > 0,05).
Всем детям основных групп исследования и группы контроля определяли уровни ИФН-альфа и -гамма в сыворотке крови (в том числе сывороточный уровень и уровни спонтанной и индуцированной продукции). Для определения интерферонового статуса использовалась венозная кровь, постановку тестов производили в день забора крови. Инкубацию разведенной средой крови осуществляли при 37 °С в атмосфере 5% СО2 в течение 24 часов. Для индукции ИФН-альфа использовался раствор, содержащий вирус болезни Ньюкасла. Концентрацию ИФН-альфа в сыворотке крови определяли иммуноферментным методом с применением тест-системы «α-Интерферон – ИФА – БЕСТ» (ЗАО «Вектор-Бест», г. Новосибирск-117). Результаты оценивали, используя иммуноферментный анализатор Anthos-2020 (“Anthos Labtec Instruments GmbH”, Австрия).
Большинству детей (n = 23), принявших участие в исследовании, и всем детям группы контроля проводилось исследование лейкоконцентрата крови и осадка мочи на наличие ЦМВ, ВЭБ и ВПГ методом ПЦР с применением соответствующих наборов “Herpes simplex virus 1 type”, “Human cytomegalovirus” и “Epstein-Barr virus” (НПФ «Гентех», Москва). Наличие антител классов М и G определяли с помощью ИФА с применением коммерческих иммуноферментных наборов и тест-систем для выявления соответствующих иммуноглобулинов (НПО «Диагностические системы», Москва).
Статистическая обработка полученных данных проводилась при помощи программы Statistica 6.0. Проверка нормальности распределения осуществлялась с использованием критерия Колмогорова – Смирнова. При отличном от нормального распределении признаков использовались непараметрические статистические методы. Изучение различий двух несвязанных групп проводилось с применением критерия Манна – Уитни. Для определения корреляции применялся непараметрический коэффициент корреляции Спирмена. При проверке статистических гипотез наличие статистической значимости определялось при значении р < 0,05.
Результаты исследования
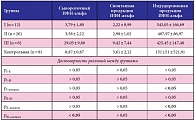
У детей с первичным ГЧНС независимо от активности процесса средний уровень сывороточного ИФН-альфа был выше по сравнению с группой контроля, но только у детей в ремиссии НС выявлена достоверная разница (р < 0,05; табл. 1). Средний уровень спонтанной продукции ИФН-альфа не зависел от активности НС и достоверно не отличался от показателей контрольной группы (р > 0,05). Средний уровень индуцированной продукции ИФН-альфа у детей с первичным ГЧНС вне зависимости от активности НС был достоверно ниже, чем в группе контроля (р < 0,05). Корреляции между уровнями сывороточного ИФН-альфа, спонтанной продукции, индуцированного ИФН-альфа и степенью активности НС не выявлено (р > 0,05).
Участники основной группы, которым проводилось вирусологическое обследование для выявления ЦМВ, ВПГ и ВЭБ-инфекции методом ПЦР (23 ребенка), были разделены на три подгруппы. Подгруппу А составили 14 детей с отрицательными результатами определения ЦМВ, ВПГ, ВЭБ в крови и моче, в том числе 11 (79%) мальчиков и 3 (21%) девочки (средний возраст – 9,14 ± 0,97 года); подгруппу Б – 9 детей с положительной реакцией хотя бы на один из определяемых герпесвирусов в крови и/или моче, в том числе 5 (56%) мальчиков и 4 (44%) девочки (средний возраст – 6,72 ± 0,95 года); подгруппу В (контроль) – 8 практически здоровых детей, в том числе 6 (75%) мальчиков и 2 (25%) девочки (средний возраст – 8,78 ± 0,86 года) с отрицательными результатами тестов на ЦМВ, ВПГ и ВЭБ в крови и моче.
Независимо от установления факта инфицирования герпесвирусами (ВПГ, ЦМВ, ВЭБ) средний уровень сывороточного ИФН-альфа у детей с первичным ГЧНС был выше, чем в контрольной группе. Средний уровень спонтанной продукции ИФН-альфа достоверно не зависел от наличия персистирующей герпесвирусной инфекции и не отличался от показателя группы контроля. Средний уровень индуцированной продукции ИФН-альфа не зависел от наличия персистирующей герпесвирусной инфекции, но был достоверно ниже, чем в группе контроля (табл. 2).
Затем 36 детей, включенных в исследование (2 ребенка из 38 выбыли по возрасту), были разделены на 2 группы. Первую группу составили 18 детей, в том числе 13 (72%) мальчиков и 5 (28%) девочек (средний возраст – 6,7 ± 0,7 года), которые в составе комплексной терапии НС получали препарат ИФН-альфа-2b (Виферон®) с противовирусной и иммуномодулирующей целями (1 суппозиторий 2 р/сут с интервалом 12 часов в течение 10 дней, затем – 3 раза в неделю через день в течение 4–6 месяцев (до 7 лет – 150 тыс. МЕ 2 раза в день, старше 7 лет – 500 тыс. МЕ 2 раза в день)). Во вторую группу были включены 18 детей, в том числе 13 (72%) мальчиков и 5 (28%) девочек (средний возраст – 9,3 ± 1,1 года), не получавших Виферон® в комплексной терапии НС. Группы достоверно не различались по проводимой патогенетической иммуносупрессивной терапии (глюкокортикоиды, Хлорбутин, циклоспорин A, микофенолата мофетил в стандартных дозировках).
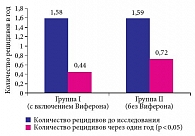
В первой группе среднее количество рецидивов НС до и после включения препарата Виферон® составило 1,58 ± 0,24 и 0,44 ± 0,17 в год соответственно. Во второй группе (без включения в терапию Виферона) количество рецидивов НС до включения в исследование и спустя год наблюдения составило 1,59 ± 0,26 и 0,72 ± 0,21 в год соответственно (р < 0,05; рисунок). На основании этих данных можно заключить, что включение Виферона способствует снижению частоты рецидивов НС. Однако, учитывая небольшую численность групп исследования, трудно оценить различие во влиянии данного препарата на течение заболевания у детей с рецидивирующим гормоночувствительным и гормонозависимым НС.
Таким образом, у детей с ГЧНС, независимо от активности заболевания, отмечался более высокий уровень сывороточного ИФН-альфа и значительное снижение уровня индуцированного ИФН-альфа по сравнению с контрольной группой, что указывает на нарушение системы ИФН и ослабление противовирусной защиты. Это соответствует данным литературы [4, 5]. У детей с выявленной персистенцией герпесвирусов имеется тенденция к более низкому уровню спонтанной и индуцированной продукции ИФН-альфа.
Отметим, что аналогичные изменения интерферонового статуса в виде повышения сывороточного ИФН и значительного снижения индуцированной продукции ИФН-альфа были показаны И.В. Лутошкиным [2] у детей с ГРНС.
Включение длительной (до 3 месяцев) терапии Вифероном в комплекс лечения пациентов с ГЧНС, ассоциированным с герпесвирусной инфекцией, позволяет снизить частоту рецидивов, что косвенно указывает на значение персистирующей вирусной инфекции в рецидивировании НС.
Virus-associated glomerulonephritis and efficacy of Viferon in children with primary steroid-dependent nephrotic syndrome
A.A. Lyndin1, V.V. Dlin1, V.V. Malinovskaya2, Ye.A. Ruzhitskaya1, T.G. Shap1, T.S. Guseva2, O.V. Parshina2
1 Federal State Budgetary Institution ‘Federal Research Institute for Pediatry and Pediatric Surgery’ of the Ministry of Health
of Russia, Moscow
2 Federal State Budgetary Institution ‘N.F. Gamaleya Research Institute for Epidemiology and Microbiology’ of the Ministry
of Health of Russia, Moscow
Contact person: Vladimir Viktorovich Dlin, vdlin@pedklin.ru
Literature data on virus-associated glomerulonephritis (GN) are presented. Interferon system abnormalities promote virus persistence in GN patients. Basing on the results of own study, the authors recommend using of human recombinant interferon alfa-2b (Viferon) as add-on therapy for primary steroid-dependent nephrotic syndrome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.