Возможности применения препаратов витамина D в коррекции нарушений сна
- Аннотация
- Статья
- Ссылки
- English
Введение
Витамин D – жирорастворимый стероидный гормон, оказывающий широкий спектр биологических эффектов благодаря взаимодействию со специфическими ядерными рецепторами [1]. Наиболее изученные функции витамина D относятся к регуляции фосфорно-кальциевого гомеостаза. Однако в настоящее время имеются убедительные доказательства его значения для поддержания нормальной деятельности сердечно-сосудистой и эндокринной систем [2]. Новейшие данные указывают на возможную роль витамина D в регуляции иммунного ответа, аппетита и психических функций, а также стволового контроля сна, для чего существуют определенные анатомические предпосылки. Рецепторы к витамину D расположены в переднем и заднем отделах гипоталамуса, черной субстанции, центральном сером веществе среднего мозга, ядрах шва, ядрах ретикулярной формации [2]. Радиографическое исследование подтвердило способность витамина D связываться с участками головного мозга, регулирующими сон [3].
История изучения физиологической роли витамина D в регуляции сна начинается с исследования N-HANES, проведенного в 2005–2006 гг. в США, когда была обнаружена взаимосвязь дефицита витамина D и низкой продолжительности сна [4]. Указанная закономерность впоследствии подтвердилась в популяционном исследовании A. Darling и соавт., но авторы не выявили ассоциации уровня витамина D с качеством сна (по данным Питтсбургского индекса качества сна) [5]. Тем не менее у пациентов с дефицитом витамина D отмечалось субъективное ухудшение качества сна (по данным Питтсбургского индекса качества сна) по сравнению с пациентами, имеющими нормальный уровень витамина D [6].
В дальнейшем S. Gominak и соавт. описали улучшение качества сна при приеме препаратов витамина D после нормализации уровня 25-гидроксивитамина D у пациентов с нарушениями сна [2]. Тот же автор наблюдал субъективное улучшение качества сна у неврологических пациентов, принимавших в течение трех месяцев комбинацию витаминов D и В. Автор предполагает, что улучшения обусловлены благоприятным влиянием витаминов на микрофлору кишечника [7]. Полученные результаты подтвердились в двойном слепом плацебоконтролируемом исследовании, в котором было установлено, что прием витамина D в течение восьми недель улучшает субъективное качество сна (по данным Питтсбургского индекса качества сна) и снижает латентность сна [8]. При этом различия между контрольной и опытной группами сохранялись после учета других влияющих факторов.
Далее будут представлены актуальные сведения о связи витамина D и нарушений сна, а также рассмотрены возможности медикаментозной коррекции нарушений сна с помощью препаратов витамина D.
Витамин D при нарушениях сна в рамках отдельных нозологических единиц
Синдром обструктивного апноэ сна
Синдром обструктивного апноэ сна (СОАС) – распространенное нарушение сна, характеризующееся повторяющимися эпизодами полного или частичного прекращения дыхания во сне вследствие обструкции верхних дыхательных путей. СОАС часто сопровождается нарушением липидного обмена и толерантности к глюкозе, подострым воспалением, что характерно и для дефицита 25-гидроксивитамина D [9].
Данные о корреляции СОАС и изменения уровня 25-гидроксивитамина D, приведенные в отдельных работах, неоднозначны. N. Bozkurt и соавт. описали снижение уровня 25-гидроксивитамина D у пациентов с СОАС по сравнению с контрольной группой и взаимосвязь тяжести СОАС, оцениваемой по индексу апноэ – гипопноэ, с уровнем 25-гидроксивитамина D [9]. Похожие результаты были получены в работе C. Kerley [10]. T. Mete и соавт. установили, что у пациентов с СОАС уровень 25-гидроксивитамина D не отличается от показателей в контрольной группе, но у пациентов с тяжелой степенью СОАС наблюдается значимое снижение уровня 25-гидроксивитамина D [11]. E. Erden и соавт. обнаружили более низкий уровень 25-гидроксивитамина D по сравнению с контрольной группой только у пациентов с СОАС тяжелой и средней степени тяжести, в то время как у пациентов с СОАС легкой степени тяжести подобных отличий не наблюдалось [12]. Тем не менее U. Goswami и соавт. не подтвердили независимого влияния низкого уровня 25-гидроксивитамина D на СОАС у пожилых людей, тогда как основными факторами риска выступали высокий индекс массы тела и большая окружность шеи [13].
Похожие закономерности наблюдаются и у пациентов детского возраста. Так, низкий уровень 25-гидроксивитамина D коррелировал с высокой вероятностью выявления СОАС по данным Берлинского опросника и тяжестью СОАС, оцениваемой по индексу апноэ – гипопноэ [14, 15]. Кроме того, у детей с первичным храпом отмечался низкий уровень витамина D, который ассоциировался с увеличенным объемом тромбоцита, причем объем тромбоцита в свою очередь был связан с уровнем С-реактивного белка. Это косвенно может свидетельствовать о возможном вкладе активации воспалительного ответа при дефиците витамина D в развитие обструкции дыхательных путей как одной из причин возникновения первичного храпа [16].
S. Upala и соавт. провели систематический обзор и метаанализ исследований, касающихся взаимосвязи СОАС и уровня 25-гидроксивитамина D, и подтвердили, что СОАС ассоциировался с низким или умеренно сниженным уровнем 25-гидроксивитамина D (до 30 нг/мл) [17]. С учетом этих данных, с одной стороны, можно предположить возможное благоприятное влияние препаратов витамина D на выраженность и течение СОАС и его осложнений. С другой стороны, наблюдаемое снижение уровня витамина D при СОАС может быть вторичным изменением, обусловленным интермиттирующей гипоксией, как при хронической обструктивной болезни легких [17], или избыточной дневной сонливостью, что подробно обсуждается ниже.
Витамин D может оказывать комплексное действие при СОАС, воздействуя на различные звенья патогенеза. Кратковременные эпизоды транзиторной системной гипоксии при СОАС индуцируют окислительный стресс и воспалительный ответ, ведущий за собой каскад системных реакций, точные механизмы которых в настоящее время изучены недостаточно [9]. У пациентов с СОАС повышены уровни фактора некроза опухоли альфа, интерлейкина 6, С-реактивного белка, связанных с индексом апноэ – гипопноэ [9, 15, 18–20].
В свою очередь витамин D воздействует на важнейшие звенья патогенеза СОАС и снижает воспалительный ответ за счет уменьшения выработки провоспалительных биологически активных веществ (интерлейкинов 1-бета, 2, 6, 8, интерферона гамма, фактора некроза опухоли альфа) с последующим ингибированием пролиферации мононуклеаров и Т-лимфоцитов [9]. Компенсация воспалительного ответа при СОАС под воздействием витамина D может приводить к снижению некоторых проявлений нарушений дыхания во сне.
Показана способность витамина D улучшать чувствительность к инсулину и снижать цитокин-опосредованный апоптоз бета-клеток за счет непосредственного влияния на синтез и функции провоспалительных цитокинов [9]. C. Kerley и соавт. установили, что у пациентов с СОАС и инсулинорезистентностью уровень 25-гидроксивитамина D был ниже, чем у пациентов с СОАС и без инсулинорезистентности [10]. В клиническом исследовании с применением препарата витамина D у пациентов, участвующих в программе поддержания метадоном, произошло улучшение чувствительности к инсулину на фоне увеличения сывороточного уровня витамина D и улучшения качества сна, оцениваемого по Питтсбургскому индексу качества сна [21]. Следовательно, нельзя исключать возможности использования препаратов витамина D для профилактики развития инсулинорезистентности при СОАС.
Описана способность препаратов витамина D нормализовать показатели липидного обмена. В пилотном исследовании у пациентов с СОАС, принимавших витамин D3 в течение 15 недель, на фоне возрастания сывороточного уровня 25-гидроксивитамина D было показано снижение липопротеинов низкой плотности и липопротеин-ассоциированной фосфолипазы А2 [22]. В клиническом исследовании с использованием препарата витамина D у пациентов, участвующих в программе поддержания метадоном, улучшился липидный профиль на фоне увеличения сывороточного уровня витамина D и улучшения качества сна, оцениваемого по Питтсбургскому индексу качества сна [21]. Значит, витамин D может принимать участие в нормализации липидного обмена, нарушения которого характерны для пациентов с СОАС.
Кроме того, пациенты с дефицитом витамина D и низкой продолжительностью сна имеют высокий риск развития ожирения [23, 24]. Широко известно влияние витамина D на регуляцию развития клеточных элементов. Описано снижение адипогенеза и пролиферации фибробластов под воздействием витамина D [25–27].
Таким образом, использование препаратов витамина D у пациентов с СОАС может рассматриваться в качестве способа улучшения толерантности к глюкозе, нормализации липидного обмена, индекса массы тела, снижения воспалительного ответа и пролиферации тканей [9]. Однако в пилотном исследовании у пациентов с СОАС, принимавших витамин D3 в течение 15 недель, на фоне возрастания сывороточного уровня 25-гидроксивитамина D не отмечалось изменений субъективных симптомов (в частности, выраженности дневной сонливости по Эпвортской шкале сонливости) или изменений в ходе использования неинвазивной вентиляции постоянным положительным давлением воздушного потока во время сна (СиПАП-терапия) [22]. Дальнейшие клинические исследования с высоким уровнем доказательности требуются для оценки возможностей использования препаратов витамина D при СОАС.
Инсомния
Инсомния подразумевает трудности засыпания и поддержания сна вопреки наличию удовлетворительных условий и мотивации для сна [28]. В настоящее время патогенез инсомнии изучен недостаточно, однако многообразие механизмов развития данного нарушения указывает на его мультифакториальную природу [28]. Среди причин инсомнии выделяют различные соматические и психопатологические нарушения. Особенно актуальны нарушения, связанные с эмоциями и настроением (тревожность, стрессовое расстройство, депрессивное расстройство), и хронический болевой синдром [28]. Известно, что эти расстройства, характерные для пациентов с инсомнией, могут сопровождаться дефицитом витамина D [29–31].
При инсомнии также отмечается избыточная активация воспалительного ответа [32, 33]. Кроме того, вероятная связь секреции мелатонина и изменения уровня метаболитов витамина D может указывать на вклад в развитие инсомнии нарушений мелатонинергической регуляции, опосредованных дефицитом витамина D [34–37]. Однако сведения о взаимосвязи синдрома инсомнии и дефицита витамина D скудные.
Проведя популяционное исследование, M. Beydoun и соавт. установили, что низкий уровень 25-гидроксивитамина D ассоциировался с симптомами инсомнии [38]. W. Huang и соавт. описали улучшение психических функций у пациентов с низким уровнем 25-гидроксивитамина D, страдающих хроническим болевым синдромом, на фоне приема препаратов витамина D [39]. В результате трехмесячного лечения отмечалось улучшение качества жизни, по данным шкалы VR-36, и нормализация сна, что проявлялось лучшим результатом по Питтсбургскому индексу качества сна, снижением латентности сна, увеличением продолжительности и эффективности сна. При этом наибольшие изменения отмечались в подгруппе пациентов с дефицитом 25-гидроксивитамина D [39]. Тем не менее в рандомизированном контролируемом клиническом исследовании с участием жертв землетрясений прием препаратов витамина D не привел к нормализации сна [40]. Противоречивость обозначенных результатов диктует необходимость проведения дальнейших исследований, в которых изучались бы возможности применения витамина D при синдроме инсомнии.
Синдром беспокойных ног
Актуальные сведения о патогенезе синдрома беспокойных ног подразумевают нарушение дофаминергической нейротрансмиссии [41], однако нельзя исключать вклад нарушений метаболизма витамина D в развитие указанного заболевания. Считается, что 1,25-дигидроксивитамин D при воздействии на дофаминергические нейроны увеличивает экспрессию N-кадгерина, который участвует в нейрогенезе дофаминергических нейронов и в свою очередь регулирует экспрессию тирозингидроксилазы – фермента, лимитирующего скорость синтеза дофамина [24].
T. Çakır и соавт. установили, что у пациентов с дефицитом витамина D чаще встречается синдром беспокойных ног, согласно диагностическим критериям Международной группы изучения синдрома беспокойных ног, чем у пациентов с нормальным уровнем витамина D [6]. По результатам проведенного S. Wali и соавт. пилотного клинического исследования, прием препарата витамина D пациентами с синдромом беспокойных ног в течение трех – восьми недель значимо улучшал симптомы заболевания по данным Шкалы оценки тяжести синдрома беспокойных ног [42]. Дальнейшие исследования позволят уточнить возможность применения препаратов витамина D при синдроме беспокойных ног в качестве средства, уменьшающего проявления синдрома или его осложнений, вызванных увеличением латентности сна или развитием избыточной дневной сонливости [24].
Избыточная дневная сонливость
Избыточная дневная сонливость – симптом, широко распространенный в популяции, он наблюдается у 30% населения и зачастую сопутствует различным заболеваниям, характеризующимся фрагментацией и низкой эффективностью сна, таким как СОАС, инсомния или синдром беспокойных ног [43].
Согласно результатам популяционного исследования M. Beydoun и соавт., низкий уровень 25-гидроксивитамина D ассоциировался с симптомами избыточной дневной сонливости [38]. Аналогичные данные были получены в работе D. McCarty и соавт., которые изучали взаимосвязь избыточной дневной сонливости, оцениваемой по Эпвортской шкале сонливости, и уровня 25-гидроксивитамина D [44]. Авторы установили, что у пациентов с нормальным уровнем 25-гидроксивитамина D степень избыточной дневной сонливости обратно коррелировала с уровнем 25-гидроксивитамина D, тогда как у пациентов с дефицитом 25-гидроксивитамина D отмечалась прямая связь степени избыточной дневной сонливости с уровнем 25-гидроксивитамина D [44].
Следует отметить, что снижение уровня витамина D у пациентов с избыточной дневной сонливостью может рассматриваться в качестве вторичных нарушений, возникающих из-за первичных нарушений сна.
Фрагментация сна при СОАС, инсомнии, синдроме беспокойных ног и др. вызывает избыточную дневную сонливость, которая способствует снижению повседневной активности человека и преимущественному нахождению его в помещении [45]. При этом уменьшается воздействие дневного света и как следствие снижается синтез предшественника витамина D в коже [44–46]. Это предположение подтверждает факт увеличения уровня 25-гидроксивитамина D на фоне кратковременной СиПАП-терапии [47].
Ввиду того что у темнокожих пациентов с дефицитом 25-гидроксивитамина D более выражены избыточная дневная сонливость и дефицит 25-гидроксивитамина D [44, 48] по сравнению с белокожими пациентами, нельзя исключить зависимости паттернов сна от пигментации кожи посредством изменения метаболизма витамина D, опосредованного меланинконцентрирующим гормоном. Однако в настоящее время требуется проведение исследований, уточняющих роль меланинконцентрирующего гормона в абсорбции витамина D в дневное время [49].
Интерес представляют клинические случаи, описывающие улучшение симптомов идиопатической избыточной дневной сонливости на фоне приема препаратов витамина D. Клинический случай 28-летней пациентки с гиперсомнией, страдающей хроническим болевым синдромом и имеющей низкий уровень 25-гидроксивитамина D (5,9 нг/мл), был описан D. McCarty и соавт. [50]. После трехнедельного лечения препаратом 25-гидроксивитамина D в дозе 50 000 МЕ еженедельно отмечалась положительная динамика, проявляющаяся нормализацией уровня 25-гидроксивитамина D (до 39 нг/мл), снижением болевого синдрома и улучшением качества сна по результатам полисомнографии, Множественного теста латентности сна и Эпвортской шкалы сонливости [50]. K. Johnson и соавт. приводят аналогичный клинический случай 61-летнего мужчины с жалобами на избыточную дневную сонливость и имеющего исходно низкий уровень 25-гидроксивитамина D (18,4 нг/мл) [51]. При лечении препаратами витамина D в течение 14 недель нормализация уровня 25-гидроксивитамина D наблюдалась при почти полном исчезновении симптомов дневной сонливости [51]. Тем не менее у пациентов, проходящих гемодиализ, прием препаратов витамина D, регистрируемый по данным опросников, сопровождался увеличением показателей по Эпвортской шкале сонливости. Однако, по мнению авторов указанной работы, наблюдаемое явление могло быть статистическим артефактом [52].
Дефицит витамина D может сопровождаться сонливостью при условии активации воспалительных каскадов, в которых участвуют вещества, регулирующие сон [44]. В частности, известно об обратной корреляции между уровнями фактора некроза опухоли альфа и 25-гидроксивитамина D [53]. Установлено участие фактора некроза опухоли альфа в развитии сонливости при СОАС [53, 54]. Дефицит витамина D также взаимосвязан с повышением концентрации NF-κB [55], который принимает участие в регуляции активности простагландина D2 [44]. Простагландин D2 считается самым сильным эндогенным снотворным биологически активным веществом и регулирует гомеостатическое давление сна в центральной нервной системе [44, 56].
Таким образом, возможности коррекции идиопатической дневной сонливости при дефиците витамина D требуют дальнейшего изучения в исследованиях с более высоким уровнем доказательности.
Циркадианные нарушения
Несмотря на широкую распространенность заболеваний, сопровождающихся циркадианными нарушениями сна и дефицитом витамина D, таких как метаболический синдром, сахарный диабет второго типа, сердечно-сосудистые и онкологические заболевания [57], исследований по оценке витамина D при циркадианных нарушениях и его роли в их развитии не проводилось. В то же время можно предположить участие витамина D в регуляции суточных ритмов, о чем свидетельствует ряд исследований, указывающих на суточные и сезонные колебания секреции метаболитов витамина D [35, 36]. Витамин D также может считаться одним из дополнительных факторов, наряду с мелатонином, обусловливающих связь между нарушением ритма сна – бодрствования и минерального обмена [58]. Имеются данные о взаимодействии мелатонина и витамина D, например, описана отрицательная корреляция между секрецией мелатонина и уровнем 25-гидроксивитамина D у пациентов с рассеянным склерозом [37]. Кроме того, косвенно об участии витамина D в регуляции различных процессов, подверженных суточным колебаниям, свидетельствуют результаты исследования, в котором выявлена положительная корреляция между витамином D и суточным профилем артериального давления (ночным снижением) [59].
Витамин D при нарушениях сна в определенных когортах пациентов
Нарушения сна у пациентов с воспалительными заболеваниями
В некоторых исследованиях показана связь дефицита витамина D с возрастанием риска и неблагоприятным исходом течения воспалительных заболеваний инфекционной и аутоиммунной природы [60–62]. Как было указано выше, витамин D принимает участие в снижении воспалительного ответа посредством регуляции продукции воспалительных цитокинов [60]. Кроме того, витамин D снижает риск развития аутоиммунных заболеваний благодаря модуляции селекции лимфоцитов в тимусе, увеличению чувствительности Т-лимфоцитов к сигналам клеточной гибели, регуляции развития и функции CD4+ регуляторных Т-лимфоцитов, а также регуляции соотношения Т-хелперов и Т-супрессоров [63].
Один из механизмов нарколепсии первого типа – снижение концентрации орексина при аутоиммунной дегенерации орексинергических нейронов, обусловленной вовлечением CD4+ T-лимфоцитов [64]. Следовательно, можно предположить, что изменение метаболизма витамина D вносит вклад в развитие этого заболевания. Однако сведения об уровне витамина D у пациентов с нарколепсией также противоречивы. B. Carlander и соавт. отмечали снижение уровня 25-гидроксивитамина D у пациентов с нарколепсией и катаплексией по сравнению с контрольной группой здоровых лиц [65], а в аналогичном исследовании Y. Dauvilliers и соавт. не обнаружили указанных различий [66].
Известно, что воспалительные заболевания могут сопровождаться нарушениями сна, например избыточной дневной сонливостью или инсомнией [32]. При этом связь низкого уровня витамина D у пациентов с эозинофильным эзофагитом и системной красной волчанкой с субъективным ухудшением качества сна (использовался Питтсбургский индекс качества сна) [67, 68], а также положительные результаты рандомизированного исследования, свидетельствующие об улучшении качества сна на фоне приема препаратов витамина D3 у пациентов с хронической крапивницей [69], свидетельствуют о перспективах дальнейших исследований того, как метаболизм витамина D влияет на нарушения сна при данных нозологиях.
Нарушения сна у пациентов пожилого возраста
Нарушения сна чрезвычайно распространены у пациентов пожилого возраста (с частотой 50%) и преимущественно представлены инсомнией и СОАС [70, 71]. По результатам популяционных исследований, у пожилых пациентов установлена связь уровня 25-гидроксивитамина D с продолжительностью сна (по данным опросников и актиграфии) и его эффективностью [72, 73]. E. Song и соавт. предположили, что дефицит витамина D играет роль в развитии когнитивной дисфункции при нарушениях сна у пожилых пациентов [74]. Авторы обнаружили, что у пожилых пациентов с сердечной недостаточностью дефицит витамина D ассоциировался с когнитивной дисфункцией и низким качеством сна (применялся Питтсбургский индекс качества сна), причем когнитивная дисфункция при дефиците витамина D была вызвана именно низким качеством сна [74].
Нарушения сна при состояниях, вызванных изменением активности половых гормонов
Несмотря на данные о связи уровня витамина D с показателями, характеризующими качество сна в общей популяции, существуют сведения о закономерностях в регуляции сна, обусловленных экспрессией половых гормонов. В частности, описана взаимосвязь продолжительности сна с низким уровнем 25-гидроксивитамина D у мужчин разного возраста [30] и девушек-подростков [75].
C. Liguori и соавт. установили, что у мужчин с СОАС отмечался рост уровня 25-гидроксивитамина D на фоне семидневной СиПАП-терапии, тогда как у женщин указанных изменений не наблюдалось [47]. Авторы объясняют это возможным изменением уровня витамин-D-связывающего белка при снижении гипоксии в зависимости от экспрессии половых гормонов, что требует дальнейшего изучения. Кроме того, половые различия в изменении концентрации витамина D могут быть обусловлены различной степенью регуляции воспалительного ответа половыми гормонами [76]. Так, у мужчин с СОАС предполагается высокий базовый уровень С-реактивного белка, тогда как у женщин при достаточной секреции эстрогенов он низкий. Поэтому меньше вероятность того, что женщины хорошо ответят на кратковременную СиПАП-терапию [76].
У 76% женщин во время беременности отмечаются нарушения сна [77], которые в свою очередь могут сопровождаться изменениями воспалительного ответа [78], что диктует необходимость поиска новых безопасных патогенетических подходов к лечению. Сведения о возможной роли витамина D в регуляции сна у беременных противоречивы. T. Cheng и соавт. описали взаимосвязь уровня витамина D с качеством сна и приемом пищи в ночное время во втором триместре гестации [79]. Однако в исследовании S. Gunduz и соавт., несмотря на дефицит витамина D, у 81% женщин с нарушениями сна (по данным Питтсбургского индекса качества сна) в последнем триместре беременности не подтвердилась ассоциация нарушений сна с уровнем витамина D [80].
Сведения о нарушениях сна (затруднении засыпания и поддержания сна, частых ночных и ранних пробуждениях) у женщин в менопаузе при изменении уровня витамина D также неоднозначны [81]. A. Darling и соавт. установили, что эффективность сна коррелирует с сывороточным уровнем витамина D у женщин в менопаузе [5]. Кроме того, у женщин в менопаузе описана связь между приемом витамина D в качестве пищевой добавки и изменением циркадианных ритмов. В частности, известно, что более поздняя акрофаза сна наблюдается при употреблении большего количества витамина D [82].
Тем не менее клинические исследования препаратов витамина D у женщин в менопаузе не подтверждают возможность улучшения качества сна [83, 84]. Было проведено двойное слепое плацебоконтролируемое рандомизированное клиническое исследование с участием женщин в менопаузе, страдающих ожирением и проходящих программу снижения массы тела. У женщин, имевших наибольшую динамику 25-гидроксивитамина D за 12 месяцев, появились жалобы на ухудшение общего качества сна с необходимостью приема препаратов для поддержания сна [84].
Увеличение сывороточного уровня 25-гидроксивитамина D на фоне приема препаратов витамина D сопровождается снижением концентрации эстрадиола и прогестерона у молодых женщин [85] и тестостерона у мужчин [86]. Это может быть обусловлено взаимодействием витамина D с гормонами гипоталамуса, регуляцией активности ароматазы посредством модуляции метаболизма кальция или непосредственным контролем экспрессии гена ароматазы [85, 87]. И избыток, и недостаток половых гормонов могут приводить к нарушениям продолжительности, архитектуры и циркадианной ритмики сна. Таким образом, отсутствие единого понимания взаимосвязи витамина D и нарушений сна с учетом различной экспрессии половых гормонов диктует необходимость новых исследований.
Заключение
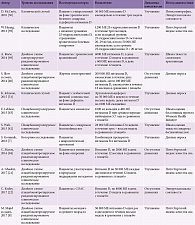
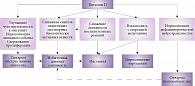
Патологические изменения метаболизма витамина D могут быть одной из причин нарушений сна или их осложнений. В свою очередь препараты витамина D могут оказаться перспективными для коррекции нарушений сна за счет способности снижать воспалительный ответ, уменьшать синтез эндогенных снотворных биологически активных веществ, нормализовать дофаминергическую нейротрансмиссию, углеводный и жировой обмен и сдерживать пролиферацию (рисунок). Тем не менее возможность использования препаратов витамина D в коррекции нарушений сна у отдельных групп пациентов или при определенных нозологиях требует уточнения (таблица). Следовательно, существует необходимость в дальнейших исследованиях с высоким уровнем доказательности, направленных на расширение понимания терапевтических эффектов при назначении препаратов витамина D пациентам с нарушениями сна.
I.A. Filchenko, L.S. Korostovtseva, Yu.V. Sviryaev
Almazov National Medical Research Centre, Saint Petersburg
Sechenov Institute of Evolutionary Physiology and Biochemistry, Saint Petersburg
North-Western State Medical University named after I.I. Mechnikov, Saint Petersburg
Contact person: Lyudmila Sergeyevna Korostovtseva, lyudmila_korosto@mail.ru
Vitamin D is a steroid hormone that exerts a wide spectrum of biological effects associated not only with the control of phosphorus and calcium homeostasis, but also with the regulation of cardiovascular, endocrine and immune system and psychic functions. The data from anatomical and physiological studies confirming the functional role of vitamin D in the central nervous system point out the role of vitamin D in sleep homeostasis. The changes of vitamin D metabolism were described in various sleep disorders including obstructive sleep apnea, insomnia, restless leg syndrome, excessive daytime sleepiness and may substantiate opportunities of pharmacological normalization of vitamin D levels for the control of sleep disorders. This review article summarizes the current knowledge of the opportunities for the pharmacological therapy with vitamin D medications for sleep disorders with the consideration of the pathophysiological features of separate states.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.