Врожденная гиперплазия коры надпочечников: новые подходы к диагностике, ведению женщин вне и во время беременности
- Аннотация
- Статья
- Ссылки
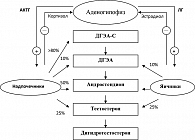

Андрогены играют важную роль в жизнедеятельности женского организма. Термин «андроген» в целом применим к классу C19 стероидов, которые образуются в гонадах и надпочечниках у лиц обоего пола и включают тестостерон (T), дегидроэпиандростерон (ДГЭА), дегидроэпиандростерон сульфат (ДГЭА-С), андростендион (A) и 5 a-дигидротестостерон (ДГТ) (см. рисунок) (1).
У женщин репродуктивного возраста приблизительно равное количество Т (25%) и А (50%) образуется в яичниках и надпочечниках, а остальная часть – на периферии, в основном в жировой ткани. Что касается так называемых D-андрогенов (дельта-андрогенов), – ДГЭА и ДГЭА-С, то около 70-80% от их общего количества продуцируется в надпочечниках, затем основная часть на периферии путем конверсии превращается в А, Т, ДГТ и эстрогены. Секреция андрогенов яичниками и надпочечниками, в дополнение к локальным внутрижелезистым механизмам, стимулируется ЛГ и АКТГ. По сравнению с другими андрогенными стероидами T и ДГТ обладают самой мощной биологической активностью. У молодых здоровых женщин ежедневная продукция Т в организме составляет примерно 300 mг (примерно 5% от таковой у мужчин), при этом около 98% этого гормона находится в связанном с белками состоянии, в основном с глобулином, связывающим половые стероиды (ГСПС), и только 2% – в свободном состоянии.
Продукция андрогенов яичниками и надпочечниками варьирует в течение менструального цикла, максимальный пик отмечается в середине цикла (2).
Известно, что первичными половыми гормонами, которые синтезируются в женском организме, являются андрогены, из которых в процессе ароматизации в гранулезных клетках яичников образуются эстрогены. Ароматазная активность, ответственная за превращение андрогенов в эстрогены, активизируется уже к 20-й неделе беременности, и с этого времени концентрация эстрогенов у плодов женского пола и далее в постнатальный период у девочек выше, чем у мальчиков. В возрасте 6-7 лет у девочек происходит увеличение секреции ДГЭА, ДГЭ-С и А в надпочечниках. Эта фаза полового развития называется адренархе, затем в течение пубертатного периода уровень этих гормонов продолжает нарастать. Полагают, что андрогены надпочечникового происхождения принимают участие в активации пубертатного роста и созревания скелета, играют определенную роль в развитии полового оволосения, участвуют в половой дифференцировке мозга, контролируют циклическую регуляцию секреции гонадолиберина и половое поведение. Максимальная концентрация адреналовых андрогенов достигается в 3-м 10-летии жизни женщины.
Биосинтез половых гормонов обеспечивается активностью 6 ферментных систем, 3 из которых являются общими для начальных этапов стероидогенеза в надпочечниках и в яичниках: 21-гидроксилаза, 11-гидроксилаза, 3b-ол-дегидрогеназа, 18-17-гидроксилазы, 20-22-десмолазы (3).
После диссоциации андрогенов и белка-носителя свободные гормоны проникают в клетку и связываются со специфическим белком – андрогенным рецептором, производя геномный эффект. Биологическое воздействие андрогенов осуществляется практически на все ткани, при этом основными органами-мишенями являются все гормонально-зависимые структуры репродуктивной системы (4). Помимо внутригонадного действия (участие в выборе доминантного фолликула), в норме андрогены оказывают влияние на центральную регуляцию репродуктивной системы, подавляя пульсирующую секрецию гонадолиберинов и гонадотропинов (ГТ) по принципу обратной отрицательной связи. В противоположность этому ГА оказывает множественное негативное влияние, проявляющееся в подавлении роста, созревания фолликулов и образования желтого тела; угнетении пролиферации эндометрия и развитии в нем атрофических процессов; в спазме капиллярных сосудов миометрия, нарушении кровообращения с последующей гипоплазией матки; в задержке ороговения влагалищного эпителия; атрофии железистой ткани молочных желез и подавлении лактации.
Этиопатогенез и клиника
Ключевую роль в регуляции гонадной дифференцировки, развитии надпочечников и в процессах стероидогенеза играет стероидный фактор 1 (SF-1). В постнатальный период SF-1 продолжает экспрессироваться в тестикулах и в яичниках, регулируя в них процессы стероидогенеза. Генез врожденной надпочечниковой недостаточности может быть связан с мутацией в этом гене.
Врожденная гиперплазия коры надпочечников (ВГКН) – наследственное нарушение, вызванное ферментативными дефектами (чаще 21-гидроксилазы, реже – 11b-гидроксилазы), характеризуется снижением синтеза кортизола. За развитие недостаточности 21-гидроксилазы отвечает только один ген – CYP 21А2. Как следствие дефицита кортизола, повышается секреция АКТГ, накапливаются его предшественники, образующиеся непосредственно перед ферментативным «блоком», которые, в свою очередь, превращаются в ДГЭА и андростендион, а затем путем периферической конверсии – в тестостерон, что вызывает появление симптомов гиперандрогении.
В случае классической тяжелой формы ВГКН (полный «блок» – менее 1% активности 21-гидроксилазы) отмечается выраженная маскулиницация женских гениталий, и диагноз легко ставится при рождении девочки. Частота классической формы ВГКН в мире составляет 1 случай на 14 500 живорождений. В случае неклассической формы (НФ) ВГКН отмечается неполный «блок» – 20-50% ферментативной активности 21-гидроксилазы.
Симптомами НФ ВГКН являются: позднее менархе, гирсутизм и другие признаки ГА, появляющиеся обычно после окончания пубертатного периода или даже в возрасте 20-30 лет, например, нерегулярный менструальный цикл. В 60% случаев эта форма заболевания проявляется у взрослых женщин только с гирсутизмом, в 10% – сочетанием гирсутизма с нарушением менструального цикла и в 10% – только нарушением менструального цикла. Частота бесплодия без лечения достигает 50%. НФ ВГКН выявляется у 1-3% женщин с признаками ГА (5).
Недостаточность 21-гидроксилазы наследуется по аутосомно-рецессивному типу. Ген CYP 21А2 расположен на расстоянии примерно 30000 пар нуклеотидов от функционально неактивного псевдогена CYP 21А2Р, на коротком плече 6-й хромосомы (6 р 21.3), рядом с генами, кодирующими HLA (6). Благодаря высокой гомологии последовательностей генов CYP 21А2 и CYP 21А2Р при рекомбинации возникают 2 типа мутаций: первый неравномерный кроссинговер во время мейоза, приводящий к делеции или удвоению гена CYP 21А2; замена (конверсия) между CYP 21А2 и CYP 21А2Р с переносом инактивирующей мутации с CYP 21А2Р на CYP 21А. Большинство больных с недостаточностью 21-гидроксилазы являются сложными гетерозиготными носителями. Распределение типичных мутаций при тяжелых классических формах ВГКН и при умеренных (неклассических) формах во взаимосвязи с уровнем ферментативной активности 21-гидроксилазы представлены в таблице.
В настоящее время доказано, что при тяжелых классических формах ВГКН при потере менее 1% ферментативной активности 21-гидроксилазы наиболее часто встречается мутация А/С659G; при потере 2-11% – мутация I172N; при умеренных (неклассических) формах ВГКН и потере » 20-50% активности 21-гидроксилазы – мутации Р30L, V281L, Р453S.
У гомозиготных носителей мутации CYP 21А2 развивается сольтеряющая форма врожденной гиперплазии коры надпочечников. На долю полной делеции гена CYP 21А2 и делеции 8 пар нуклеотидов в 3-м экзоне приходится еще 20% больных с сольтеряющей формой. Для выявления этих мутаций используется метод блоттинга по Саузерну (метод гибридизации ДНК на твердой подложке) (7).
Большинство родителей – гетерозиготы и «несут» один нормальный и один мутантный аллель. Приблизительно в 1% случаев мутации возникают de novo, в этом случае гетерозиготным носителем может быть только один из родителей.
Иногда у одного из родителей, который считал себя здоровым, диагностируют НФ ВГКН. Гетерозиготные носители мутации здоровы, у них только несколько повышен уровень 17-гидроксипрогестерона при проведении пробы с АКТГ.
Если оба родителя являются гетерозиготными носителями какого-либо варианта мутации в гене CYP 21А2, то в 25% у них рождается гомозиготный ребенок по дефекту этого гена, в 50% – гетерозиготный носитель и в 25% – здоровый ребенок.
Если у брата или сестры больного ребенка нет признаков заболевания, то в 2/3 случаев он является носителем. Если один из родителей болен, а второй является носителем, то с вероятностью 50% ребенок несет 2 мутантных аллеля и будет болен, а в 50% – будет только носителем.
Если у половой пары, являющейся носителями мутации гена CYP 21, рождается девочка с ВГКН, то вероятность рождения второго больного ребенка составляет 1:8. В случае если один из партнеров страдает классической формой ВГКН, а генетический статус второго партнера в отношении CYP 21 не известен, то риск рождения девочки с врожденной формой АГС составляет 0,4% или 1:250. У матери с НФ ВГКН риск рождения девочки с классической формой ВГКН составляет 0,1% (1:1000) (8).
Диагностика
Имеющиеся к настоящему времени молекулярно-генетические технологии в 95% случаев позволяют выявить наиболее часто встречающиеся мутации гена CYP 21А2, и эти исследования необходимо обязательно включать в обследование больных с ГА. Для пациенток со стертой НФ ВГКН характерен нормальный базальный уровень 17-гидроксипрогестерона, слабо выраженные признаки гирсутизма и относительно невысокое повышение уровня 17-гидроксипрогестерона на фоне пробы с аналогами АКТГ. При уровне 17-гидроксипрогестерона, измеренном в утренние часы и равном 8 нг/мл, диагноз НФ ВГКН не вызывает сомнений.
Уже в течение нескольких десятков лет при высоком риске рождения ребенка с недостаточностью 21-гидроксилазы проводят пренатальную диагностику, а с 1984 г. и лечение этого заболевания. Если у плода подозревают неклассическую форму заболевания, то пренатальное лечение не показано. На смену определению уровня 17-гидроксипрогестерона в околоплодных водах и типированию HLA с последующим анализом сцепления пришло молекулярно-генетическое исследование гена CYP 21А2. Разработан механизм пренатальной диагностики и лечения классической формы ВГКН. Цель пренатального лечения – уменьшить вирилизацию у плодов женского пола и тем самым избежать или уменьшить необходимость проведения феминизирующей пластики наружных половых органов (9).
Дифференциальная диагностика НФ ВГКН с СПКЯ
НФ ВГКН часто характеризуется нарушением менструального цикла и ановуляциией, механизм которой сходен с таковым при СПКЯ. Повышенный уровень андрогенов способствует снижению ГСПС и, таким образом, некоторому повышению уровня биологически активных эстрогенов. Повышение эстрогенов стимулирует тоническое образование ЛГ, выработку андрогенов яичниками и локально подавляет рост фолликулов и овуляцию. Поэтому клиническая картина у женщин с НФ ВГКН может напоминать таковую при СПКЯ и включает постпубертатное появление гирсутизма, олигоменорею или аменорею и др. Но в отличие от СПКЯ у женщин с НФ ВГКН в анамнезе отмечается препубертатное акцелератное повышение роста (между 6 и 8 годами) с последующим замедлением роста, и в конечном счете рост оказывается невысоким. Такая характеристика динамики роста, семейный анамнез постпубертатного проявления гирсутизма, выявление умеренных признаков вирилизации являются индикаторами надпочечниковой ГА.
Дифференциальный диагноз между НФ ВГКН и СПКЯ включает измерение базального уровня (в утренние часы) 17-гидроксипрогестерона в сыворотке. Как уже отмечалось, если его показатели выше 8 нг/мл, можно ставить диагноз НФ ВГКН. Если его уровень выше нормы (от 2,5 до 3,3 нг/мл), но ниже 8 нг/мл, необходимо провести тест с АКТГ. Для этого измеряется базальный уровень 17-гидроксипрогестерона и вводится 0,25 мг синтетического аналога АКТГ в единой дозе. Через 1 час еще раз определяют уровень 17-гидроксипрогестерона, если он выше 10 нг/мл – устанавливается диагноз НФ ВГКН. Однако наиболее объективным тестом является обнаружение мутации в гене CYP 21А2 (7).
Лечение
Лечение ВГНК глюкокортикостероидами впервые было предложено Wikins в начале 50-х годов прошлого века. Наряду с заместительным гормональным эффектом глюкокортикостероиды – мощные противовоспалительные средства, широко используемые при острых и хронических ВЗОМТ. Обладая иммуносупрессивным действием, глюкокортикостероиды нашли широкое применение при привычном невынашивании беременности. Молекулярные механизмы действия глюкокортикостероидов реализуются путем регуляции супрессии ряда генов на транскрипционном и посттранскрипционном уровнях, а также в негеномных эффектах, которые возникают при использовании высоких доз препаратов. В низких концентрациях (> 10-12 ммоль/л) глюкокортикостероиды реализуют свое действие только за счет так называемых геномных эффектов, для развития которых требуется 30 мин. и более. Глюкокортикостероиды подавляют синтез и секрецию АКТГ гипофизом и вторично – глюкокортикостероидов надпочечниками. Оказывают противовоспалительное, противоаллергическое, десенсибилизирующее, противошоковое, иммунодепрессивное действие. Основной целью назначения заместительной терапии глюкокортикоидами (Метипред® таблетки 4 мг) у пациенток с классической формой ВГКН является восполнение недостатка кортизола и альдостерона, избегая передозировки, направленное на снижение уровня надпочечниковых андрогенов, уменьшение вирилизации, обеспечение нормального роста и репродуктивной функции. Метипред® таблетки используются в дозе 5-10 мг в 2 приема. Эффективность лечения контролируют по уровню 17-гидроксипрогестерона, андростендиона и тестостерона в ранние утренние часы, один раз в 3-6 месяцев. Терапия пациенток с классической формой ВГКН заключается в постоянном назначении кортикостероидов для купирования признаков гиперандрогении и восстановления регулярного менструального цикла. Однако больные с неклассической формой недостаточности 21-гидроксилазы не всегда нуждаются в медикаментозном лечении или им требуются меньшие дозы (Метипред® по 4 мг в 2 приема). Показанием для начала терапии является ускорение костного возраста, гирсутизм, нарушение менструального цикла, увеличение яичников и др. (10).
Ведение беременности
В случае наступления беременности у женщин с ГА любого генеза существенно увеличивается риск нарушения имплантации плодного яйца, нарушения кровообращения в матке, склерозирования сосудов миометрия и хориона, разрыва сосудов, образования ретрохориальных гематом, отслойки хориона, развития истмико-цервикальной недостаточности, кроме того, создаются предпосылки для внутриутробной вирилизации плода женского пола. С другой стороны, гестационный период может явиться провоцирующим стрессорным фактором, способствующим проявлению скрытой неполноценности ферментных систем стероидогенеза, в результате чего может развиться НФ ВГКН. В связи с этим нередко возникает необходимость обследования беременных женщин на наличии ГА с целью последующей коррекции имеющихся гормональных и метаболических нарушений и профилактики нарушений со стороны плода.
Следует учитывать, что выбор лабораторных маркеров ГА у беременных должен проводиться с учетом особенностей гормональной секреции в период гестации. В организме беременной метаболизм ДГЭА-С имеет ряд особенностей в связи с наличием фетоплацентарного комплекса, синтезирующего эстрогены. Помимо материнских андрогенов, фетальная зона коры надпочечников плода секретирует ДГЭА-С в количестве, на порядок превышающем его секрецию во взрослом организме, использующийся плацентой для образования эстриола.
Отсутствие корреляционной связи между повышением уровней ДГЭА-С и 17-гидроксипрогестерона не позволяет использовать уровень ДГЭА-С в качестве единственного диагностического критерия ВГКН у беременных, так как он превышает лабораторные показатели для беременных во всех триместрах беременности. При скрининговом обследовании беременных женщин отмечается повышение уровня ДГЭА-С относительно лабораторной нормы, установленной для беременных женщин: уровень ДГЭА обратно коррелирует со сроком гестации, составляя в среднем в I триместре 4,3 мкг/мл, во II – 3,2 мкг/мл, а к III триместру отмечается его снижение примерно в 2 раза от исходного уровня до 2,5 при средней норме 1,3 мкг/мл. Содержание общего Т в сыворотке крови беременных женщин в несколько раз превышает его показатели вне периода гестации: в I триместре – 3,7 нмоль/л, во II – 4,6 нмоль/л и в III – 6,35 нмоль/л.
Во время беременности глюкокортикостероиды показаны при вирилизирующей и сольтеряющей классической форме ВГКН и для профилактики вирилизации у плодов от гетерозиготных матерей с неклассической формой дисфункции.
В случае подтверждения НФ ВГКН при проведении генотипирования и выявления мутации в гене CYP 21 и женском поле плода средняя доза препарата Метипред® составляет 1 мг в сутки до конца беременности. При подтверждении мужского пола плода с помощью УЗИ или биопсии ворсин хориона в 9-11 недель или с помощью амниоцентеза в 15-18 недель прием Метипреда должен быть немедленно прекращен с целью минимизации потенциальных рисков со стороны матери и плода. Подобная тактика ведения беременности, по данным литературы, оправдана в 7 из 8 случаев у беременных с подозрением на НФ ВГКН. В настоящее время рассматриваются возможные риски неоправданного назначения кортикостероидов как по отношению к плоду, так и к матери. Риски по отношению к плоду: ряд врожденных уродств – гипертрофия межсердечной перегородки, гидроцефалия, синдром задержки развития плода, необъяснимая гибель плода (до 2%). В последствии у этих детей наблюдается задержка умственного развития, низкорослость, выраженная лабильность АД. Со стороны матери: развитие синдрома Иценко-Кушинга, гипертензия, гипогликемия, появление отечного синдрома и признаков ятрогенной ГА. Частота развития этих осложнений может достигать 10%.
Массовые обследования новорожденных на недостаточность 21-гидроксилазы позволяют выявить больных с классическими формами заболевания, угрожаемых по развитию синдрома потери соли, и уточнить диагноз у девочек с неправильным строением наружных гениталий. Это обследование в большинстве случаев позволяет выявить НФ ВГКН. В ряде штатов США проводятся обязательные массовые обследования новорожденных на недостаточность 21-гидроксилазы путем определения уровня 17-гидроксипрогестерона. К сожалению, в первые сутки жизни возможны ложноположительные результаты, особенно у маловесных и недоношенных детей, что необходимо учитывать.
Во время беременности для профилактики дистресс-синдрома из числа глюкокортикостероидных препаратов наиболее предпочтителен Метипред®. Этот препарат, быстро проходя через плаценту в биологически активных формах, обладает слабой иммуносупрессивной активностью, лишен минералокортикоидной активности и обладает более продолжительным периодом действия, чем кортизол. Биодоступность несинтетических глюкокортикостероидов плоду вторично снижается вследствие метаболизма в плаценте.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.