Значение лазерной проточной ДНК-цитофлуорометрии при лучевой терапии рака шейки матки
- Аннотация
- Статья
- Ссылки



Введение
Лечение рака шейки матки (РШМ) имеет большое социальное значение. Это обусловлено сохраняющейся тенденцией роста заболеваемости первичным РШМ, высокой частотой рецидивов и неизлеченности, ведущими к летальному исходу даже после специализированного лечения. Несмотря на достигнутые успехи в диагностике РШМ, в настоящее время в России до 40% больных РШМ обращаются за медицинской помощью уже с распространенной III–IV стадией этого заболевания [1, 17]. Одним из основных факторов, с которым связана заболеваемость РШМ, является возраст пациента. Однако в последнее время отмечено увеличение частоты выявления различных форм РШМ у женщин молодого возраста – 15–39 лет, что занимает 1-е ранговое место среди онкозаболеваний (21,9% по данным на 2009 г.). РШМ является основной причиной смерти онкобольных в этой возрастной категории. В возрастной категории 40–54 лет заболеваемость РШМ составляет 9,3%, занимая 2-е место после рака молочной железы [1].
Клиническая практика показывает, что злокачественные опухоли одного и того же морфологического типа, размера и локализации не одинаково реагируют на лучевую терапию у пациентов, что проявляется разной степенью их регрессии – от полного излечения до прогрессирования во время лечения. Очевидно, это зависит от индивидуальной радиочувствительности. В последние годы выявление факторов прогноза неуклонно интегрируется в диагностический процесс, и характеристика опухоли становится неотъемлемой частью клинического диагноза. Среди учитываемых в настоящее время факторов прогноза РШМ наиболее часто используются степень распространения опухолевого процесса, поражение регионарных лимфатических узлов, степень дифференцировки опухоли, а также сопутствующие изменения периферической крови в сочетании с нарушениями функции органов мочевыделительной системы, возраст, продолжительность курса лечения [2–8]. Анализ этих показателей, безусловно, важен для планирования лечения, однако он не всегда дает возможность предсказать течение заболевания с необходимой точностью.
Применение в клинической практике количественных методик стало возможно благодаря внедрению метода лазерной проточной ДНК-цитофлуорометрии. Определяемые с его помощью плоидность клетки опухоли и соотношение клеток в различных фазах клеточного цикла исключают субъективизм исследования и позволяют выявить особенности пролиферации и аномальное содержание ДНК в ядрах клеток при проведении лучевой терапии у больных РШМ [9–12]. Это дает основание полагать, что с помощью метода лазерной проточной ДНК-цитофлуорометрии возможно объективизировать цитологические критерии, провести количественную оценку изменений в клетках опухоли, происходящих в результате лучевой терапии, и получить надежные прогностические количественные показатели. Проведение такого исследования представляется современным и актуальным. Целью настоящего исследования явилось изучение количественных показателей клеток местнораспространенного рака шейки матки на фоне лучевой терапии (плоидность, распределение клеток по фазам клеточного цикла), а также взаимосвязи данных показателей с клиническими факторами прогноза.
Материалы и методы исследования
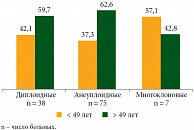
Материалом для настоящего проспективного исследования послужили клинические наблюдения за 121 больной РШМ II, III, IV стадий, которым проводился курс сочетанной лучевой терапии с 2000 по 2008 г. в РОНЦ им. Н.Н. Блохина РАМН. Изучался биопсийный материал шейки матки, который забирался до начала курса лучевой терапии (ЛТ), после 1-го этапа ЛТ на суммарной очаговой дозе (СОД) 50–40 Гр и после окончания всего курса лечения на СОД в точке А 76–80 Гр, в точке В – 60 Гр. Проведенное исследование у 121 больной с местнораспространенным РШМ показало, что диплоидные опухоли выявлены у 38 (31,4%) больных, анеуплоидные опухоли – у 75 (62%), многоклоновые – у 7 (5,8%) и у 1 (0,8%) больной обнаружена гиперанеуплоидная опухоль. В группе диплоидных опухолей средний возраст пациенток составил 50,8 ± 2,1 лет (от 26 до 71 года), среди них 16 (42,1%) больных были моложе 49 лет и 22 (57,9%) – старше 49 лет.
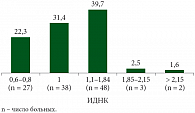
В группе анеуплоидных опухолей средний возраст больных составил 52,1 ± 1,3 лет (от 25 до 74 лет), среди них 28 (37,3%) больных были моложе 49 лет и 47 (62,6%) – старше 49 лет. Средний возраст больных с многоклоновыми опухолями составил 47,4 ± 2,7 лет (от 37 до 58 лет), среди них 4 (57,1%) были моложе 49 лет и 3 (42,8%) старше 49 лет. У 1 больной в возрасте 41 год была выявлена гиперанеуплоидная опухоль. Распределение больных РШМ по возрасту в зависимости от плоидности клеток опухоли представлено на рисунке 1. Отмечено, что у больных старше 49 лет чаще встречались анеуплоидные опухоли. Для характеристики степени анеуплоидии вычисляли индекс ДНК (ИДНК) клеток опухоли. Распределение больных в зависимости от ИДНК опухоли представлено на рисунке 2. По результатам исследования, у 38 больных РШМ выявлены диплоидные опухоли (ИДНК = 1). У 27 (22,3%) больных значение ИДНК при РШМ составило от 0,6 до 0,8, то есть наблюдалась анеуплоидия клеток опухоли с потерей генетического материала. У 48 (39,7%) больных отмечалась анеуплоидия в пределах митотического цикла (ИДНК – 1,1–1,84). Многоклоновые опухоли, имеющие три клона, характеризовались по значению ИДНК, который составил у 2 пациенток в пределах 1,85–2,15, у 1 – более 2,15, а у 4 больных – 1,1–1,84, то есть в пределах митотического цикла. Гиперанеуплоидная опухоль у 1 больной имела ИДНК более 2,15.
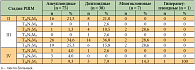
Распределение больных в зависимости от стадии заболевания представлено в таблице 1. В большинстве случаев выявлен плоскоклеточный рак различной степени дифференцировки. В группе анеуплоидного плоскоклеточного рака чаще встречался плоскоклеточный неороговевающий рак – у 14 (18,6%) больных и низкодифференцированная форма рака – у 15 (20,0%) больных. Диагноз «аденокарцинома» установлен у 3 (4,0%) больных. В группе диплоидных опухолей в большинстве наблюдений верифицирован плоскоклеточный ороговевающий рак (у 12 (31,6%) пациенток) и низкодифференцированная форма плоскоклеточного рака (у 8 (21%) пациенток). Аденокарцинома выявлена у 1 (2,6%) пациентки. Многоклоновые опухоли в основном были представлены плоскоклеточным раком без дифференцировки (у 3 (42,8%) пациенток) и плоскоклеточным ороговевающим раком (также у 3 (42,8%) пациенток).
В целом можно отметить, что анеуплоидные опухоли представлены прогностически более неблагоприятными по сравнению с диплоидными и многоклоновыми опухолями формами плоскоклеточного рака – плоскоклеточным неороговевающим (18,6%) и низкодифференцированной формой рака (20%), а также аденокарциномой (4,0%). Для оценки прогностически значимых признаков РШМ с учетом данных, в соответствии с плоидностью и пролиферативной активностью клеток, каждый тип ДНК-гистограмм делили на подтипы, представленные в таблице 2 [10]. При анализе полученных данных установлено, что диплоидные опухоли характеризовались низкими темпами деления клеток, что подтверждается низкими значениями числа клеток в фазе клеточного цикла G0/1. Число клеток в фазе G0/1 составило более 80% в 94,8 ± 8,1% случаев, в S-фазе < 7% – в 78,9 ± 6,6% случаев, в фазе G2 + M < 10% – в 97,4 ± 2,6% опухолей. Индекс пролиферации (ИП) < 15% наблюдался в 92,1 ± 4,4% случаев новообразований.
Анеуплоидные опухоли характеризовались более высокой пролиферативной активностью по сравнению с диплоидными. Число клеток в фазе G0/1 было в большинстве случаев в пределах 80–90% (в 61,3 ± 5,6% случаев) и более 90% – в 22,7 ± 4,8% случаев, а менее 80% – в 16,0 ± 4,2%. Количество клеток в S-фазе < 7% наблюдалось в 52 ± 5,8% случаев, а число клеток в S-фазе в пределах от 7 до 14% было в 44 ± 5,7% опухолей, число клеток в S-фазе ≥ 14% – в 4,0 ± 2,3% новообразований. Количество клеток в фазе G2 + M в 82,6 ± 4,4% случаев было менее 10%, а в 17,3 ± 4,4% случаев – более 10%.
Индекс пролиферации клеток опухоли в большинстве случаев (61,3 ± 5,6%) составил менее 15%, в 22,6 ± 4,8% опухолей он был в пределах от 15 до 20% и более 20% – в 16,0 ± 4,2% новообразований. Количество анеуплоидных клеток в опухоли в 69,3 ± 5,3% случаев было более 40%, а в 24,0 ± 4,9% новообразований – в пределах от 20 до 40% и в 14,6 ± 4,1% случаев – менее 20%, что свидетельствует о гетерогенности клеточного состава опухоли. Гиперанеуплоидная опухоль (1 случай) характеризовалась высокой пролиферативной активностью в пределах 15–20% при динамическом наблюдении на фоне курса лучевой терапии, а также высокими показателями числа клеток в S-фазе в пределах от 7 до 14%. При дальнейшем наблюдении за больной выявлено быстрое прогрессирование заболевания за счет отдаленного метастазирования РШМ. Группа с многоклоновыми опухолями была немногочисленна (n = 7), в результате исследования в ряде новообразований выявлено 3 клона клеток опухоли, для статистического анализа использовались параметры клеточного цикла популяции с наибольшим значением ИДНК. В целом распределение количества клеток в фазах клеточного цикла многоклоновой опухоли мало отличалось от показателей диплоидных опухолей. Значения G0/1 более 80% выявлены у 85,5 ± 14,3% (n = 6) больных. Количество клеток S-фазы < 7% установлено у 57,1 ± 20,2% (n = 4) пациенток, большее количество случаев составило значение S в пределах от 7 до 14% – в 42,8 ± 20,2% (n = 3) случаев. Число клеток в фазе G2 + M менее 10% выявлено у 85,7 ± 14,3% (n = 6) больных. Индекс пролиферации в большинстве случаев был менее 15% – в 71,4% (n = 5). Количество анеуплоидных клеток в опухоли составило более 40% в 57,1 ± 20,2% случаев РШМ (n = 4), в 28,5 ± 18,4% (n = 2) опухолей значение этого показателя было в интервале 20–40%, в 14,3 ± 14,3% опухолей (n = 1) – менее 20%.
Результаты исследования
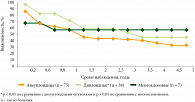
Полученные методом лазерной проточной цитофлуорометрии данные можно использовать в качестве отдельных дополнительных прогностических критериев течения РШМ. Точность прогноза важна для выбора тактики ведения больных. Анализ общей и безрецидивной выживаемости у больных РШМ в зависимости от плоидности клеток опухоли без учета стадии заболевания подтвердил: диплоидные опухоли имеют более доброкачественное течение по сравнению с анеуплоидными, что подтверждено результатами выживаемости (рис. 3 и 4). Так, общая 5-летняя выживаемость у пациенток с диплоидными опухолями была выше (68,4 ± 9,6%) по сравнению с больными с анеуплоидными опухолями (45,4 ± 8,4%), р < 0,05, а в группе с многоклоновыми опухолями статистически значимо не отличалась – 66,7 ± 19,2% (р = 0,6). Аналогичная тенденция прослежена при изучении результатов безрецидивной выживаемости у больных РШМ: в группе диплоидных опухолей к пятилетнему сроку наблюдения результаты оказались выше (45,1 ± 11,0%), чем в группе анеуплоидных опухолей (32,7 ± 7,2%), р < 0,05. В группе с многоклоновыми опухолями показатели безрецидивной выживаемости статистически значимо не отличались (р = 0,3) от первых двух групп, безрицидивная выживаемость в течение пяти лет составила 57,1 ± 18,7%. Медиана выживаемости в группе анеуплоидных опухолей составила 14,1 мес., в группе диплоидных – 39,7 мес., в группе многоклоновых опухолей – 51,9 мес.
При анализе результатов выживаемости у больных РШМ в зависимости от возраста выявлено, что в группе анеуплоидных опухолей выживаемость зависела от возрастной категории больных (табл. 3 и 4). При анализе результатов выживаемости у больных РШМ в зависимости от возраста выявлено, что в группе анеуплоидных опухолей как общая, так и безрецидивная выживаемость пациенток младше 49 лет составила в течение пяти лет 43,4 ± 8,4% и 32,7 ± 7,2% соответственно, что хуже по сравнению с данными по старшей возрастной категории (> 49 лет): 68,4 ± 9,6% и 45,1 ± 11,0% (р < 0,05) соответственно. В группе диплоидных опухолей статистически значимых результатов выживаемости по возрастным категориям не получено. Группа с многоклоновыми опухолями с учетом возраста не анализировалась из-за ее малочисленности (n = 7). Отмечено, что при анеуплоидном РШМ частота рецидивов у больных выше, чем при диплоидном раке: 24,0% по сравнению с 2,6% (р < 0,05) соответственно. В группе с многоклоновыми опухолями рецидивы не выявлены. Частота выявления отдаленных метастазов практически одинакова в группах с диплоидными и анеуплоидными опухолями – 28,9% и 25,3% соответственно. В группе с многоклоновым РШМ отдаленные метастазы выявлены в 71,4% случаев. Наличие одновременно рецидива и метастазов при диплоидном РШМ выявлено у 5,3% пациенток, а при анеуплоидном – 8%. Анализ результатов выживаемости в зависимости от показателей ИДНК оказался хуже (р < 0,05) только по результатам общей выживаемости. При значениях ИДНК в пределах 0,6–0,8, то есть при анеуплоидии с потерей генетического материала, результаты общей выживаемости в течение пяти лет составили 37,8 ± 10,7% по сравнению с 47,3 ± 15,3% в группе больных с ИДНК в пределах 1,1–1,84. Результаты безрецидивной выживаемости в этих категориях оказались статистически не значимы.
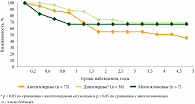
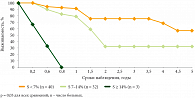
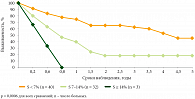
Отмечено, что при увеличении стадии РШМ у пациенток с анеуплоидными опухолями (n = 75) увеличивалась и доля клеток опухоли, находящихся в S-фазе клеточного цикла: так, при II стадии РШМ число клеток в S-фазе в большинстве случаев было от 7 до 16%, тогда как при III стадии S < 7% выявлено у 30,6% больных, в пределах от 7 до 14% – у 28% и ≥ 14% – у 2,6%. Похожая тенденция выявлена и при диплоидных опухолях. В группе анеуплоидных опухолей у больных старше 49 лет наибольшее число клеток в S-фазе клеточного цикла было выше и составило от 7 до 36%, в пределах от 7 до 14% – у 24%, а ≥ 14% – у 2,6% больных по сравнению с пациентками в возрастной категории до 49 лет, у которых оно составило 17,3%, 18,6% и 1,3% соответственно. Отмечено, что при увеличении количества клеток опухоли в S-фазе до начала курса лучевой терапии результаты выживаемости больных РШМ ухудшаются (рис. 5 и 6). Так, при числе клеток опухоли в S-фазе < 7% общая и безрецидивная выживаемость в течение пяти лет была наиболее высокой и составила 57,2 ± 13,1% и 45,6 ± 11,3%, а при S от 7 до 14% – 32,3 ± 10,3% и 18,2 ± 8,5% (р = 0,03 и р = 0,0006) соответственно. При значениях S ≥ 14% все больные умерли в течение первого года наблюдения от прогрессирования заболевания. Возраст больных в данном случае не показал статистически значимых различий в результатах выживаемости. Cроки прогрессирования РШМ после проведенного курса лучевой терапии зависели от исходного количества клеток в S-фазе. Чем выше исходное число клеток в S-фазе, тем лучше ответ опухоли на лучевую терапию, что характеризовалось уменьшением их количества в опухоли после проведенного курса лучевой терапии.
При исходных значениях количества клеток опухоли в S-фазе до 7% поведение опухолевого процесса было менее агрессивным, прогрессирование отмечалось в среднем через 34,1 ± 7,4 мес. после окончания курса ЛТ, при значениях исходного количества клеток опухоли в S-фазе в пределах от 7 до 14% прогрессирование выявлялось через 10,8 ± 4,5 мес., а при S ≥ 14% – через 7,0 ± 2,0 мес. Аналогично в группе диплоидных опухолей безрецидивная выживаемость выше (р = 0,002) при низком содержании числа клеток в S-фазе: пять лет живы 74,7 ± 10,1% больных. При содержании клеток в S-фазе 7% и более все больные умерли в течение трех лет от прогрессирования заболевания. Поведение злокачественной опухоли связано не только с морфологическими характеристиками клеток, но и с их пролиферативной активностью и плоидностью. Оценка этих двух критериев вместе делает прогноз еще более достоверным. Отмечено, что при увеличении стадии РШМ увеличивалась и пролиферативная активность опухоли среди анеуплоидных опухолей, что характеризует агрессивность течения заболевания. Безрецидивная выживаемость оказалась статистически значимо хуже с увеличением исходных показателей ИП (р = 0,01). При значениях ИП менее 15% в течение пяти лет живы 40,9 ± 9,8% пациенток; при ИП от 15 до 20% – 29,2 ± 14,5% соответственно. При ИП более 20% в течение года прожили только 25,0 ± 12,5% больных.
У женщин до 49 лет показатели выживаемости при ИП 15–20% оказались хуже: все пациентки умерли до истечения трехлетнего срока наблюдения, тогда как общая и безрецидивная пятилетняя выживаемость у больных старше 49 лет составила 58,9 ± 16,2% и 38,9 ± 18,5% соответственно (р = 0,01). При ИП клеток более 20% все пациентки умерли от прогрессирования заболевания независимо от возрастной категории в течение 5 лет. В процессе лучевой терапии регрессия опухоли сопровождалась снижением уровня пролиферативной активности, причем чем выше был индекс пролиферации, тем большее его снижение наблюдалось в процессе облучения у большинства больных. Этот факт известен из литературных данных: опухоли с высокой пролиферативной активностью лучше отвечают на лучевое лечение [13–16]. Анализ отдаленных результатов показал, что исходно высокие значения ИП (более 20%) до начала лечения приводят к быстрому прогрессированию РШМ (через 11,4 ± 4,6 мес.) по сравнению с ИП < 15% (20,8 ± 5,7 мес.) и ИП 15–20% (17,9 ± 7,1 мес.) (p < 0,05). В 92,1% случаев показатели ИП в группе больных с диплоидными опухолями оказались менее 15% и, следовательно, выживаемость больных сопоставима с результатами выживаемости всей группы. Важным прогностическим фактором РШМ является дифференцировка клеток опухоли при наиболее часто встречающемся плоскоклеточном раке. Выявлено, что в группе анеуплоидных опухолей с вероятностью 98% (t = 1,8; р = 0,08) понижение степени дифференцировки опухоли приводит к быстрому прогрессированию. Так, при плоскоклеточном ороговевающем раке прогрессирование в среднем наступало через 29,5 ± 8,1 мес. после окончания курса лучевой терапии, при умереннодифференцированном – через 17,2 ± 5,9 мес., при низкодифференцированном – через 16,6 ± 4,5 мес., а при неороговевающем – через 13,2 ± 4,2 мес.
Индекс пролиферации (ИП) клеток опухоли при умеренной дифференцировке составил 12,3 ± 1,4%, низкой степени – 14,4 ± 1,3%, что коррелирует с агрессивным поведением опухоли. В группе диплоидных опухолей выявлена статистически значимая (t = 2,7; р = 0,05) зависимость прогрессирования РШМ от степени дифференцировки клеток плоскоклеточного рака. Средние сроки прогрессирования при плоскоклеточном ороговевающем раке составили 25,9 ± 5,6 мес., при умереннодифференцированном – 22,2 ± 8,9 мес., при низкодифференцированном – 15,9 ± 3,2 мес., а при неороговевающем – 7,8 ± 1,4 мес. В ходе многофакторного регрессионного анализа выявлено, что на агрессивное поведение опухолевого процесса при РШМ III и IV стадий у женщин в возрастной категории до 49 лет статистически значимо оказывают влияние такие морфологические признаки, как низкодифференцированная форма плоскоклеточного рака, высокая пролиферативная активность опухоли (при ИП 15–20%), а также значение ИДНК в пределах 1,1–1,84 и более. У пациенток старше 49 лет с РШМ III и IV стадий наиболее прогностически значимыми факторами являются ИП более 20% и ИДНК 0,6–0,8. Такие независимые факторы прогноза, как плоидность и количество клеток опухоли в S-фазе клеточного цикла, следует рассматривать как прогностические у больных при II стадии РШМ.
Заключение
Применение лазерной проточной ДНК-цитофлуорометрии целесообразно в качестве дополнительного метода для определения прогностических количественных показателей при раке шейки матки, особенно таких, как плоидность, индекс пролиферации с одновременной оценкой пропорции клеток в G1/0, S, G2 + M фазах клеточного цикла. У больных раком шейки матки при III–IV стадии в возрастной категории до 49 лет основными прогностическими факторами являются: низкодифференцированный плоскоклеточный рак, высокая пролиферативная активность опухоли (при ИП от 15 до 20%), ИДНК в пределах 1,1–1,84 и более. У пациенток старше 49 лет – пролиферативная активность более 20% и ИДНК 0,6–0,8. У данной категории пациенток целесообразно проведение химиолучевой терапии. Такие независимые факторы прогноза, как плоидность и количество клеток в S-фазе клеточного цикла, следует рассматривать как независимые прогностические критерии у больных при II стадии рака шейки матки.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.