Значение жировой ткани в формировании гормонального статуса у женщин
- Аннотация
- Статья
- Ссылки

Ключевой вазоактивной субстанцией, продуцируемой фибробластами жировой ткани, является лептин – важный регулятор потребления пищи. Благодаря лептину происходит «диалог» между жировой тканью и гипоталамусом.
Характер распределения жира у женщин в основном определяется гормонами половых желез и коры надпочечников, важную роль играет конверсия андрогенов в эстрогены в жировой ткани.
Для репродуктивной системы женщины существуют три основных периода «испытаний», которые характеризуются тремя «М»:
- менархе;
- менструации;
- менопауза.
Также важными испытаниями являются беременность и роды. Именно в эти периоды важно оптимальное физиологическое взаимодействие между жировой тканью и половыми гормонами.
В период полового созревания триггером менархе и установления циклической функциигипоталамо-гипофизарно-яичниковой системы является «критическая» масса тела, которая составляет 46-47 кг. При ожирении возраст менархе чаще снижается до 9-11 лет. При дефиците массы тела происходит задержка полового развития, сопровождающаяся поздним менархе или первичной аменореей.
В пубертатном периоде повышается чувствительность к лептину. Низкий уровень лептина – это сигнал о недостаточности жира для роста и развития, что ведет к повышению аппетита и снижению сигнала насыщения. Установлено, что повышение массы тела на 10% ведет к возрастанию уровня лептина на 300%. Снижение массы тела на 10% может вести к снижению уровня лептина на 53%.
Под влиянием женских половых гормонов формируется типично женский фенотип с преобладающей локализацией жировой ткани в бедренно-ягодичной области. Жировая ткань в области бедер и ягодиц регулируется главным образом ферментом липопротеинлипазой, здесь в основном идут процессы липогенеза, активность липолиза низкая, в связи с чем гиноидное ожирение не влияет на метаболическое здоровье и сказывается лишь на внешнем облике женщины. Жировая ткань бедренно-ягодичной области обеспечивает питание плода у беременной матери при значительной потере массы тела, возникающей в силу различных причин, а также обеспечивает лактацию.
Установлено, что наряду с синтезом гормонов в яичниках жировая ткань является местом экстрагонадного синтеза половых гормонов из андрогенов. Следовательно, уровень половых стероидов в крови определяет характер распределения жировой ткани, поскольку и в ней происходит накопление, их интенсивная ароматизация и секреция.
Ароматаза – ключевой фермент, участвующий в гонадном и экстрагонадном синтезе эстрогенов и катализирует ароматизацию андрогенов в эстрогены. Это цитохром Р450 – продукт экспрессии CYP19. Ген Р450-аро находится на хромосоме 15q21.
Установлено, что в жировой ткани экспрессируются эстрогеновые β-рецепторы. Один из основных механизмов влияния половых гормонов на жировую ткань – прямая регуляция активности липопротеинлипазы – главного фермента регуляции накопления триглицеридов в адипоцитах. У женщин репродуктивного возраста она стимулируется эстрогенами в жировой ткани бедер и ягодиц, где активность указанного фермента выше, чем в подкожном жире абдоминальной области. В результате идет накопление липидов для обеспечения адекватных запасов энергии в период беременности и лактации. После менопаузы активность липопротеинлипазы снижается, и адипоциты бедренно-ягодичной области уменьшаются в размерах, то есть происходит относительное перераспределение жира.
Прогестерон также участвует в регуляции функций жировой ткани. Он конкурирует с глюкокортикоидами за их рецепторы на адипоцитах, предотвращая таким образом воздействие глюкокортикоидов на жировую ткань в поздней лютеиновой фазе цикла. Установлено, что нейропептид Y может изменять секрецию гонадолиберина, благодаря чему возможна взаимосвязь между аппетитом и репродуктивной функцией женщины.
Аппетит и пищевое поведение у женщин отчасти регулируются половыми гормонами. В клинических исследованиях и в экспериментах на животных доказано, что от состояния системы гипоталамус – гипофиз – яичники зависит количество и частота употребляемой пищи у животных. Например, если у самцов крыс режим питания и масса тела стабильны, то у самок они значительно изменяются в течение овариального цикла, а после овариоэктомии возникает гиперфагия и как следствие масса тела увеличивается за счет ожирения в среднем на 25% за 3-5 недель. Причем введение эстрадиола в цикличном режиме кастрированным самкам крыс восстанавливает ритм и количество поглощаемой пищи, а прогестерон не оказывает влияния на характер питания.
В клинических исследованиях показано, что у женщин с регулярным менструальным циклом аппетит зависит от уровня эстрадиола в крови. В частности, в периовуляторном периоде общее количество употребляемой пищи резко уменьшается, а в лютеиновой фазе аппетит повышается.
Специфической области в головном мозге, где эстрадиол оказывает подавляющее влияние на аппетит не обнаружено. Предполагают, что это осуществляется по механизму обратной связи (как и при взаимодействии с лютеинизирующим гормоном) с одновременным влиянием на несколько областей головного мозга. На основании факта подавления аппетита у животных после имплантации эстрадиола в гипоталамус предполагают, что эстрадиол реализует свое действие в вентромедиальной области гипоталамуса, подавляя аппетит.
Как известно, вкус продуктов влияет на количество потребляемой пищи, например, сладости стимулируют аппетит. Экспериментально установлено, что скорость поедания сахарозы выше у крыс после овариоэктомии по сравнению с животными с сохраненными яичниками, а введение эстрадиола кастрированным крысам уменьшает скорость приема сладкого раствора.
Данных о повышении частоты гиперфагии у женщин после менопаузы (как естественной, так и вследствие овариоэктомии) в литературе не опубликовано, а приведенные выше результаты экспериментов на животных позволяют лишь предполагать аналогичное воздействие эстрогенов на аппетит у человека.
Эстрогены могут влиять на жировую ткань, взаимодействуя с лептином. Результаты экспериментов на грызунах и исследований тканей человека показали, что в яичниках экспрессируются рецепторы к лептину, а эстрадиол регулирует продукцию лептина адипоцитами по механизму положительной обратной связи. Примечательно, что у женщин с ожирением (как в пре-, так и в постменопаузе) уровни лептина выше, чем у мужчин с такой же степенью ожирения. Установлено, что концентрации лептина увеличиваются в лютеиновой фазе менструального цикла.
Воздействие эстрогенов на симпатическую нервную систему подтверждается подавлением ими тирозингидроксилазы – фермента, участвующего в синтезе катехоламинов. Кроме того, эстрогены увеличивают плотность и функцию α2-адренорецепторов, расположенных на адипоцитах. В экспериментах на животных и в клинических исследованиях продемонстрирована выраженная взаимосвязь колебаний уровня половых гормонов в различные фазы менструального цикла с суточным расходом энергии и калорийностью потребляемой пищи. Так, у женщин репродуктивного возраста в лютеиновой фазе менструального цикла на фоне высоких концентраций прогестерона и относительно низких эстрадиола увеличиваются расход энергии, масса тела и общее количество потребляемой пищи и жиров.
Уровни тестостерона в крови напрямую связаны с массой абдоминального жира.
После менопаузы скорость метаболизма в покое замедляется, что подтверждается результатами исследования E.T. Poehlman и соавт., которые при динамическом наблюдении зафиксировали постоянную скорость метаболизма в покое у здоровых женщин в возрасте до 48 лет и значительное замедление обменных процессов (на 4-5% в каждое десятилетие жизни) в более старшем возрасте. Установлено, что степень снижения скорости метаболизма в покое после менопаузы соответствует накоплению энергии 60000-80000 кДж в год, что эквивалентно увеличению массы тела на 3-4 кг. При длительном наблюдении за женщинами одинакового возраста показано, что в постменопаузе скорость метаболизма в покое снижается примерно на 420 кДж/день, а при сохраненной функции яичников подобный эффект отсутствует. Из-за метаболических последствий длительного периода нарушения регуляции баланса энергии не только растет масса жировой, но и сокращается масса мышечной ткани. В частности с помощью рентгеновской денситометрии установлено, что масса нежировых тканей после менопаузы уменьшается примерно на 3 кг.
У женщин с возрастом отмечается прогрессивное снижение уровней многих гормонов: прогестерона, эстрогенов, дегидроэпиандростерона, а также гормона роста, что способствует изменениям композиционного состава тела, а также увеличению веса. Быстрая прибавка массы тела в перименопаузе отмечается примерно у 60% женщин. По данным исследования здоровых женщин (Healthy Women’s Study), в первые три года после менопаузы масса тела в среднем увеличивается на 2,3 кг (у 20% женщин – на 4,5 кг и более), а через восемь лет – на 5,5 кг.
Рассматривается несколько возможных патогенетических механизмов увеличения массы тела у женщин после менопаузы. Установлено, что на фоне снижения секреции гормонов яичников растет общее количество жира и происходит его перераспределение в область передней брюшной стенки, а масса мышечной и костной ткани уменьшается. В нескольких исследованиях показано, что изменения составляющих массы тела после менопаузы: потеря костной плотности, уменьшение мышечной и увеличение жировой массы — происходят независимо от изменений общей массы тела. С помощью денситометрии продемонстрировано, что у пациенток в пери- и постменопаузе общее количество жира (особенно на туловище) на 8-9 % больше, а жировой и мышечной массы на бедрах меньше, чем у женщин с сохраненной функцией яичников. Причем у женщин репродуктивного возраста, получавших агонисты гонадотропин-рилизинг-гормона, создающих медикаментозную, временную менопаузу, отмечены такие же изменения, как и после естественной менопаузы: повышение количества жира на фоне снижения костной и мышечной массы.
С увеличением возраста отмечается повышение способности внегонадных тканей синтезировать эстрогены. Анализ экспрессии генов показал, что количество транскриптов, кодирующих ароматазы, было больше в ягодичной области, чем в абдоминальной независимо от пре- или постменопаузы. Назначение ЗГТ не влияло на экспрессию гена ароматазы ни в одном из регионов тела. Контролируют эту экспрессию глюкокортикоиды, ИЛ-6 и факторы роста.
По-видимому, активацию ароматазы в жировой ткани в постменопаузе можно рассматривать как своеобразную компенсаторную реакцию организма женщины в ответ на закономерное возрастное снижение и выключение функции яичников. Это способствует более плавной биологической трансформации женского организма, кроме того это своеобразная защита от развития остеопороза, старческого слабоумия и болезни Альцгеймера. Установлено, что низкий ИМТ (<19 кг/м2) является фактором риска постменопаузального остеопороза и болезни Альцгеймера.
Однако повышенный синтез эстрогенов в жировой ткани может явиться фактором риска развития рака в репродуктивных органах, хотя данные последних лет, отражающие пути метаболизма эстрогенов, указывают на более важную роль не столько уровня эстрогенов, сколько путей метаболизма их посредством образования 2-гидроксиэстрона (2-ОН Е1) или 16α-гидроксиэстрона (16α-ОН Е1). Установлена связь между уровнем 16α-ОН Е1 и риском развития опухолей в эстрогенозависимых тканях. Однако при повышении уровня 2-ОН Е1 наблюдалась тенденция к гибели опухолевых клеток и снижению риска их образования.
Дефицит прогестерона в пери- и постменопаузе отчасти объясняет замедление метаболизма после менопаузы. В постменопаузе снижаются уровни глобулина, связывающего половые гормоны (ГСПС), что приводит к росту концентрации свободного тестостерона, относительной гиперандрогении и вносит определенный вклад в формирование абдоминального ожирения. E.T. Poehlman и соавт. зафиксировали связь уровней ИПФР-I, массы тела и соотношения массы различных тканей у женщин после менопаузы. Секреция гормона роста с возрастом снижается, чем, в частности объясняют увеличение общей массы тела и жировой ткани у женщин в постменопаузе. Заместительная терапия гормоном роста уменьшает общую массу тела и количество жировой ткани. Представляют интерес выводы B.W. Hartmann и соавт. о том, что прибавка массы тела в течение первого месяца терапии на фоне приема перорального 17β-эстрадиола происходит лишь у женщин со значительным снижением секреции гормона роста и небольшим повышением уровней ИПФР-I.
После менопаузы уровни β-эндорфина снижаются, а заместительная терапия эстрогенами повышает их. Предполагают, что в постменопаузе также происходит усиление глюкокортикоидной стимуляции, что ведет к увеличению размеров адипоцитов и формированию абдоминального ожирения. Уровни норадреналина в крови в постменопаузе повышены, и более выражено стрессиндуцированное увеличение его концентраций по сравнению с показателями у пациенток репродуктивного возраста. После шестинедельного лечения эстрадиолом эти эффекты значительно ослабляются.
Следовательно, половые гормоны и их дефицит взаимосвязаны с жировой тканью и синтезируемыми ею биологически активными веществами прямо и опосредованно через изменение активности ферментов (липопротеинлипазы, ароматазы и др.), цитокинов, норадреналина как на местном, так и на гипоталамическом уровне за счет изменения секреции пептидов, регулирующих аппетит (β-эндорфина, нейропептида-Y, ПОМК и др.).
Воздействие половых гормонов на жировую ткань проявляется в особенностях распределения жира в различные периоды жизни женщины. Как уже отмечалось, для репродуктивного возраста в области бедер и ягодиц характерны более высокая активность липопротеинлипазы, низкая активность липолиза и гиноидное распределение жира. На фоне дефицита половых гормонов липопротеинлипаза не стимулируется, и адипоциты жировой ткани бедренно-ягодичной области уже не служат источником запасов энергии в организме. Однако в подкожной абдоминальной и особенно висцеральной жировой ткани идет интенсивный липолиз.
Как потеря массы тела, так и значительная ее прибавка в равной степени могут вести к нарушению функции репродуктивной системы женщины. Клинически это может проявляться нарушением менструального цикла – от редких менструаций до аменореи. При избыточной массе тела могут также наблюдаться ациклические маточные кровотечения, ановуляция и бесплодие. При ожирении и беременности могут наблюдаться невынашивание беременности, гестационный диабет, преэклампсия, родовые травмы, тромбофилии.
Для характеристики массы тела наибольшее распространение в настоящее время получил индекс массы тела (ИМТ) – это отношение массы тела в кг к квадрату роста, выраженного в метрах. В таблице 1 представлена международная классификация массы тела.
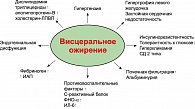
Различают избыточное отложение жира в области бедер и ягодиц, или гиноидное, характерное для женщин, а также избыточное накопление жира в области туловища и особенно живота или висцеральное (абдоминальное) ожирение
В настоящее время на нашей планете отмечается пандемия ожирения. В России 30-40% женщин и 10-20% мужчин болеют ожирением (С.А. Бутрова). Каждый 10-й ребенок в мире страдает ожирением.
К пренатальным факторам риска ожирения относятся:
- со стороны матери:
- ожирение,
- значительная прибавка массы тела при беременности,
- курение,
- диабет;
- со стороны плода:
- большой вес при рождении,
- низкий вес при рождении,
- искусственное вскармливание.
Считаем необходимым остановиться на характеристике метаболического синдрома, с которым нередко сталкиваются акушеры-гинекологи при обращении по поводу бесплодия, нарушений менструального цикла.
Метаболический синдром (МС) – это совокупность метаболических нарушений, основными из которых являются:
- абдоминальное ожирение,
- инсулинорезистентность и дислипидемия.
Другие метаболические проявления, которые могут наблюдаться при метаболическом синдроме, – это микроальбуминурия и нарушения в системе фибринолиза и коагуляции.
В 2005 году Всемирная федерация диабета предложила новое определение метаболического синдрома.
Центральное ожирение: окружность талии (ОТ) >= 94 см у мужчин и >= 80 см у женщин в сочетании как минимум с 2 из следующих нарушений:
- повышенные уровни триглицеридов: >= 1,7 ммоль/л (150 мг/дл);
- пониженные уровни ХС-ЛПВП: < 1,04 ммоль/л (40 мг/дл) – у мужчин, < 1,29 ммоль/л (50 мг/дл) – у женщин;
- повышенное АД: >= 130/85 мм рт. ст.;
- гипергликемия натощак: > 5,6 ммоль/л (100 мг/дл) или ранее диагностированный сахарный диабет 2 типа;
- установленный ранее сахарный диабет 2 типа или нарушение толерантности к глюкозе.
Абдоминальное (висцеральное) ожирение – основной клинический симптом метаболического синдрома, которое является важным фактором риска сердечно-сосудистых и других заболеваний (рисунок 1).
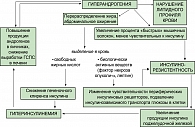
До настоящего времени не прекращается дискуссия о первичности или вторичности инсулинорезистентности и гиперандрогении при метаболическом синдроме (рисунок 2).
Полагают, что повышение уровней провоспалительных цитокинов (ФНО-α, ИЛ-6) в жировой ткани может вести к дисфункции эндотелия, оксидативному стрессу, способствуя атеросклеротическим изменениям и развитию инсулинорезистентности. Единственным защитным фактором является адипонектин – антиатерогенный фактор, синтезируемый адипоцитами. Он оказывает следующие эффекты:
- уменьшает инсулинорезистентность;
- снижает поступление жирных кислот в печень;
- способствует снижению продукции глюкозы печенью и синтеза триглицеридов ЛПОНП;
- в мышечной ткани улучшает чувствительность к инсулину;
- тормозит адгезию моноцитов и тромбоцитов к эндотелию.
Защитные антиатерогенные механизмы адипонектина утрачиваются при ожирении, особенно при абдоминально-висцеральном. Низкий уровень адипонектина в плазме крови предшествует инсулинорезистентности.
В последние годы принято выделять также менопаузальный метаболический синдром (ММС), который развивается на фоне возрастного снижения и выключения функции яичников. Критерии диагностики его соответствуют вышеизложенным критериям метаболического синдрома, однако важную роль играют данные анамнеза: значительная прибавка массы тела (5-10 кг) за короткий период времени (6-12 месяцев) в период постменопаузы.
Терапевтические подходы к лечению метаболического синдрома
Существует два основных метода терапии ожирения:
- немедикаментозный и медикаментозный.
Немедикаментозный подход к лечению ожирения.
Для эффективного лечения метаболического синдрома и ожирения необходимо:
- формирование и поддержание внутренней мотивации пациентки к снижению массы тела;
- постоянный контакт с пациенткой с постановкой и согласованием промежуточных целей лечения и контролем за их достижением.
Пациентка должна усвоить следующее:
- избыточная масса тела и ожирение требуют пожизненного и многопланового внимания;
- масса тела регулируется сложными биологическими механизмами и влияниями внешней среды. Избыток массы тела не является следствием отсутствия воли;
- даже умеренное снижение массы тела приводит к улучшению общего состояния;
- ненаучный подход мешает лечебному процессу;
- важно постепенное и стойкое снижение массы тела (около 8-10% в год) и формирование условий, способствующих поддержанию достигнутого результата.
Итак, немедикаментозное лечение включает: обучение больных, рациональное гипо- и эукалорийное питание, повышение физической активности, изменение образа жизни.
Существует также оперативное лечение.
Медикаментозный подход к лечению ожирения включает назначение:
- селективного ингибитора обратного захвата серотонина и норадреналина – сибутрамин (Меридиа);
- препарат периферического воздействия – орлистат (Ксеникал).
Эффективность терапии сибутрамином (Меридиа)
При метаболическом синдроме эффективным средством является назначение сибутрамина (Меридиа). Механизм действия сибутрамина заключается в избирательном ингибировании обратного захвата нейромедиаторов серотонина и норадреналина в синапсах нейронов центральной нервной системы, результатом которого являются более быстрое возникновение и пролонгирование чувства насыщения и как следствие уменьшение объема потребляемой пищи. Помимо усиления чувства насыщения Меридиа повышает расход энергии, стимулируя термогенез. Этот эффект обусловлен стимуляцией β3-адренорецепторов жировой ткани, ответственных за липолиз. Таким образом, Меридиа способствует восстановлению баланса энергии, уменьшая потребление пищи и увеличивая расход энергии.
Начальная доза Меридиа составляет 10 мг/сут. – одна капсула 1 раз в сутки в первой половине дня независимо от приема пищи. Меридиа в дозе 15 мг/сут. применяется в том случае, если в течение первого месяца лечения снижение веса составило менее 2 кг и у больных с сахарным диабетом 2 типа.
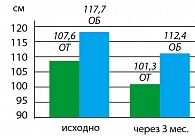
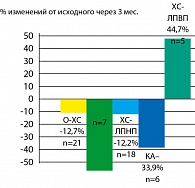
Опыт применения сибутрамина у молодых женщин с метаболическим синдромом и в постменопаузе в клинике гинекологической эндокринологии Научного центра акушерства, гинекологии и перинатологии Росмедтехнологий представлен на рисунках (Г.Е. Чернуха, И.Г. Шестакова – рисунки 3, 4, 5, 6).
Следует отметить, что наряду со снижением массы тела и нормализацией липидного спектра крови наблюдалось восстановление регулярных менструальных циклов у подавляющего большинства женщин (93,8%), овуляция отмечена в 36,7% случаев.
В ходе исследования отмечена хорошая переносимость препарата. Значительных изменений систолического и диастолического АД, а также частоты пульса на фоне приема Меридиа в дозах 10 и 15 мг нами не отмечено. Побочные эффекты (сухость во рту, запоры, тошнота), выявленные у 4% больных в течение первых 4 недель лечения, расценивались пациентками как умеренно выраженные и ни в одном случае не потребовали отмены препарата.
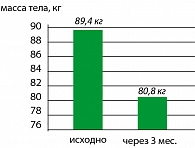
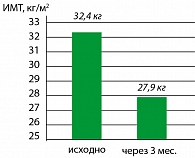
Результаты исследования свидетельствуют о высокой эффективности препарата Меридиа для лечения ожирения у женщин с МС. Применение Меридиа в дозах 10 или 15 мг в течение 3 месяцев способствовало клинически значимой потере массы тела (в среднем на 9,1±2,4 кг), уменьшению ИМТ и массы абдоминального жира у 90% больных. В ходе исследования установлено, что снижение массы тела у женщин с МС на фоне терапии Меридиа сопровождалось значительным улучшением липидного спектра крови, что является важным преимуществом препарата для данной группы больных, поскольку дислипидемия во многом определяет риск заболеваемости и смертности от сердечно-сосудистых заболеваний у женщин в постменопаузе.
Антидепрессанты в коррекции пищевого поведения
Больным с ожирением, у которых сниженная насыщаемость, эмоциогенное пищевое поведение сопровождается тревожно-депрессивными расстройствами, паническими атаками, а также больным невротической булимией показаны антидепрессанты – селективные ингибиторы обратного захвата серотонина. Флуоксетин назначается в суточной дозе от 20 до 60 мг в течение трех месяцев, флувоксамин – в суточной дозе от 50 до 100 мг в день также в течение трех месяцев. Данные препараты не рекомендованы FDA для лечения ожирения. Не доказан их эффект в отношении длительного удержания массы тела. Поэтому указанные средства предпочтительно назначать при наличии у пациентов с ожирением тревожно-депрессивных расстройств, панических атак и невротической булимии (Т.Г. Вознесенская).
Таким образом, между половыми гормонами и жировой тканью существуют сложные взаимоотношения с определенными особенностями в различные возрастные периоды женщины – от пубертата до постменопаузы. Нередко довольно трудно определить, что первично, а что вторично – гормональный дисбаланс или дефицит/избыток жировой ткани. Во всяком случае, активное лечение, направленное на снижение избыточной массы тела, может способствовать нормализации функции яичников, синтезу половых гормонов и восстановлению фертильности. Для пациенток пери- и постменопаузального возраста снижение избыточной массы тела является важнейшим фактором в терапии метаболического синдрома, а следовательно снижения заболеваемости и смертности от сердечно-сосудистой патологии и улучшения качества жизни.
Традиционно пациенты с ожирением и избыточной массой тела направлялись на лечение к эндокринологу. Гинекологи, как правило, не считали лечение, направленное на коррекцию веса, своей профессиональной задачей. Однако такой подход не может обеспечить результативность лечения по ряду причин: высокой загруженности эндокринологов, нежеланием пациенток обращаться к незнакомому специалисту. За исключением серьезных эндокринопатий, ожирение чаще всего является алиментарно-конституциональным, то есть связанным с образом жизни и пищевым поведением пациентки. Принятым мировым стандартом является ведение этого вопроса врачом первого контакта. Для успешного лечения необходимо, чтобы именно тот врач, который лечит основное заболевание, помогал пациентке скорректировать массу тела и перейти на здоровый образ жизни.
Современного специалиста характеризует ясное понимание связи массы тела и гормонального статуса женщины. Врачу-гинекологу в своей повседневной практике необходимо:
- своевременно диагностировать патологию массы тела и степень ее влияния на функцию женской репродуктивной системы;
- знать и применять на практике современные подходы к коррекции массы тела и мотивации пациенток к здоровому образу жизни;
- выбирать терапию с позиции эффективности, безопасности и улучшения качества жизни пациенток.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.