Адъювантная таргетная терапия немелкоклеточного рака легкого с мутациями в гене EGFR
- Аннотация
- Статья
- Ссылки
- English


Введение
Рак легкого – заболевание, характеризующееся высокой распространенностью и летальностью во всем мире. По прогнозам Всемирной организации здравоохранения, к 2040 г. число ежегодно выявляемых случаев заболевания увеличится с 2,21 до 3,63 млн [1]. Необходимо отметить, что данная патология относится к пяти наиболее высокозатратным для здравоохранения онкологическим заболеваниям. Так, с 2010 по 2020 г. только в США расходы на лечение рака легкого возросли до 15 млрд долларов в год [2]. В аспекте влияния различных злокачественных новообразований на утрату трудоспособности рак легкого занимает первое место [3]. Только раннее выявление заболевания и радикальное лечение позволяют рассчитывать на излечение и экономят ресурсы здравоохранения [4, 5].
Немелкоклеточный рак легкого (НМРЛ) составляет 85% всех случаев рака легкого [6]. За последние два десятилетия количество терапевтических опций при распространенном НМРЛ существенно возросло благодаря расширению знаний о биологии опухоли [7]. Внедрение в клиническую практику таргетной и иммунотерапии способствовало увеличению выживаемости и качества жизни больных [8]. Успехи в лечении пациентов с метастатическим НМРЛ заставляют задуматься о возможности применения этих препаратов при НМРЛ ранних стадий.
Примерно трети пациентов с НМРЛ может быть проведено радикальное хирургическое лечение [9–11]. Однако из-за агрессивного течения НМРЛ доля рецидивов после операции остается высокой [12, 13]. Из 100 пациентов у 50–60 после полной резекции возникнет рецидив, шестеро из них проживут пять лет после рецидива. В среднем рецидив развивается в первые два года после операции [14–19]. Более чем у 80% пациентов уже при первом рецидиве заболевания выявляются отдаленные метастазы, чаще в головном мозге (до 41% случаев) [20]. Таким образом, пациентам после радикального хирургического вмешательства требуется дополнительное лечение.
У пациентов с НМРЛ ранних стадий единственной терапевтической опцией остаются дуплеты на основе препаратов платины. В рутинной клинической практике лишь около 40% больных получают адъювантную химиотерапию [21]. Из них от трети до половины не получают полное число циклов. Несмотря на проведенную адъювантную химиотерапию, более чем в 30% случаев возникают отдаленные метастазы [21, 22]. Кроме того, на фоне такой терапии не снижается частота метастазирования в центральную нервную систему (ЦНС) [23]. Все это послужило предпосылкой для исследования таргетной терапии в адъювантном режиме. В этом аспекте наиболее изучены ингибиторы тирозинкиназы (ИТК) EGFR.
Исследования ИТК EGFR в качестве адъювантной терапии у пациентов с НМРЛ
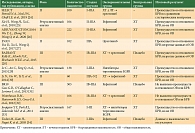
В таблице 1 представлены исследования ИТК EGFR в адъювантном режиме [24–34]. Часть исследований представляют ретроспективный анализ данных. В отношении популяции пациентов исследования неоднородны: больные имели разные стадии заболевания, ИТК EGFR могли применяться самостоятельно или после адъювантной химиотерапии, в ряде исследований (BR19, RADIANT) статус мутации в гене EGFR не определялся до начала исследования.
Особый интерес вызывает продолжительность лечения. В большинстве проспективных исследований она составляла два года. Это связано с тем, что наибольшее число рецидивов НМРЛ развивается в течение первых двух-трех лет после полной резекции. Это лишний раз подтверждают и результаты исследования ADJUVANT/CTONG1104. В данной работе эффективность адъювантной терапии гефитинибом в течение двух лет у пациентов с НМРЛ II–IIIA стадии сравнивали с эффективностью химиотерапии. Гефитиниб продемонстрировал преимущество в отношении безрецидивной выживаемости (БРВ) (медиана 28,7 месяца в группе гефитиниба и 18,0 месяца в группе химиотерапии; отношение рисков (ОР) 0,60; р = 0,0054), но к третьему году наблюдения кривые практически сошлись. Интересно, что пациенты, получавшие гефитиниб 18 месяцев и более, имели преимущество в отношении ОВ по сравнению с пациентами, которые получали гефитиниб менее 18 месяцев. Теоретически это свидетельствует в пользу большей длительности лечения (ОР 0,38; 95%-ный доверительный интервал (ДИ) 0,22–0,66; р < 0,001) [26].
Возможность повторного использования ИТК EGFR в случае развития рецидива после окончания адъювантной терапии также представляет интерес. Данный вопрос изучался в протоколе SELECT. В открытом исследовании II фазы эрлотиниб в течение двух лет назначали пациентам c НМРЛ I–IIIA стадии после полной резекции и адъювантной химиотерапии (± лучевая терапия). Почти 2/3 пациентов после рецидива (n = 26/40) получили эрлотиниб повторно. Медиана длительности терапии составила 13,1 месяца [24].
Исследование ADAURA
Исследование III фазы ADAURA послужило основанием для первой регистрации ИТК EGFR в качестве адъювантной терапии НМРЛ после полной резекции (с возможным назначением адъювантной химиотерапии на основе препаратов платины до начала терапии ИТК EGFR). В исследовании оценивали эффективность ИТК EGFR третьего поколения осимертиниба у пациентов с IB–IIIA стадией заболевания с классическими мутациями в гене EGFR [35].
Результаты незапланированного промежуточного анализа показали 80%-ное снижение риска рецидива или смерти при использовании осимертиниба в адъювантном режиме по сравнению с плацебо [35]. Исходно первичный анализ данных ADAURA был запланирован не ранее чем на 2022 г. Но эффективность осимертиниба была настолько высока, что независимый комитет по мониторингу данных рекомендовал раннее расслепление полученных результатов [36].
Участниками исследования стали 682 пациента с НМРЛ IB–IIIA стадии (согласно классификации TNM 7-й редакции) с мутацией в гене EGFR после радикальной операции. Проведение пред- или послеоперационной лучевой терапии не допускалось, но пациенты могли получать адъювантную химиотерапию. После завершения стандартного лечения больным назначали осимертиниб или плацебо в течение трех лет либо до развития рецидива или выполнения других критериев отмены лечения, в зависимости от того, какое событие наступит раньше.
Первичной конечной точкой исследования была БРВ у пациентов с НМРЛ II–IIIA стадии. Согласно дизайну исследования, для подтверждения эффективности осимертиниба ОР должно было достигнуть 0,70. Этот показатель составил 0,17 (99,06% ДИ 0,11–0,26; p < 0,001), что соответствует снижению риска рецидива или смерти на 83% при использовании адъювантной терапии осимертинибом по сравнению с плацебо. Двухлетняя БРВ в группе осимертиниба превысила в два раза таковую в группе плацебо – 90 против 44% [35].
Результат для всей популяции включенных в исследование пациентов (НМРЛ IB–IIIA стадии) был сопоставим: ОР 0,20 (99,12% ДИ 0,14–0,30; p < 0,001), что соответствует снижению риска на 80% [35].
Преимущество осимертиниба в отношении БРВ наблюдалось во всех клинически значимых подгруппах независимо от стадии заболевания, типа мутации и предшествующей адъювантной химиотерапии.
На момент окончания сбора данных для промежуточного анализа рецидив заболевания зарегистрирован у 11% пациентов, получавших осимертиниб, и 46% пациентов, принимавших плацебо. При этом большинство рецидивов в группе осимертиниба носили локальный характер (7 из 11%). Только у 1% пациентов выявлено метастатическое поражение ЦНС. В то же время в группе плацебо более половины рецидивов сопровождались развитием отдаленных метастазов (28 из 46%), у 10% пациентов отмечались метастазы в ЦНС. На фоне применения осимертиниба достигнуто снижение риска развития метастазов в ЦНС или смерти на 82% (ОР 0,18; 95% ДИ 0,10–0,33; p < 0,0001) [35].
Показатели ОВ на момент промежуточного анализа были незрелыми (4%): 29/682 событий (осимертиниб – n = 9, плацебо – n = 20). Согласно предварительной оценке, двухлетняя ОВ в группе пациентов с НМРЛ II–IIIA стадии составила 100% в группе осимертиниба и 93% в группе плацебо (ОР 0,40; 95% ДИ 0,18–0,90; зрелость данных – 5%). Важно, что, несмотря на публикацию результатов, исследование по-прежнему заслеплено для врачей и пациентов (как завершивших, так и продолжающих лечение в рамках исследования). Это позволяет продолжить наблюдение и в будущем получить результаты по ОВ [35].
Отмечалась хорошая переносимость осимертиниба: частота осложнений 3–4-й степени, связанных с приемом препарата, составила 10%. Основными проявлениями токсичности, преимущественно 1–2-й степени тяжести, были диарея (46%), развитие паронихий (25%) и кожной сыпи (26%). Отмена препарата в связи с токсичностью зарегистрирована у 11% больных. Летальных исходов, обусловленных токсичностью лечения, не зарегистрировано [35].
Влияние предшествующей адъювантной химиотерапии на безрецидивную выживаемость – подгрупповой анализ
В исследовании ADAURA пациенты могли получать адъювантную химиотерапию до рандомизации.
Согласно представленным на WCLC-2020 данным, адъювантную химиотерапию (четыре цикла, режимы на основе препаратов платины) получили 60% пациентов.
Адъювантная химиотерапия чаще назначалась пациентам с НМРЛ II или IIIA стадии, чем пациентам с НМРЛ IB стадии (76 против 26%), лицам моложе 70 лет (66 против 42%) и в азиатской популяции (65 против 53%).
Осимертиниб продемонстрировал преимущество в отношении БРВ по сравнению с плацебо среди пациентов, как получавших, так и не получавших адъювантную химиотерапию (табл. 2). Преимущество осимертиниба не связано со стадией заболевания (табл. 3).
Таким образом, анализ подтвердил ранее полученные результаты и продемонстрировал, что адъювантная терапия осимертинибом приводит к стабильному улучшению БРВ у пациентов с НМРЛ IB–IIIA стадии с наличием мутации в гене EGFR после радикальной операции независимо от стадии и предшествующей адъювантной химиотерапии [36].
Дальнейшее изучение
Дальнейшее изучение данных исследования ADAURA, а также возможностей другой таргетной и иммунотерапии у пациентов с НМРЛ ранних стадий позволит определить наилучшую стратегию лечения. Особый интерес представляют ожидаемые результаты пятилетней БРВ и ОВ. Необходимо оценить, что происходит с больными после отмены таргетной терапии и какие подходы к лечению могут применяться впоследствии в случае рецидива. Между тем уже сегодня можно провести параллели с другими нозологиями, при которых изучали ИТК в качестве адъювантной терапии. Так, в исследовании COMBI-AD у пациентов с резектабельной меланомой III стадии с мутацией в гене BRAF комбинация ингибиторов BRAF и МЕК дабрафениба и траметиниба применялась в течение года в адъювантном режиме. Преимущество в отношении БРВ сохранялось на протяжении пятилетнего периода наблюдения (пятилетняя БРВ в группе комбинированной терапии составила 52%, в группе плацебо – 36%). Медиана БРВ в группе таргетной терапии не достигнута, а в группе плацебо составила 16,6 месяца (ОР 0,51; 95% ДИ 0,42–0,61). Выживаемость без отдаленных метастазов через пять лет в группе «дабрафениб + траметиниб» достигла 65%, в группе плацебо – 54% (ОР 0,55; 95% ДИ 0,44–0,70).
Таким образом, применение таргетной терапии может приводить к долгосрочному увеличению БРВ спустя продолжительное время после окончания адъювантной терапии [37].
Заключение
В связи с агрессивным течением НМРЛ риск рецидива после радикального хирургического лечения у пациентов с ранними стадиями остается высоким. Ограничения в применении адъювантной химиотерапии требуют поиска новых опций. Поэтому уже сегодня значительный выигрыш в безрецидивной выживаемости на фоне применения адъювантной таргетной терапии является огромным шагом вперед.
Ye.A. Filippova, A.M. Lozhkina, A.O. Cheremnykh, S.V. Orlov, PhD, Prof., Corr. Mem. of RAS
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Yelena A. Filippova, helen-doc@mail.ru
Targeted therapy has dramatically changed the approaches to the management of patients with non-small cell lung cancer (NSCLC) with driver mutations. The introduction of tyrosine kinase inhibitors into clinical practice made it possible to prolong and improve the quality of life of patients with late stages. However, despite the high demand for new treatments, there has been no change for patients with early-stage NSCLC over the past decade and a half. Adjuvant platinum-based chemotherapy has shown only a moderate benefit in relapse-free and overall survival, with relapse occurring in more than half of the patients. In routine clinical practice, only about 40% of patients receive adjuvant chemotherapy. One-third to one-half of them do not get the full number of cycles. This became
the basis for the study of targeted therapy in the adjuvant mode. In this aspect, tyrosine kinase inhibitors are the most studied. This review will provide the discussion on them.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.