Актуальные подходы к наружной терапии акне, дерматозов, осложненных вторичной инфекцией, и остроконечных кондилом в практике врача-дерматовенеролога. Х Международный форум дерматовенерологов и косметологов. Сателлитный симпозиум компании «Гленмарк»
- Аннотация
- Статья
- Ссылки






Лечение акне
Акне является одним из самых распространенных дерматозов, которым страдают порядка 85% лиц в период полового созревания, у 15% из них регресса заболевания не происходит даже в зрелые годы. Как отметила Елена Владиславовна МАТУШЕВСКАЯ, д.м.н., профессор кафедры дерматовенерологии и косметологии Института повышения квалификации Федерального медико-биологического агентства, ключевыми патогенетическими факторами при акне считаются фолликулярная гиперкератинизация, микробная колонизация Propionibacterium acnes, продукция сала и комплекс воспалительных механизмов, воздействующих на врожденный и приобретенный иммунитет. На патогенез также оказывают влияние нейроэндокринная регуляция, диета, генетические и негенетические факторы1.
Основная роль в патогенезе заболевания отводится P. acnes – условно патогенному сапрофиту. Именно P. acnes может быть триггером воспаления посредством активации Toll-подобных и протеазных рецепторов, через которые происходит воздействие на клетки иммунной системы – сначала на клетки врожденного иммунитета, затем адаптивного. Это приводит к синтезу целого ряда факторов, в частности антимикробных пептидов, интерлейкинов (ИЛ). P. acnes стимулирует продукцию таких провоспалительных цитокинов, как ИЛ-8, ИЛ-12, ИЛ-1-альфа. Последний обусловливает гиперкератоз2.
P. acnes способствует повышенной кератинизации в устье волосяного фолликула за счет индукции интегрина и филаггрина, находящегося в более высоких концентрациях в протоках и воронке сальных желез у лиц, склонных к развитию акне.
Биопленки оказывают дополнительное влияние на формирование гиперкератоза и повышают устойчивость P. acnes к антибиотикам3.
В метагеномных исследованиях изучались микробиомы кожи лица больных акне и здоровых добровольцев. В результате было выделено пять основных филотипов: IA, IB, IC, II и III. С акне ассоциировался филотип IC. При этом филотип III у пациентов с акне отсутствовал4.
В целом микробиом кожи больных акне в отличие от микробиома кожи здоровых добровольцев представлен разными филотипами, причем филотипы P. acnes несут ген антибиотикорезистентности.
Согласно Федеральным клиническим рекомендациям по ведению больных акне (2015), Европейским рекомендациям по лечению акне (2016) и Американским рекомендациям по лечению акне (2016) терапия заболевания проводится в зависимости от его тяжести и предусматривает назначение системных (ретиноиды, антибиотики, гормональные препараты) и наружных лекарственных средств.
Лечение должно быть своевременным и эффективным. После достижения контроля над заболеванием показана поддерживающая терапия. Необходима коррекция психологического состояния пациентов.
По словам профессора Е.В. Матушевской, в 80% случаев пациентам для успешного лечения достаточно топической терапии. Могут применяться ретиноиды, антимикробные препараты (бензоил пероксид), антибиотики (макролиды, линкозамиды), комбинированные лекарственные средства (антибиотик + ретиноид), азелаиновая и салициловая кислоты. Наиболее перспективной считается комбинация ретиноида с антибиотиком.
Клинический эффект топической антибиотикотерапии, имеющей высокий уровень доказательности при акне1, основан на противовоспалительном и антибактериальном действии. Наиболее эффективными антибактериальными препаратами считаются эритромицин и клиндамицин. В силу растущей резистентности колонизирующих кожу P. acnes к эритромицину на сегодняшний день предпочтение отдается клиндамицину5.
Анализ результатов клинических исследований, проведенных с 1974 по 2003 г., показал, что устойчивость P. acnes к эритромицину выросла значительно: его эффективность в отношении сокращения количества воспалительных и невоспалительных повреждений кожи снизилась на 2,14 и 2,03% (p = 0,001) в год соответственно. Изменение эффективности клиндамицина за этот период не зафиксировано (рис. 1)6.
Клиндамицин – антибиотик широкого спектра действия, оказывающий мощный антибактериальный и противовоспалительный эффекты. Он сокращает популяцию P. acnes, содержание свободных жирных кислот (на 50%). Доказаны терапевтическая эффективность, высокий профиль безопасности и хорошая переносимость препарата. Однако, учитывая растущие опасения по поводу устойчивости микроорганизмов к антибиотикам, в клинических рекомендациях Российское общество дерматовенерологов (2015) указало, что топические антибиотики обязательно должны назначаться в комбинации с топическими ретиноидами.
Топические ретиноиды (адапален, изотретиноин, тазаротен) – основа топической терапии акне, поскольку обладают комедонолитическим, противовоспалительным действием и предотвращают появление предшественников комедонов. На данный момент доказано преимущество адапалена в монотерапии легких и среднетяжелых форм акне, в связи с чем рекомендуется начинать лечение именно этим препаратом1. Препарат оказался не только более эффективным, но и более безопасным.
Адапален – топический ретиноид последнего поколения. Он характеризуется противовоспалительным, комедонолитическим и антикомедоногенным эффектами7. Кроме того, адапален признан иммуномодулятором, поскольку воздействует на иммунокомпетентные клетки. Адапален в виде 0,1%-ного геля выпускается под торговым названием Клензит.
Преимуществами Клензита считаются:
- мощное влияние на два звена патогенеза – устранение комедонов и предупреждение образования новых, а также уменьшение воспаления;
- оптимальная для лечения акне водно-гелевая основа;
- отсутствие фотосенсибилизации, присущей препаратам, содержащим изотретиноин;
- возможность длительного применения в качестве поддерживающей терапии.
Ни одно из лекарственных средств в виде монотерапии не влияет сразу на все звенья патогенеза. Поэтому будущее топического лечения акне связано с применением фиксированных комбинаций. Таковой, в частности, является препарат Клензит С.
Клензит С представляет собой фиксированную комбинацию адапалена 0,1%-ного и клиндамицина 1%-ного. Совместное их применение в два раза увеличивает пенетрацию антибиотика в сально-волосяной фолликул, тем самым повышается эффективность лечения8, 9.
Преимущества препарата Клензит С:
- воздействует на большинство патогенетических факторов акне – фолликулярную кератинизацию, колонизацию P. acnes и воспаление;
- более быстро и эффективно по сравнению с монотерапией антибиотиком устраняет P. acnes;
- снижает риск появления устойчивых к антибиотикам бактерий;
- удобен в применении – вместо двух и более средств используется одно, что повышает приверженность пациентов лечению.
Акне признано хроническим заболеванием, требующим длительной терапии. В связи с этим после окончания основного курса лечения и достижения клинического эффекта показана поддерживающая терапия сроком до 12 месяцев в интермиттирующем режиме. В качестве препарата выбора можно рассматривать адапален (Клензит)10.
Профессор Е.В. Матушевская представила аудитории наиболее оптимальный алгоритм лечения акне препаратами линейки Клензит.
Для лечения акне легкой степени тяжести (преимущественно комедональной формы) назначают гель Клензит один раз в сутки на ночь в течение 8–12 недель. При средней степени тяжести заболевания (преимущественно папуло-пустулезной форме) – комбинированный препарат Клензит С в виде геля. Режим нанесения: один раз в сутки перед сном в течение 8–12 недель. При достижении регресса пустулезных высыпаний через одну-две недели используется гель Клензит – один раз в сутки перед сном в течение 8–12 недель. Поддерживающая терапия гелем Клензит проводится в интермиттирующем режиме. Гель наносится вечером два-три раза в неделю, длительность такого лечения составляет 6–12 недель.
В заключение выступающая процитировала J. Leyden: «Чтобы справиться с акне, многим больным достаточно назначить препараты, подавляющие жизнедеятельность P. acnes и устраняющие патологический гиперкератоз. При более тяжелых формах заболевания, когда такой подход неэффективен, необходимо лечение, направленное на подавление секреции кожного сала».
Дерматозы, осложненные вторичной инфекцией
Универсальная модель патогенеза осложненного дерматоза базируется на трех составляющих: свойствах микроорганизма, макроорганизма и окружающей среды. По словам Андрея Николаевича ЛЬВОВА, д.м.н., профессора, руководителя отдела клинической дерматологии Московского научно-практического центра дерматовенерологии и косметологии (МНПЦДК), большинство кожных заболеваний, с которыми врачам приходится сталкиваться в клинической практике, осложняются грибковой и/или микробной контаминацией, что диктует необходимость проведения комбинированной терапии11.
При осложнении хронических дерматозов целесообразно использовать комбинированные препараты, содержащие не только глюкокортикостероид (ГКС), но и противобактериальный и противогрибковый компоненты. При этом важно подобрать наиболее оптимальное их соотношение.
Препаратами выбора в терапии аллергодерматозов признаны топические ГКС. Они характеризуются минимальным побочным действием при хорошей эффективности.
Введение галогена в молекулу глюкокортикостероида существенно повысило его активность в отношении воспаления. Так, галогенизированные хлорированные ГКС, представителем которых является беклометазона дипропионат, обладают большей противовоспалительной активностью.
Актуальность проблемы заключается в том, что практически у всех больных аллергодерматозами, в частности аллергическим дерматитом, экземой, в местах расчесов отмечается бактериальная активность. В частности, выявляется колонизация дрожжеподобных грибов Malassezia furfur, Candida, бактерии Staphylococcus aureus, поддерживающих и течение атопического дерматита, и атопический марш в целом.
Согласно эпидемиологическим данным, при дерматозах инфицированность Candida albicans достигает 77%, St. aureus – 60%12.
Поскольку чаще всего отмечается смешанная инфекция, с присутствием разного вида грибов и бактерий, поставить точный диагноз бывает сложно.
В данном случае эффективная терапия – это комбинация сильного и безопасного ГКС, антигрибкового и антибактериального препаратов.
Среди трехкомпонентных препаратов таким требованиям отвечает Кандидерм. В его состав входят беклометазона дипропионат, гентамицина сульфат и клотримазол. Первый компонент – наиболее подходящий стероид для лечения осложненных повреждений кожи, второй – идеальный топический антибиотик, третий – антигрибковый препарат, обладающий активностью против размножающихся и растущих микроорганизмов. В сравнительном рандомизированном исследовании по оценке эффективности и фармакоэкономических показателей двух видов терапии трехкомпонентными препаратами участники были рандомизированы на две группы по 30 человек в каждой: первая – получала комбинацию «гентамицин + клотримазол + беклометазон», вторая – комбинацию «гентамицин + клотримазол + бетаметазон». Длительность лечения составила 21 день.
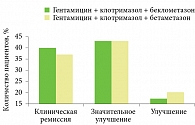
Результаты исследования продемонстрировали преимущество препарата Кандидерм (гентамицин, клотримазол, беклометазон) в отношении достижения клинической ремиссии и нивелирования симптомов (рис. 2).
До начала лечения все пациенты жаловались на зуд и шелушение. На фоне терапии Кандидермом у большего числа пациентов первой группы данные симптомы были устранены.
На фоне терапии Кандидермом клиническая ремиссия была достигнута у 40% больных, значительное улучшение – у 43%, улучшение – у 17% больных13.
По окончании лечения препарат Кандидерм получил наиболее высокую оценку по таким параметрам, как эффективность, удобство применения и органолептические свойства. 75% пациентов охарактеризовали его эффективность как отличную, 25% – как хорошую. Для препарата сравнения данные значения были чуть ниже – 60 и 37% соответственно. 3% пациентов второй группы оценили эффективность препарата как удовлетворительную.
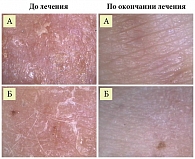
Высокая эффективность препарата Кандидерм была подтверждена и результатами дерматоскопии (рис. 3). Если у применявших комбинацию «гентамицин + клотримазол + беклометазон» кожа была абсолютно здорова, у применявших комбинацию «гентамицин + клотримазол + бетаметазон» наблюдались сухость кожи и мелкопластинчатое шелушение.
Аналогичные результаты получены в исследовании эффективности препарата Кандидерм у больных экземой. Такая терапия способствовала достижению клинической ремиссии у 40,5% пациентов, значительному улучшению – у 46%, улучшению – у 13,5% пациентов14.
Преимуществом Кандидерма является низкая системная абсорбция беклометазона дипропионата.
В клинической практике препарат Кандидерм можно использовать при кандидозной, стрептококковой и смешанной заеде, сухой стрептодермии, экзематозных поражениях кожи в области язв.
Подводя итог выступлению, профессор А.Н. Львов подчеркнул, что Кандидерм (беклометазон 0,025% + гентамицин 0,1% + клотримазол 1,0%) – высокоэффективный и безопасный комбинированный препарат для лечения дерматозов, осложненных вторичной инфекцией.
Кандидерм обладает противовоспалительным, противозудным, антиаллергическим, антибактериальным и антимикотическим действием. Высокая безопасность терапии обусловлена включением в состав препарата нефторированного ГКС.
ВПЧ: международный консенсус по терапии и профилактике инфекции
Вирус папилломы человека (ВПЧ) представляет собой большую гетерогенную группу вирусов, вызывающих доброкачественные и злокачественные заболевания. Как отметил Алексей Анатольевич ХАЛДИН, член-корреспондент Российской академии естественных наук, д.м.н., профессор, научный руководитель Центра вирусной патологии кожи МНПЦДК, вирус папилломы человека – самая частая инфекция, передаваемая половым путем (ИППП). По данным МНПЦДК за 2015 г., на ее долю в структуре ИППП Московского региона приходилось 36,38% случаев. Заболеваемость аногенитальными бородавками в г. Москве может составлять от 35 тыс. до 40 тыс. случаев. Аногенитальные бородавки наиболее часто вызываются ВПЧ 6-го и 11-го типов, а также высокоонкогенными ВПЧ 16-го и 18-го типов.
В 2015 г. количество пациентов с аногенитальными бородавками составило 22,5 на 100 тыс. населения. Однако, по мнению профессора А.А. Халдина, эта цифра далека от действительности, потому что основана лишь на данных, полученных от дерматовенерологов, в то время как многие пациенты наблюдаются у гинекологов, инфекционистов и специалистов негосударственных медицинских учреждений.
Реальная распространенность патологии может быть выше в шесть – восемь раз.
Анализ данных позволил составить социальный портрет пациента с аногенитальными бородавками. Это преимущественно женщины в возрасте от 18 до 30 лет, сексуально активные и имеющие в течение года несколько половых партнеров. Это лица, практикующие орально-генитальные и анально-генитальные сексуальные отношения, нерегулярно использующие презервативы и малоинформированные о методах безопасного секса.
В патогенезе ВПЧ-инфекции важная роль отводится местному, а не системному иммунитету. Если звенья местного иммунитета функционируют нормально, при попадании вируса на кожу или слизистые высыпаний не будет. Некоторое время в эпителиальных клетках может отмечаться присутствие вируса (подтверждается при проведении полимеразной цепной реакции (ПЦР)). Однако патологический процесс не развивается, поскольку вследствие элиминации клеток вирус отторгается.
При подавлении местного интерферонового звена иммунитета вирус размножается и появляются бородавки, в том числе аногенитальные.
За долгие годы существования ВПЧ «научился обманывать» иммунную систему человека – располагается только в эпителиальных тканях, отсутствует в кровяном русле и ганглиях. Ввиду этого при естественном течении инфекции антитела к ВПЧ либо не продуцируются, либо обнаруживаются в очень низких концентрациях, не позволяющих предотвратить реинфекцию15.
С учетом патогенеза ВПЧ-инфекции и большого количества исследований по ее изучению в методических рекомендациях МНПЦДК «Папилломавирусная инфекция» (2016) указано на необходимость проводить вакцинопрофилактику против генитальной папилломавирусной инфекции четырехвалентной вакциной до начала сексуальной активности. Мировой опыт свидетельствует об эффективности вакцинопрофилактики и в более старшем возрасте, а также после лечения аногенитальных бородавок, обусловленных высоко- и низкоонкогенными штаммами вируса, для предупреждения развития рака.
Современное лечение аногенитальных бородавок предусматривает применение деструктивных и терапевтических методов.
По мнению профессора А.А. Халдина, только использование комбинированной терапии позволяет предотвратить рецидивы, частота которых после деструкции велика. Их причины – недостаточная эффективность методов лечения в отношении элиминации ВПЧ, отсутствие обследования и лечения половых партнеров.
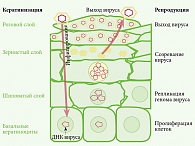
Методы лечения, направленные на удаление поверхностного слоя эпидермиса без санации клеток базального слоя, где происходит репликация ДНК ВПЧ, не всегда бывают эффективны и сопровождаются рецидивом заболевания. Это обусловлено тем, что инфицированные клетки базального слоя служат источником инфицирования эпителиальных клеток и последующего персистирования ВПЧ (рис. 4)16.
Триггером для активации вируса зачастую служит удаление бородавок, выступающее в качестве локального стресса для иммунной системы.
Деструктивные методы лечения аногенитальных бородавок включают электрокоагуляцию, лазеротерапию, радиоволновую хирургию, криотерапию, химиодеструкцию. Их эффективность варьируется от 60 до 100%.
Согласно международному консенсусу по ВПЧ, удалением достигается деструкция видимых вирусных новообразований при возможном сохранении ВПЧ в глубине очага или на других, визуально неизмененных участках кожи и слизистых. Избежать этого можно путем назначения местной иммунной терапии. Активность вируса подавляется, предотвращается реинфекция и, таким образом, осуществляется вторичная профилактика ВПЧ-инфекции.
В европейском руководстве вторичная иммунная профилактика проводится с помощью 5%-ного крема имихимод (препарата Кераворт). Имихимод (Кераворт) не обладает прямым противовирусным действием. Крем Кераворт стимулирует местный интерфероногенез. Речь, в частности, идет о выработке интерферонов альфа, гамма и других медиаторов, действующих на ВПЧ.
Крем Кераворт широко применяется и в России.
Препарат показан для лечения наружных остроконечных кондилом на наружных половых органах или в перианальной области у пациентов 18 лет и старше. Применение препарата во время беременности и лактации возможно, но по строгим показаниям – если предполагаемая польза для матери будет превышать потенциальный риск для плода. При его использовании в период лактации грудное вскармливание следует прекратить.
Крем Кераворт наносится на бородавки три раза в неделю (через день) перед сном на шесть – десять часов. По истечении указанного времени область нанесения очищается теплой водой и мягким мылом. Лечение продолжается до исчезновения видимых генитальных или перианальных кондилом, но не более 16 недель. Если местная реакция на препарат становится причиной серьезного дискомфорта, разрешается сделать перерыв на несколько дней.
Современная тактика лечения ВПЧ-инфекции предполагает проведение комплекса мероприятий, включая деструкцию аногенитальных бородавок и использование крема Кераворт. При этом кремом обрабатывается не только бородавка, но и зона вокруг нее.
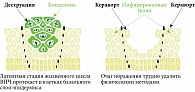
Необходимо помнить, что выбор метода терапии зависит от морфологии (формы, строения) и распространенности аногенитальных бородавок, опыта врача, предпочтений пациента и происходит по взаимному согласию врача и пациента (рис. 5).
В заключение профессор А.А. Халдин привел собственные данные по оценке эффективности различных методов терапии аногенитальных бородавок за 2013–2015 гг., которые подтвердили более высокую эффективность комбинированной терапии – удаление плюс крем Кераворт.
Лечение ВПЧ-инфекции: современный взгляд на проблему
По словам Светланы Викторовны КЛЮЧАРЕВОЙ, д.м.н., профессора, руководителя лазерного центра кафедры дерматовенерологии Северо‑Западного государственного медицинского университета им. И.И. Мечникова, крем Кераворт продемонстрировал высокую эффективность в комплексном лечении аногенитальных бородавок.
Кераворт, действуя на рецепторы, находящиеся на поверхности дендритных клеток, моноцитов и макрофагов, индуцирует секрецию фактора некроза опухоли альфа (ФНО-альфа), ИЛ-12 и других цитокинов. ФНО-альфа вызывает быстрое, неспецифическое, антивирусное и антипролиферативное действие. ИЛ-12 и другие цитокины запускают опосредованную Т-клетками реакцию, очищая очаг поражения и создавая «иммунную память» в отношении ВПЧ. Других препаратов, обладающих аналогичным механизмом действия, пока не существует.
ВПЧ имеет ряд особенностей. ВПЧ – строго эпителиотропный вирус, поэтому поражает только эпителий кожи, слизистые оболочки гениталий, гортани, ротовой полости и глаза. Вирус персистирует в эпителиальных тканях, поэтому в крови не определяется. Кроме того, ВПЧ признан одним из основных канцерогенных факторов, вызывающих эпителиальные опухоли.
Поскольку ВПЧ не проникает глубже базального слоя, лечение должно быть сконцентрировано на этом уровне.
К основным методам терапии относятся различные виды деструкции: деструкция патологического образования, деструкция цитотоксическими и химическими препаратами.
При этом риск рецидива не зависит от метода деструкции и глубины удаления. Рецидив инфекции возможен вследствие латентной инфекции в прилегающих участках кожи. Таким образом, удаление является только симптоматической терапией, которая не воздействует на очаг латентной ВПЧ-инфекции вокруг кондиломы.
Традиционные методы удаления бородавок наружных половых органов обладают рядом недостатков. К таковым относятся плохое заживление ран, появление рубцов, длительный восстановительный период.
Именно поэтому принципиально важно применять топические препараты, которые будут влиять на стимуляцию противовирусного иммунного ответа.
Сочетание деструкции и местного иммуномодулятора (Кераворта) нивелирует недостатки первой.
Распространенность процесса, рецидивирующее течение заболевания, непереносимость анестезии, отсутствие у врача возможности провести деструкцию могут стать основанием для использования крема Кераворт.
Крем Кераворт, упакованный в одноразовые пакетики-саше, применяется три раза в неделю перед сном. Крем наносится тонким слоем на предварительно очищенный участок кожи или слизистой и аккуратно втирается до полного впитывания. В случае появления эритемы, которая как правило нивелируется самостоятельно, следует сделать перерыв в лечении на несколько дней. При развитии отека, что бывает крайне редко, применяется симптоматическая терапия.
Далее профессор С.В. Ключарева представила алгоритм терапии пациентов с аногенитальными бородавками. Монотерапия Керавортом рекомендуется при появлении одиночных кондилом, а также для подготовки больного к удалению кондилом и постпроцедурного лечения. Крем нельзя наносить на эрозивную поверхность, следует дождаться эпителизации.
При наличии множественных кондилом крупные элементы удаляют аппаратными методами, мелкие – лечат Керавортом. Если множественные кондиломы сливаются, срастаются в большие бляшки, то сначала проводят лечение Керавортом в течение двух-трех недель, затем крупные кондиломы удаляют аппаратными методами с последующей терапией Керавортом в течение трех месяцев.
Крем Кераворт характеризуется хорошим профилем безопасности, поэтому его можно назначать беременным и ВИЧ-инфицированным.
В то же время анализ зарубежной литературы показывает, что системные иммуномодуляторы не рекомендуются для широкого применения, их используют для терапии аногенитальных бородавок при иммунодефицитных состояниях.
«Основа лечения остроконечных кондилом – своевременная патогенетическая терапия, направленная на элиминацию ВПЧ», – констатировала профессор С.В. Ключарева.
Дерматомикозы: современный подход к терапии
Грибковые заболевания кожи являются одной из часто обсуждаемых проблем. Ее актуальность связана с высокой распространенностью таких заболеваний и отрицательным их воздействием на качество жизни пациентов. По словам Алексея Александровича ЦЫКИНА, к.м.н., доцента кафедры кожных болезней и косметологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, микозами страдают порядка 7 млн российских граждан. Непрекращающемуся росту заболеваемости способствует увеличение в структуре населения лиц пожилого и старческого возраста.
Согласно классификации дерматомикозов по локализации различают микоз волосистой части головы (tinea capitis), микоз гладкой кожи (tinea corporis), микоз крупных складок (tinea cruris), микоз кистей и стоп (tinea pedis et manuum) и микоз ногтей (tinea unguium).
Клиническая классификация микозов включает пять основных групп:
- кератомикозы, разноцветный лишай, узловатая трихоспория;
- дерматофитии (дерматомикозы), эпидермофития паховая, руброфития, эпидермофития стоп, трихофития, микроспория, фавус;
- кандидоз;
- глубокие (висцеральные и системные) микозы (гистоплазмоз, кокцидиоидомикоз, бластомикозы, криптококкоз, геотрихоз, споротрихоз, хромомикоз, риноспоридиоз, аспергиллез, пенициллиноз, мукороз);
- псевдомикозы (эритразма, подмышечный трихомикоз, актиномикоз, микромоноспороз, мицетомы, нокардиоз).
Дерматофиты считаются основными этиологическими возбудителями онихомикозов, которые выявляются у больных в 86,36% случаев17. Следует отметить, что классические методы диагностики онихомикозов, основанные на микроскопии патологического материала и выделении культуры возбудителя, достаточно трудоемки и характеризуются невысокой чувствительностью. Значительно более информативным представляется обнаружение генетических маркеров возбудителей с помощью ПЦР.
Широкое распространение дерматофитов, упорное хроническое течение онихомикозов обусловливают повышенный интерес врачей к поиску оптимальных лекарственных средств и способов их применения.
Современный подход к лечению онихомикозов предполагает использование топической, системной и комбинированной терапии.
Топическая терапия применяется при поверхностном белом и дистально-латеральном онихомикозе с площадью поражения до 30–50% в отсутствие вовлечения матрикса и сильного гиперкератоза. Она также назначается пациентам с противопоказаниями к системной терапии.
К сожалению, в России только 1% больных обращается за помощью на ранних стадиях онихомикоза, поэтому в 99% случаев приходится назначать системную терапию.
Системная терапия показана при поражении более 30–50% ногтевой пластины с вовлечением матрикса, наличии сильного гиперкератоза, а также при низкой комплаентности лечению наружными средствами.
Чтобы избежать необоснованного назначения системных антибиотиков, важно уметь отличать онихомикоз от других патологий, сопровождающихся изменением ногтевой пластины, например ониходистрофии. Приобретенные ониходистрофии могут быть самостоятельным заболеванием или составной частью симптомокомплекса соматических заболеваний, следствием псориаза, красного плоского лишая, травматической онихии и других видов дистрофий, визуально напоминающих изменение ногтевых пластинок.
К сожалению, очень часто врачи не рассматривают микоз стоп как очаг хронической инфекции. Поэтому, когда они назначают системные препараты, например цитостатики или гормоны, происходит генерализация процесса и его распространение практически по всему кожному покрову.
Трудности в лечении онихомикозов связаны не только с возрастом больных, среди которых преобладают пожилые лица с сопутствующей патологией, но и с формой онихомикозов, строением ногтевых пластин.
Клинически формы микозов стоп подразделяются на сквамозную, гиперкератотическую, интертригинозную, дисгидротическую, стертую. Они бывают сухие, чаще вызываются Trichophyton rubrum, и влажные, в их развитии участвует интрагенитальный Trichophyton.
Для практикующих врачей очень важно уметь диагностировать стертую форму микоза стоп, поскольку такие пациенты не соотносят себя с больными и заражают окружающих.
К противогрибковым препаратам относятся топические и системные антибиотики, азольные соединения и алиламиновые производные.
Назначение топических антимикотиков в том или ином виде должно проводиться с учетом клинической формы микозов стоп. Так, например, стертая, сквамозная и гиперкератотическая формы сопровождаются сухостью кожи и трещинами, поэтому целесообразно использовать препарат в форме крема или мази. Интертригинозную форму, отличающуюся мокнутием кожи, предпочтительно лечить антимикотиком в форме раствора.
Постепенно на смену традиционным антимикотикам приходят новые соединения. Одним из уникальных противогрибковых соединений является сертаконазол.
Молекула сертаконазола состоит из бензотиофена и азолового матрикса. Бензотиофен повреждает мембрану грибковой клетки и таким образом способствует ее гибели. Этим обусловлено фунгицидное действие препарата. Азоловая группа препятствует биосинтезу эргостерола, что приводит к нарушению структуры и функции мембраны гриба. Как следствие, достигается фунгистатический эффект.
Сертаконазол (Сертамикол) выпускается в форме крема и раствора. Спектр его применения довольно широк: кератомикозы, разноцветный лишай, дерматофитии, эпидермофития паховая, руброфития, эпидермофития стоп, трихофития, микроспория, кандидоз.
«Сертаконазол в виде раствора можно использовать при кандидозах влажной формы, при экссудативных очагах на коже лица, при артифициальном дерматите с присоединившейся Candida krusei», – уточнил А.А. Цыкин.
В заключение выступающий подчеркнул, что своевременное выявление и лечение микоза стоп является профилактикой генерализации руброфитии и онихомикоза у пациентов.
Заключение
Проблема рационального лечения дерматозов обусловлена продолжающимся распространением патологии во всех возрастных группах, развитием вторичных инфекций и снижением качества жизни больных.
Линейка препаратов для наружного применения компании «Гленмарк» способствует расширению терапевтических опций при акне, дерматозах, осложненных вторичной инфекцией, аногенитальных бородавках, микозах. Приведенные докладчиками результаты исследований и примеры из практики свидетельствуют о высокой клинической эффективности и безопасности препаратов Клензит и Клензит С, Кандидерм, Кераворт, Сертамикол. Разнообразие форм препаратов и удобство их применения позволяют повысить приверженность пациентов лечению.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.