Рациональная топическая терапия распространенных дерматозов: обоснование и тактика. Григорьевские чтения. Сателлитный симпозиум компании «Гленмарк»
- Аннотация
- Статья
- Ссылки



Пиодермии: этиология, патогенез, лечение
В настоящее время инфекции кожи и мягких тканей (ИКМТ) являются наиболее частой причиной обращения за амбулаторной помощью, возрастает и количество госпитализаций таких больных. Например, в США регистрируется ежегодно 14,2 млн амбулаторных визитов по поводу ИКМТ1, 2.
Пиодермии, или гнойничковые болезни кожи, развиваются в результате проникновения патогенных пиококков, наиболее частыми из которых являются стафилококки и стрептококки, нередки их ассоциации.
Согласно данным, представленным вице-президентом Российского общества дерматовенерологов и косметологов, заведующим кафедрой и клиникой кожных и венерических болезней Военно-медицинской академии им. С.М. Кирова, заслуженным врачом РФ, д.м.н., профессором Алексеем Викторовичем САМЦОВЫМ, ключевым считается Staphylococcus aureus. Данный патоген вызывает развитие ИКМТ в 56,7% случаев1. На Streptococcus spp. приходится значительно меньшее количество случаев3.
Поскольку основной причиной ИКМТ в целом и пиодермий в частности признан S. aureus, обеспокоенность медицинского сообщества вызывает увеличение случаев обнаружения метициллинрезистентного золотистого стафилококка (Methicillin-Resistant Staphylococcus Aureus – MRSA), что создает сложности при подборе терапии. Следует отметить, что за последние пять лет новых методов диагностики ИКМТ предложено не было, поэтому препараты назначаются эмпирическим путем1.
По мнению профессора А.В. Самцова, при инфекционном процессе необходимо учитывать источник инфекции, путь ее передачи и восприимчивость к ней организма. В последнем случае особое значение придается локальным факторам риска. Речь, в частности, идет о грибковых инфекциях, инфицированных ранах, воспалительных дерматозах (дерматитах, в том числе атопическом, псориазе), лимфостазах, нарушении гигиены, постоянной травматизации.
При обследовании пациентов следует обращать внимание на наличие таких факторов риска, как алкоголизм, курение, хроническая болезнь почек, цирроз печени, пожилой возраст, сахарный диабет, ВИЧ, ожирение, нейропатия, опухоли, выполнение инвазивных процедур, пирсинга, тесный контакт с животными и больными ИКМТ4.
Лечение пиодермий, как правило, предусматривает использование системных и топических средств. Системную антибиотикотерапию назначают при распространенных формах пиодермий, топическую – при ограниченных.
В случае назначения местной терапии предпочтение следует отдавать мупироцину, который выпускается в виде 2%-ной мази. Установлено, что мупироцин эффективнее комбинации бацитрацина и неомицина5.
Именно мупироцин является препаратом выбора при лечении пиодермий у детей с двух месяцев, в том числе при обнаружении MRSA5, 6.
Мупироцин активен в отношении ряда бактерий, вызывающих кожные инфекции и при этом устойчивых к другим антибиотикам. В исследовании in vitro показано, что штаммы S. aureus обладают минимальной резистентностью к мупироцину в отличие от большинства других антибиотиков: эритромицина, ципрофлоксацина, линкомицина, клиндамицина, тетрациклина, гентамицина7.
В исследованиях по оценке потенциала антибиотиков в отношении MRSA-штаммов также продемонстрировано значимое преимущество мупироцина8.
Мупироцин превосходит большинство топических антимикробных препаратов (неомицин, бацитрацин, фузидиевая кислота, полимиксин В, хлорамфеникол) при лечении пиодермий. Кроме того, мупироцин не уступает и даже превосходит по эффективности такие пероральные антибиотики, как эритромицин, ампициллин, цефиксим9.
Мупироцин относится к препаратам природного происхождения. Его получают из культуры Pseudomonas fluorescens.
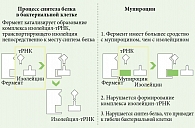
Механизм действия мупироцина уникален. Он способен подавлять синтез бактериальных белков путем специфического связывания с транспортной РНК-синтетазой (рис. 1)10.
Именно поэтому перекрестной резистентности при использовании других классов антимикробных препаратов не наблюдается.
Мупироцин практически не всасывается с поверхности здоровой кожи (0,24%). При этом он создает высокие и стабильные концентрации в поврежденных участках.
Еще одна важная особенность мупироцина – низкая активность in vitro в отношении нормальной микрофлоры кожи9, 11.
Мупироцин является активным компонентом препарата Супироцин мазь (компания «Гленмарк»).
Далее профессор А.В. Самцов представил результаты собственного исследования эффективности 2%-ной мази Супироцин у больных пиодермиями12.
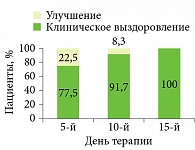
Уже на пятый день применения Супироцина клиническое выздоровление наступило у 77,5% пациентов, на второй неделе применения – у 100% (рис. 2)12.
В исследовании Ю.А. Бельковой и соавт. продемонстрирована более высокая эффективность 2%-ной мази мупироцина по сравнению с 0,75%-ной мазью хлорамфеникола13.
В двойном слепом рандомизированном исследовании показано преимущество топического мупироцина над системным цефалексином у пациентов с инфицированной экземой. В группе мупироцина бактериологического излечения достигли 50% больных, в группе цефалексина – 28%. При этом терапия мупироцином не ассоциировалась с какими-либо нежелательными явлениями. У получавших цефалексин отмечались тошнота и диарея14.
В рандомизированном открытом исследовании пациенты с импетиго, возраст – от пяти месяцев до 13 лет, получали наружную терапию мупироцином (мазь 2%) или системную терапию эритромицином в дозе 40 мг/кг/сут в течение восьми дней. Применение мупироцина оказалось более эффективным и безопасным, чем использование эритромицина15.
Резюмируя сказанное, профессор А.В. Самцов сформулировал следующие выводы:
- на сегодняшний день во всем мире, в том числе в России, стандартом топической терапии пиодермий является мупироцин, который обладает выраженным бактерицидным действием в отношении возбудителей пиодермий, включая MRSA-штаммы;
- у мупироцина отсутствует перекрестная резистентность с другими антибиотиками;
- мупироцин обладает низкой активностью в отношении нормальной микрофлоры кожи;
- высокая клиническая эффективность и безопасность мупироцина подтверждены в целом ряде российских и зарубежных исследований;
- мупироцин включен в Федеральные клинические рекомендации Российского общества дерматовенерологов и косметологов с высоким уровнем убедительности и достоверности доказательств (А1+);
- мупироцин разрешен к применению у детей с двух месяцев.
Инфицированные дерматозы. Выбор терапии
Свое второе выступление профессор А.В. Самцов посвятил возможностям применения крема Кандидерм у пациентов с инфицированными дерматозами.
Сделав краткий экскурс в историю, профессор А.В. Самцов констатировал, что на протяжении столетий представление о составе микроорганизмов кожи основывалось на описании, сделанном еще в 1683 г. Только в последние десятилетия благодаря внедрению постгеномных технологий и открытию микробиома как огромного микробного органа человека пришло понимание, что микробиом кожи чрезвычайно разнообразен и уникален.
В настоящее время известно, что на 1 см2 кожи приходится 1 млн бактерий с сотнями различных штаммов16. Большинство из них представлены Actinobacteria (62%) и Staphylococcus (26%).
Кожу колонизируют не только бактерии, но и грибы, а также вирусы. Они образуют сообщества, состав которых может значительно различаться как у разных людей, так и у одного человека в разные периоды жизни. Это зависит от количества сальных желез, температуры, увлажненности кожных покровов, генетических и экзогенных факторов.
Дисбаланс в экосистеме комменсалов может быть причиной развития дерматозов или их обострений17.
Так, именно с изменением микробиома связаны обострения атопического дерматита. Метагеномные исследования показали, что при обострении заболевания доля стафилококков увеличивается с 35 до 90%18.
Установлено также, что S. aureus и Malassezia утяжеляют течение основного кожного заболевания посредством стимуляции выброса тимического стромального лимфопоэтина кератиноцитами19.
Обсемененность кожи различными микроорганизмами и грибами обусловливает присоединение вторичной инфекции20.
Стандарты лечения дерматозов, сопровождающихся вторичной инфекцией, предполагают применение глюкокортикостероидов в комбинации с антимикотиками и антибиотиками.
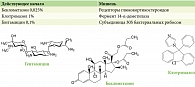
Препарат Кандидерм представляет собой комбинацию современного сильного нефторированного глюкокортикостероида беклометазона дипропионата 0,025%, антибиотика с широким спектром действия гентамицина сульфата 0,1% и антимикотика клотримазола 1,0% (рис. 3)21.
По словам профессора А.В. Самцова, Кандидерм – таргетный препарат, составляющие которого «перебирают», находят и прочно связывают мишень.
Мишенью беклометазона являются рецепторы глюкокортикостероидов, клотримазола – фермент 14-α-деметилаза, гентамицина – 30S-субъединица бактериальных рибосом.
Далее профессор А.В. Самцов подробно рассмотрел особенности каждого из трех активных компонентов препарата Кандидерм.
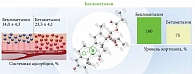
Благодаря механизму биоактивации беклометазон оказывает быстрый и выраженный противовоспалительный эффект только в очаге воспаления. Аффинность рецепторов его метаболита, беклометазона-17-монопропионата, в 30 раз превышает аффинность исходного соединения (беклометазона дипропионата) (рис. 4)22–24.
Беклометазона дипропионат в отличие от бетаметазона вместо фтора содержит хлор21.
Хлор относится к макроэлементам. Хлор в виде хлорида является основным анионом внеклеточной жидкости. Суточная потребность в нем составляет 28–56 мг/кг. Фтор – это микроэлемент. Фтор в виде фторида в дозе более 35 мг/кг может вызывать острые токсические реакции. Избыток фтора в организме является причиной флюороза и отравления, реминерализации костной ткани25. Хлор биосовместим и используется в природных органических соединениях, фтор – только в синтетических.
Установлено, что беклометазон характеризуется низким потенциалом атрофогенности и отсутствием выраженного системного действия23. Системная адсорбция беклометазона в два раза меньше, чем бетаметазона. Немаловажно и то, что на фоне топической терапии беклометазоном уровень кортизола сохраняется в пределах нормы (рис. 5)26–28.
Клотримазол, входящий в состав препарата Кандидерм, относится к антимикотическим средствам. Эффект последних определяется воздействием на эргостерол – аналог холестерина в клетке человека21.
Снижение содержания эргостерола приводит к размягчению мембраны и миколизису.
В зависимости от механизма действия топические антимикотики подразделяют на полиеновые и азольные. Первые «вынимают» эргостерол из мембраны: одна молекула антимикотика «вынимает» одну молекулу эргостерола. Вторые «выключают» синтез эргостерола за счет избирательного воздействия на 14-α-деметилазу21.
В этом, возможно, заключается их преимущество.
Так, минимальная подавляющая концентрация полиенового антимикотика нистатина для 90% исследованных штаммов Candida albicans в 67 раз выше, чем клотримазола29.
Гентамицин – антибиотик широкого спектра действия из группы аминогликозидов. Аминогликозиды подавляют биосинтез белков и повреждают цитоплазматическую мембрану. Благодаря этому гентамицин способен преодолевать резистентность микроорганизмов30.
Следует отметить, что компоненты основы крема Кандидерм также способствуют улучшению результатов лечения.
Вазелин увлажняет и смягчает кожу, уменьшает трансдермальную потерю воды в 170 раз больше, чем оливковое масло. Натрия дигидрофосфат моногидрат поддерживает необходимый рН, обеспечивая защиту от бактерий, грибов и некоторых вирусов. Пропиленгликоль оказывает увлажняющее, противомикробное воздействие, хорошо удерживает воду26.
В рандомизированном исследовании Е.В. Матушевской и соавт. (2009 г.) сравнивали эффективность и безопасность топических комбинированных препаратов у 60 больных атопическим дерматитом, осложненным вторичной инфекцией26. Участники исследования были разделены на группу Кандидерма и группу Тридерма (по 30 человек в каждой). Кремы наносили на пораженные участки кожи два раза в день в течение трех-четырех недель.
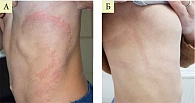
На фоне терапии топическими комбинированными препаратами у пациентов обеих групп отмечалось сопоставимое двукратное снижение индекса тяжести симптомов, однако в группе Кандидерма зарегистрировано более быстрое и значимое уменьшение выраженности симптомов, чем в группе Тридерма. Речь, в частности, идет о сухости кожи, шелушении и зуде (рис. 6).
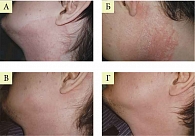
Высокая эффективность крема Кандидерм при атопическом дерматите, осложненном вторичной инфекцией, была подтверждена результатами дерматоскопии. Трехнедельная терапия Кандидермом способствовала полному разрешению высыпаний.
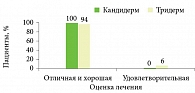
Большинство применявших Кандидерм оценили результат лечения как отличный и хороший (рис. 7).
Кроме того, пациенты из группы Кандидерма отметили хорошую переносимость, удобство применения, приятную текстуру, отсутствие запаха, цвета и следов препарата на одежде26.
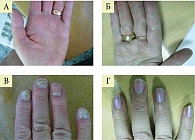
В 2018 г. на кафедре с клиникой кожных и венерических болезней Военно-медицинской академии им. С.М. Кирова оценивали эффективность Кандидерма у больных экземой и атопическим дерматитом23. Результаты исследования подтвердили высокую эффективность крема в данных популяциях (рис. 8)23.
К концу лечения у 96% пациентов с экземой ее тяжесть снизилась в пять раз, интенсивность зуда – в три раза, у 95% больных атопическим дерматитом тяжесть симптомов заболевания уменьшилась в пять раз, интенсивность зуда – в четыре.
Завершая выступление, профессор А.В. Самцов констатировал, что препарат Кандидерм является оригинальной комбинацией трех активных компонентов для эффективного и безопасного устранения симптомов дерматоза, осложненного вторичной инфекцией.
Кандидерм выпускается в двух дозах – 15 и 30 г.21
Крем следует наносить тонким слоем на пораженные участки кожи два раза в день (утром и вечером).
Продолжительность лечения зависит от эффективности и переносимости терапии и, как правило, составляет не более трех-четырех недель21.
Терапия дерматомикозов: ожидания и реальность
Как отметила доцент кафедры дерматовенерологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, к.м.н. Любовь Павловна КОТРЕХОВА, в последние десятилетия в структуре дерматозов увеличилась доля микозов кожи, обусловленных патогенными и условно патогенными микроскопическими грибами. Наиболее частыми поверхностными микозами кожи и ее придатков, вызываемыми дерматофитами, считаются дерматомикозы.
В группу риска входят пациенты с сахарным диабетом, иммунодефицитными состояниями, а также дети и лица старше 60 лет.
Среди основных возбудителей лидирующую позицию занимают дерматофиты, которые в 75–92% случаев становятся причиной поверхностных микозов кожи. Среди возбудителей также указывают дрожжи (11–25%) и плесени (< 1%)31.
По мнению докладчика, на современном этапе вполне ожидаемо изменение спектра возбудителей, характера течения и клиники микотического поражения кожи. Причиной тому являются миграция населения, урбанизация и сокращение доли сельских жителей32.
К современным особенностям следует отнести увеличение доли распространенных форм микозов кожи с вовлечением ее придатков, атипичных форм (грибковых фолликулов, tinea incognita, гранулемы Майокки), сочетанное поражение кожи и слизистых оболочек32.
Основой лечения поверхностных микозов кожи признаны этиотропные (противогрибковые) препараты. Выбор терапии зависит от степени распространенности процесса. При ограниченном поражении кожи следует использовать топическую терапию, при распространенном – системную, комбинированную33.
Идеальный противогрибковый препарат для местного применения должен обладать фунгицидным действием, широким спектром противогрибковой, антибактериальной активности и противовоспалительным эффектом. Быть безопасным и хорошо переноситься, иметь разные лекарственные формы выпуска.
Антимикотики местного действия имеют определенные различия. Так, азолы демонстрируют фунгистатический эффект, аллиламины – фунгицидный, полиеновые антибиотики, обладающие фунгистатическим и фунгицидным эффектами, характеризуются избирательным воздействием в отношении дрожжей рода Candida30.
Применение данных антимикотических средств не всегда позволяет добиться полного выздоровления.
Несомненное преимущество в лечении поверхностных микозов кожи принадлежит препаратам, сочетающим фунгицидную активность с широким спектром действия. Такими свойствами обладает сертаконазол. Данное вещество входит в состав крема и раствора Офломикол (компания «Гленмарк»).
Сертаконазол – первый в мире азоловый антимикотик двойного действия (фунгицидное и фунгистатическое)34. В отличие от других производных имидазола в состав молекулы сертаконазола помимо азоловой группы входит бензотиофен, который встраивается в структуру клеточной мембраны гриба вместо триптофана – незаменимой аминокислоты, необходимой структурной части стенки гриба. Это приводит к нарушению ее целостности и проницаемости, а в дальнейшем – к гибели гриба35.
Сертаконазол оказывает прямое токсическое воздействие на клеточную мембрану гриба уже через десять минут после применения и обеспечивает гибель 90% грибковых клеток в течение одного часа экспозиции в концентрации 0,008 г/мл36.
В качестве иллюстрации эффективности Офломикола выступающая представила несколько клинических случаев с наиболее часто встречающимися дерматомикозами, такими как трихофитии гладкой кожи, отрубевидный лишай, кандидоз кожи, грибковое поражение кожи кистей и ногтей, вызванных дрожжеподобными грибами и дерматомицетами (Trichophyton, T. rubrum, Mallassezia, Candida parapsilosis).
Терапия кремом Офломикол трихофитии и отрубевидного лишая проводилась два раза в день в течение 21 дня (рис. 9), кандидоза кожи – два раза в день в течение четырех недель (рис. 10).
Для лечения микоза и онихомикоза кистей использовали лак Офломил и крем Офломикол. Лак наносили один раз в неделю в течение трех месяцев, крем – один раз в день в течение двух недель (рис. 11).
Офломикол позволил быстро справиться с микозами во всех клинических случаях. Ни в одном из них нежелательных явлений, связанных с применением Офломикола, не зафиксировано.
Подводя итог, Л.П. Котрехова сделала следующие выводы:
- сертаконазол (Офломикол) является высокоактивным антимикотиком широкого спектра действия (фунгицидное, антибактериальное и противовоспалительное);
- сертаконазол (Офломикол) воздействует на всех возбудителей (дерматофиты, дрожжи, плесени) и эффективен при разных клинических формах поверхностных микозов кожи;
- сертаконазол (Офломикол) удобен для применения, имеет две лекарственные формы (раствор и крем), экономически выгоден, что обеспечивает комплаентность пациентов лечению.
Заключение
Широкое распространение пиодермий, инфекционных дерматозов, дерматомикозов в популяции обусловливает интерес врачей к лекарственным средствам, отвечающим оптимальному соотношению «эффективность/безопасность». Таковым обладают препараты для наружной терапии компании «Гленмарк». Приведенные докладчиками результаты исследований и примеры из собственной клинической практики свидетельствуют о высокой эффективности и безопасности препаратов Супироцин, Кандидерм и Офломикол.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.