Актуальные рекомендации ESCEO по лечению остеоартрита коленного сустава
- Аннотация
- Статья
- Ссылки
- English
В структуре всех патологий сустава 80% приходится на остеоартрит (ОА). Остеоартрит – хроническое гетерогенное прогрессирующее заболевание, характеризующееся деградацией экстрацеллюлярного матрикса хряща с последующим ремоделированием тканей сустава. Основные симптомы патологии – болевой синдром и краевые остеофиты.
У пациентов с ОА нарушается функциональная активность суставов и, как следствие, снижается качество жизни.
К факторам риска развития ОА относятся женский пол, дефицит эстрогенов в период постменопаузы, врожденные заболевания костей и суставов, избыточная масса тела, повышенная физическая нагрузка, травмы суставов и др. [1].
Остеоартрит чаще поражает коленные суставы.
Остеоартрит коленного сустава в большей степени распространен среди лиц старше 50 лет.
На сегодняшний день данным заболеванием страдают более 250 млн человек. В связи со старением населения к 2020 г. ОА может стать четвертой по значимости причиной инвалидизации [1].
Вследствие воздействия различных этиологических факторов нарушается обмен и синтетическая активность хондроцитов, а также происходит физико-химическое повреждение матрикса суставного хряща.
В основе нарушения метаболизма хряща при ОА лежит нарушение обмена протеогликанов – основного вещества хряща. Характерным признаком деструкции хряща является потеря матриксом гликозаминогликанов: хондроитинсульфата, кератансульфата, гиалуроновой кислоты. В результате происходит дегидратация хряща, дезорганизация и разрыв коллагеновых волокон. Определенная роль в патогенезе ОА отводится воспалению. Механизм, посредством которого воспаление может участвовать в деградации хряща, – выработка провоспалительных цитокинов (интерлейкинов 1-бета и 6, фактора некроза опухоли альфа и др.). Они в свою очередь способствуют высвобождению ферментов, повреждающих коллаген. Речь, в частности, идет о коллагеназе, эластазе, пептидазе [2].
Лечение должно быть направлено на снижение выраженности симптомов и замедление прогрессирования патологии. Это позволит уменьшить негативное влияние ОА на функциональную активность сустава и качество жизни пациентов, в долгосрочной перспективе – потребность в аналгезии и эндопротезировании.
Европейское общество по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis – ESCEO) в 2014 г. опубликовало рекомендации по лечению ОА коленного сустава, в которых определена приоритетность разных терапевтических вмешательств. Эксперты исходили из эффективности (уменьшение выраженности боли, улучшение функции сустава), безопасности (сокращение риска развития нежелательных явлений), структурно-модифицирующего действия, фармакоэкономики методов лечения.
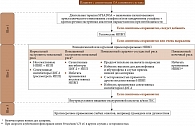
Появление новых данных стало основанием для обновления рекомендаций. И в 2016 г. ESCEO предложило алгоритм, максимально приближенный к клинической практике (рисунок) [2]. Согласно современным рекомендациям лечение ОА предполагает применение нефармакологических, фармакологических, при необходимости хирургических методов. К важнейшим нефармакологическим методам терапии относятся снижение массы тела и укрепление мышц. Среди фармакологических методов лечения основное место занимают симптоматические (анальгетики, опиоиды, нестероидные противовоспалительные препараты (НПВП)) и структурно-модифицирующие препараты (Symptomatic Slow-Acting Drug in Osteoarthritis – SYSADOA). Первые относятся к средствам быстрого действия, вторые – отсроченного. Их совместное применение обеспечивает эффективность лечения.
На сегодняшний день алгоритм ведения пациентов с ОА состоит из четырех шагов.
Шаг 1. Применение нефармакологических методов.
К немедикаментозным методам относятся физиотерапия, мануальная терапия, бальнеотерапия и физическая активность (например, прогулки).
Однако согласно выводам экспертов ESCEO при оказании первичной медицинской помощи для купирования боли при легком или умеренном ОА следует использовать парацетамол до 3 г/сут.
Применение парацетамола свыше указанной дозы ассоциируется с высоким риском госпитализаций по поводу язвенного дефекта, перфорации или кровотечения в желудочно-кишечном тракте (относительный риск (ОР) 1,20 при 95%-ном доверительном интервале (ДИ) 1,03–1,40).
Длительный прием высоких доз препарата приводит к поражению почек у женщин (OР 2,04 (95% ДИ 1,28–3,24)) – скорость клубочковой фильтрации снижается более чем на 30 мл/мин/1,73 м2, повышению риска развития артериальной гипертензии и у женщин (ОР 2,00 (95% ДИ 1,52–2,62)), и у мужчин (ОР 1,34 (95% ДИ 1,00–1,79)).
Не случайно уже на этом этапе лечения эксперты ESCEO рекомендуют терапию структурно-модифицирующими препаратами с добавлением при необходимости парацетамола для краткосрочного купирования боли. Среди лекарственных средств указанной группы наибольшая доказательная база собрана в отношении глюкозамина сульфата и хондроитина сульфата. Глюкозамина сульфат оказался эффективнее плацебо не только в снижении выраженности боли (стандартизованное среднее различие (ССР) 1,11 (95% ДИ -1,66– -0,57)), но и в улучшении функции суставов (оценивали по индексу Лекена) (ССР -0,47 (95% ДИ -0,82– -0,12)) [3–5].
Систематические обзоры свидетельствуют, что препараты хондроитина сульфата могут оказывать влияние на структурные изменения сустава, их эффективность в отношении симптомов заболевания сопоставима с эффективностью глюкозамина сульфата [4–8]. В исследовании, проведенном М. Hochberq (2014), установлено, что комбинация хондроитина сульфата и глюкозамина сульфата не уступает по силе действия целекоксибу после 180 дней терапии [7].
Таким образом, глюкозамина сульфат и хондроитина сульфат можно рассматривать как средства, обеспечивающие долгосрочный симптом-модифицирующий эффект при ОА, защиту суставного хряща и замедление прогрессирования заболевания [8, 9]. Кроме того, частота нежелательных явлений на фоне такой терапии сопоставима с частотой побочных эффектов при приеме плацебо.
Если на фоне адекватной базисной терапии SYSADOAs (с доказанной эффективностью) и применения парацетамола в качестве экстренной аналгезии симптомы ОА сохраняются, в схему лечения могут быть добавлены топические НПВП или капсаицин. Результаты прямых сравнительных исследований свидетельствуют, что топические НПВП столь же эффективны, что и системные (пероральные) НПВП. Обобщенный эффект в отношении снижения боли при наружном применении НПВП оценен в 0,44 (95% ДИ 0,27–0,62), хотя в отношении указанного показателя между разными препаратами наблюдается значительная гетерогенность (I2 – 69%).
Из-за более низкой системной абсорбции и, как следствие, лучшей переносимости топические НПВП могут иметь предпочтение перед системными (пероральными) НПВП. Это особенно важно для пациентов с ОА 75 лет и старше, лиц с сопутствующими заболеваниями или повышенным риском развития гастроинтестинальных, сердечно-сосудистых или почечных побочных реакций.
Терапия топическими НПВП характеризуется более низким риском развития нежелательных явлений со стороны желудочно-кишечного тракта. В то же время она ассоциируется с повышением частоты легких кожных реакций.
Шаг 2. Использование системных НПВП.
Пероральные НПВП традиционно занимают лидирующие позиции в фармакологическом лечении ОА. Они оказывают умеренное влияние на боль – от 0,29 (95% ДИ 0,22–0,35), что превышает таковое парацетамола – 0,14. Однако прием пероральных НПВП ассоциируется с трех- – пятикратным увеличением риска осложнений со стороны верхних отделов желудочно-кишечного тракта, в том числе перфорации пептической язвы, обструкции и кровотечения. В то же время разные НПВП существенно различаются по частоте гастроинтестинальных и сердечно-сосудистых нежелательных явлений. Экспертная группа ESCEO пациентам с низким (нормальным) гастроинтестинальным риском рекомендует назначать либо неселективные НПВП с/без ингибиторов протонной помпы (ИПП), либо селективные ингибиторы циклооксигеназы (ЦОГ) 2.
Необходимо отметить, что повышение риска осложнений со стороны верхних отделов желудочно-кишечного тракта обусловлено такими факторами, как пожилой возраст, пептическая язва в анамнезе, сопутствующее лечение глюкокортикостероидами (ГКС), аспирином или антикоагулянтами.
В реальной клинической практике выбор перорального НПВП основывается на оптимальном соотношении эффективности, безопасности и стоимости. Одним из препаратов, обладающих таким оптимальным соотношением, является нимесулид (Нимесил) [9–15].
Молекула нимесулида в отличие от молекул других препаратов группы НПВП имеет свойства основания. Это затрудняет ее проникновение в слизистую верхних отделов желудочно-кишечного тракта, как следствие, уменьшается возможность контактного раздражения.
Благодаря высокой биодоступности уже через 30 минут после приема концентрация препарата в крови составляет 50% от пиковой и отмечается выраженный обезболивающий эффект. Максимальная концентрация в плазме крови достигается в среднем через два-три часа, соответственно к этому времени развивается и максимальное анальгетическое действие [12].
Нимесулиду свойственны эффекты, не связанные с класс-специфическим влиянием на синтез простагландинов и определяющие его терапевтическое своеобразие: подавление синтеза провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли альфа), активности металлопротеиназ, ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при ОА, блокирование фосфодиэстеразы 4, повышающей активность клеток воспалительной агрессии – макрофагов и нейтрофилов, а также антигистаминное действие.
Рандомизированные клинические исследования подтверждают мощный и быстрый анальгетический и противовоспалительный эффекты нимесулида. Это определяет целесообразность использования нимесулида (Нимесила) при ОА. Так, терапия нимесулидом у больных ОА коленного и тазобедренного суставов способствовала снижению концентрации маркеров катаболизма хрящевой ткани [13, 14].
Кроме того, отмечено положительное влияние нимесулида на динамику артериального давления (оценивалось по данным суточного мониторирования) у пациентов с артериальной гипертензией. Через 30 дней наблюдения у получавших нимесулид в отличие от принимавших диклофенак не зафиксировано дестабилизации артериального давления. Так, на фоне нимесулида среднее систолическое артериальное давление снизилось с 143 до 140 мм рт. ст., диклофенака – повысилось с 147 до 156 мм рт. ст. (p < 0,05) [13].
Принципиальное значение для оценки безопасности препарата имеют результаты его длительного применения. Так, в работе P. Locker и соавт. 199 пациентов с ОА получали нимесулид 200 мг или этодолак 600 мг в течение трех месяцев. Терапевтический потенциал нимесулида оказался выше: его действие оценили как хорошее или превосходное 80% больных. Этодолаку аналогичную оценку дали 68% пациентов. Несмотря на то что этодолак относится к селективным НПВП, частота побочных эффектов в группах терапии не различалась [14].
На данный момент проведено недостаточно серьезных эпидемиологических исследований, в которых сравнивалась бы гепатотоксичность НПВП. Наиболее значимое среди них – масштабное популяционное исследование, проведенное G. Traversa и соавт. Ученые проанализировали частоту гепатотоксических реакций с 1997 по 2001 г. у 397 537 больных. Суммарное число таких осложнений составило 29,8 на 100 тыс. пациенто-лет. Следовательно, ОР тяжелых гепатотоксических реакций для НПВП составляет 1,4. Для сравнения – частота осложнений со стороны печени при использовании нимесулида составила 35,3 на 100 тыс. пациенто-лет. Это оказалось ниже, чем у диклофенака – 39,2 на 100 тыс. пациенто-лет, кеторолака – 66,8 и ибупрофена – 44,6 [15, 16].
В ретроспективном исследовании, проведенном в Научно-исследовательском институте ревматологии им. В.А. Насоновой, у 322 больных, принимавших нимесулид не менее 12 месяцев, не было отмечено эпизодов клинически выраженной патологии печени: желтухи, гепатомегалии, симптомов печеночной недостаточности. Существенное – более чем двукратное по сравнению с нормальным уровнем – повышение печеночных ферментов зафиксировано лишь у семи (2,2%) больных ревматоидным артритом. Необходимо отметить, что эти пациенты помимо нимесулида получали цитотоксические препараты (метотрексат или лефлуномид) [17, 18].
Исходя из вышесказанного, можно сделать вывод: Нимесил – универсальное средство для лечения ОА, в котором сочетаются быстрота действия, хороший анальгетический и значимый противовоспалительный эффекты. По переносимости Нимесил превосходит многие традиционные НПВП. Препарат относительно редко вызывает диспепсию и другие осложнения со стороны желудочно-кишечного тракта.
Избегать применения пероральных НПВП экспертная группа ESCEO рекомендует пациентам с повышенным риском развития нежелательных явлений со стороны почек, например с хронической болезнью почек и скоростью клубочковой фильтрации ниже 30 мл/мин/1,73 м2.
Из соображений безопасности и в отсутствие долгосрочных исследований рекомендуется использовать пероральные НПВП эпизодически или курсами, в минимальной эффективной дозе и в течение как можно более короткого времени, необходимого для контроля над симптомами.
При противопоказаниях к НПВП или сохранении симптомов, несмотря на проводимое лечение, следует рассмотреть возможность внутрисуставного введения препаратов гиалуроновой кислоты или ГКС.
Экспертная группа ESCEO указывает, что гиалуроновую кислоту необходимо назначать пациентам с ОА коленного сустава легкой или умеренной степени тяжести, а также лицам с более тяжелым заболеванием, которым противопоказано тотальное эндопротезирование коленного сустава или которые хотят отсрочить операцию. Препараты гиалуроновой кислоты для интраартикулярного введения показаны в отсутствие признаков острого воспаления. При наличии таковых в качестве терапии первой линии внутрь сустава следует вводить ГКС. Одновременное интраартикулярное введение гиалуроновой кислоты и ГКС не рекомендуется из-за риска межлекарственного взаимодействия. Таковое станет возможным, когда будет доказана их фармацевтическая совместимость.
Шаг 3. Предоперационная терапия.
Пациентам, ожидающим операцию, рекомендуется краткосрочное применение опиоидных препаратов (например, трамадола) и антидепрессантов.
Слабые опиоиды назначаются при тяжелых симптомах ОА.
В отличие от обычных опиатов трамадол редко вызывает угнетение дыхания и зависимость. Кроме того, его использование не ассоциируется с повышением риска гастроинтестинальных и сердечно-сосудистых осложнений, характерных для НПВП.
Наиболее частые побочные эффекты терапии трамадолом – тошнота и головная боль. В некоторых случаях они могут стать причиной прекращения лечения либо недостаточного обезболивания.
Риск побочных реакций может быть снижен благодаря медленной титрации дозы и приему трамадола медленного высвобождения (от 50 до 100 мг/сут в течение семи дней).
По мнению экспертов ESCEO, кратковременное применение трамадола может быть показано пациентам с очень выраженными симптомами ОА.
Антидепрессанты, в том числе дулоксетин, используют при хроническом болевом синдроме. Они обладают центральным механизмом действия, влияя на болевые нейромедиаторы (серотонин и норадреналин). Однако доказательства эффективности антидепрессантов при ОА ограничены, а частота нежелательных явлений достаточно высока.
Шаг 4. Замена сустава и другие хирургические процедуры.
В качестве альтернативы хирургическому вмешательству на этом этапе предлагается назначать опиоидные анальгетики для перорального или трансдермального введения.
В рекомендациях ESCEO за 2016 г. рассмотрены все современные методы лечения ОА, которые включены в алгоритм ведения больных. Исследовательская группа ESCEO полагает, что представленная мультимодальная программа должна применяться у всех больных.
Когда пациент переходит ко второму шагу – терапии пероральными НПВП, лечение, предусмотренное на первом шаге, должно продолжаться, так как оно по-прежнему влияет на течение заболевания.
Аналогичным образом решение о необходимости внутрисуставного введения гиалуроновой кислоты и ГКС (при сохраняющейся симптоматике) не должно приводить к отмене предыдущего лечения.
При переходе к третьему шагу терапии из-за недостаточного контроля симптомов основные мероприятия первых двух шагов могут быть продлены, поскольку возможен отсроченный положительный эффект. В алгоритме не представлены некоторые группы препаратов, включая бисфосфонаты. Фаза III клинических исследований эффективности ризедроновой кислоты в отношении контроля симптомов и прогрессирования структурных изменений суставов не закончена, поэтому невозможно сделать окончательный вывод о ее терапевтической активности.
Миорелаксанты также не были включены в алгоритм из-за отсутствия соответствующих исследований при ОА.
Таким образом, выбор рациональной терапии ОА в каждом конкретном случае определяется с учетом предикторов ответа на проводимую терапию, темпов рентгенологического прогрессирования, параметров, влияющих на прогноз, механизмов боли, коморбидного фона, психологического статуса, а также баланса риска и пользы назначаемых препаратов.
ESCEO-Relevant Recommendations for the Treatment of Osteoarthritis of the Knee
I.B. Belyayeva, V.I. Mazurov, K.V. Raymuyev
North-West State Medical University named after I.I. Mechnikov
Contact person: Irina Borisovna Belyayeva, belib@mail.ru
According to the latest ESCEO recommendations for osteoarthritis treatment, it supposes the use of non-pharmacological, pharmacological and, if necessary, surgical methods. Pharmacological therapy, in turn, is being divided into symptomatic and structural-modifying. Symptomatic drugs (fast action) include analgesics, opioids, non-steroidal anti-inflammatory drugs. The article provides the results of studies showing that Nimesil has a rapidly developing clinical effect, high safety profile and can be recommended for symptomatic treatment of osteoarthritis of the knee joint.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.