Актуальные вопросы дифференциальной диагностики крапивницы
- Аннотация
- Статья
- Ссылки
- English
В типичных ситуациях диагностика крапивницы не вызывает затруднений у клиницистов. Однако при атипичных проявлениях заболевания возникают сложности дифференциальной диагностики, обусловленные вариабельностью клинических проявлений, сложными междисциплинарными аспектами патологии и недостаточной информированностью практикующих врачей о редких заболеваниях и синдромах, протекающих с уртикарными или уртикароподобными высыпаниями.
Перечислены отличительные особенности заболеваний, сопровождаемых уртикарными элементами или имитирующих крапивницу. Представлен дифференциально-диагностический алгоритм
при атипичных характеристиках уртикарных высыпаний, а также при сочетании крапивницы и лихорадки, крапивницы и суставного синдрома, крапивницы и гипотензии и/или внезапной гиперемии кожных покровов. Особое внимание уделено принципам диагностики и генно-инженерной биологической терапии аутовоспалительных заболеваний. В перспективе повышение точности фенотипирования и дифференциальной диагностики крапивницы возможно при сочетании клинического обследования, лабораторных и гистологических исследований с геномными и постгеномными технологиями.
В типичных ситуациях диагностика крапивницы не вызывает затруднений у клиницистов. Однако при атипичных проявлениях заболевания возникают сложности дифференциальной диагностики, обусловленные вариабельностью клинических проявлений, сложными междисциплинарными аспектами патологии и недостаточной информированностью практикующих врачей о редких заболеваниях и синдромах, протекающих с уртикарными или уртикароподобными высыпаниями.
Перечислены отличительные особенности заболеваний, сопровождаемых уртикарными элементами или имитирующих крапивницу. Представлен дифференциально-диагностический алгоритм
при атипичных характеристиках уртикарных высыпаний, а также при сочетании крапивницы и лихорадки, крапивницы и суставного синдрома, крапивницы и гипотензии и/или внезапной гиперемии кожных покровов. Особое внимание уделено принципам диагностики и генно-инженерной биологической терапии аутовоспалительных заболеваний. В перспективе повышение точности фенотипирования и дифференциальной диагностики крапивницы возможно при сочетании клинического обследования, лабораторных и гистологических исследований с геномными и постгеномными технологиями.
Термин «крапивница» используется для описания гетерогенной группы заболеваний, симптомом которых является волдырь и/или ангиоотек [1]. Медико-социальное значение крапивницы обусловлено достаточно высокой распространенностью (1–5% населения), поражением лиц преимущественно трудоспособного возраста (20–40 лет), выраженным снижением качества жизни пациентов и значительными затратами здравоохранения [2]. В связи с актуальностью проблемы в последние годы реализованы отечественные и международные инициативы, направленные на оптимизацию диагностики и ведения больных крапивницей. Ежегодно 1 октября проводится Всемирный день крапивницы, получивший широкое освещение в прессе. В Российской Федерации в 2016 г. утверждены Федеральные клинические рекомендации по диагностике и лечению крапивницы [3]. В декабре 2016 г. в Университете Charite в Берлине состоялся Третий GA2LEN Всемирный форум крапивницы (GUF2016) с участием свыше 300 специалистов из более чем 50 стран мира с целью обновления международных согласительных документов по диагностике и лечению крапивницы.
В классических случаях диагноз крапивницы не вызывает затруднений и устанавливается при сборе анамнеза и физикальном обследовании пациента. Однако клинические ситуации, требующие дифференциальной диагностики крапивницы с другими заболеваниями, в том числе аутовоспалительными, нередко представляют диагностические трудности для практикующих врачей. Вариабельность клинических проявлений, сложные междисциплинарные аспекты дифференциального диагноза и недостаточная информированность врачей о редких заболеваниях, сопровождающихся крапивницей, могут приводить к ошибочным диагнозам и несвоевременному назначению адекватной терапии.
Вопрос дифференциальной диагностики крапивницы приобрел особую актуальность с внедрением в клиническую практику генно-инженерной биологической терапии при хронической спонтанной крапивнице (ХСК). Генно-инженерная биологическая терапия (ГИБП) является высокотехнологичным и высокозатратным методом лечения ХСК, поэтому должна проводиться пациентам с подтвержденным диагнозом. В сложных клинических случаях при возникновении подозрений необходимо исключить другую патологию до назначения ГИБП. Кроме того, при неэффективности биологической терапии необходимы ревизия диагноза ХСК и проведение тщательного дифференциального диагноза.
Разработка инновационных диагностических технологий в эру персонализированной медицины ставит новые вопросы в области дифференциальной диагностики крапивницы [4]. Представляется актуальным изучение роли геномных и постгеномных исследований с целью верификации диагноза, фенотипирования, дифференциальной диагностики и персонализированной терапии крапивницы [5].
Принципы дифференциальной диагностики крапивницы
Своевременность дифференциальной диагностики крапивницы является основополагающим условием ведения пациентов. Ранняя диагностика ряда заболеваний, сопровождающихся крапивницей, позволяет своевременно начать патогенетически обусловленную терапию и предупредить осложнения.
При дифференциальной диагностике целесообразно применение современных методов обследования. Например, недостаточная информативность рутинных гистологических методов в ряде случаев способна привести к ошибочным диагнозам. В таких случаях применение дополнительных методов исследования (иммуногистохимическое исследование, генотипирование) позволяет уточнить вероятность того или иного диагноза.
Учитывая наличие переходных форм между крапивницей и уртикарным васкулитом (УВ), иногда уточнить диагноз можно только при динамическом наблюдении пациентов. Нередко вопрос о необходимости дифференциальной диагностики крапивницы возникает при резистентности к проводимой терапии. Таким образом, клиническая эффективность антигистаминных препаратов или ГИБП также может иметь диагностическое значение.
При проведении дифференциальной диагностики крапивницы имеет значение своевременное применение биопсии пораженной кожи и дополнительных методов для ранней диагностики заболеваний, имитирующих крапивницу. В перспективе методы дифференциальной диагностики будут дополнены мультиплексными исследованиями аутореактивности к аутоантигенам и методами геномных и постгеномных исследований.
Дифференциальный диагноз крапивницы является междисциплинарной проблемой и проводится с участием аллергологов, дерматологов, ревматологов и инфекционистов. Междисциплинарный диалог позволяет дифференцировать коморбидность у больных ХСК от крапивницы, являющейся симптомом другого заболевания. Кроме того, необходимо помнить, что в отдельных случаях возможно сочетание нозологий у одного и того же пациента. Тщательный анализ клинических ассоциаций у отдельного пациента и междисциплинарный подход имеют значение для верификации диагноза и оптимизации терапии.
Клинические особенности крапивницы и показания к дифференциальной диагностике
Основным симптомом крапивницы является волдырь, который представляет собой ограниченный поверхностный отек сосочкового слоя дермы. У большинства пациентов волдыри сочетаются с отеками глубоких слоев дермы или подслизистого слоя – ангиоотеками. У некоторых пациентов ангиоотеки, без волдырей, могут быть единственным проявлением заболевания.
Волдыри при крапивнице могут быть от бледно-розового до ярко-красного цвета. По мере развития элементов отмечается более бледный центр волдыря с гиперемированной периферией. У больных крапивницей размеры волдырей варьируют от нескольких миллиметров до десятков сантиметров. При распространенных высыпаниях возможно слияние уртикарных элементов с формированием гигантской крапивницы. Уртикарные высыпания сопровождаются зудом. При интенсивном зуде у пациентов нарушается сон.
Для крапивницы характерен мономорфный характер высыпаний: кожный процесс представлен только уртикарными высыпаниями. При разрешении волдырей не формируются вторичные элементы. При крапивнице волдыри бесследно разрешаются в течение суток.
Ангиоотеки – бледные ограниченные отеки подкожного слоя дермы или подслизистого слоя. Ангиоотеки преимущественно возникают в области лица, кистей, стоп и гениталий. При крапивнице ангиоотеки также бесследно исчезают в течение 24–36 часов.
При дифференциальной диагностике крапивницы необходимо обращать внимание на атипичные характеристики уртикарных высыпаний [6]. Для них характерно длительное персистирование – свыше 24 часов. В клинической практике для уточнения длительности персистирования отдельных волдырей пациента просят обвести маркером границы высыпаний на ограниченном участке тела и зафиксировать время их разрешения. Фиксированные высыпания не являются крапивницей.
Атипичные уртикарные высыпания сопровождаются преимущественно жжением и болезненностью, в меньшей степени зудом. В некоторых случаях зуд полностью отсутствует. Для атипичных уртикарных высыпаний характерно разрешение с формированием гиперпигментаций, гемосидеринового окрашивания, петехий. Атипичной характеристикой также является сочетание волдырей с другими первичными элементами сыпи. Например, уртикарный васкулит может протекать с формированием как волдырей, так и отдельных буллезных элементов [7].
При выраженных высыпаниях больные крапивницей могут отмечать слабость, недомогание. У некоторых из них возможны озноб и лихорадка. Однако выраженная длительная лихорадка несвойственна крапивнице и требует проведения дифференциальной диагностики с уртикарным васкулитом, заболеваниями соединительной ткани и аутовоспалительными заболеваниями (АВЗ). Некоторые пациенты с крапивницей могут предъявлять жалобы на уртикарные высыпания в сочетании с внезапными эпизодами покраснения лица и верхней половины туловища, гипотензию, обмороки и диспепсические проявления. Такие клинические ситуации необходимо дифференцировать с анафилаксией, системным мастоцитозом и синдромом моноклональной активации тучных клеток.
Внимательный осмотр пациента, фотографии кожного процесса, анализ характеристик высыпаний и анамнестических данных позволяют своевременно выявить атипичные характеристики уртикарных высыпаний у пациентов. Таким больным проводится дифференциальная диагностика крапивницы с широким спектром заболеваний, которые сопровождаются уртикарными высыпаниями. Дифференциальная диагностика крапивницы также должна проводиться у пациентов с тяжелым торпидным течением заболевания и неэффективностью проводимой терапии.
Дифференциальная диагностика крапивницы с заболеваниями, сопровождающимися уртикарными высыпаниями
Для дифференциальной диагностики крапивницы практическому врачу важно знать особенности клинической картины и течения заболеваний, сопровождающихся уртикарными высыпаниями.
Уртикарный васкулит диагностируется примерно у 10% пациентов, обследованных по поводу ХCК [8]. УВ характеризуется рецидивирующими уртикарными высыпаниями и гистопатоморфологическими признаками лейкоцитокластического васкулита с преимущественным поражением посткапиллярных венул. Волдыри при УВ сопровождаются пурпурой, резидуальным гемосидериновым окрашиванием, иногда гиперпигментацией. Волдыри сохраняются более 24 часов. Зуд не характерен, чаще беспокоят жжение и болезненность. При УВ помимо уртикарных элементов могут наблюдаться ангиоотек, livedo reticularis, иногда буллы [7, 9]. Наряду с кожными симптомами пациенты иногда отмечают лихорадку, недомогание, миалгию и артралгии. Нередко кожные элементы при УВ внешне неотличимы от высыпаний при ХСК. Для подтверждения диагноза УВ требуется гистологическое исследование биоптата пораженной кожи. Типичными гистологическими признаками УВ являются лейкоцитарная (преимущественно нейтрофильная) инфильтрация, фрагментированные лейкоциты (лейкоцитоклазия), фибриновые отложения в сосудистой стенке и вокруг сосудов, поврежденные и отечные эндотелиальные клетки посткапиллярных венул и экстравазация эритроцитов [8]. С помощью иммунофлюоресцентной микроскопии визуализируют отложения иммуноглобулинов и компонентов комплемента вокруг кровеносных сосудов у большинства больных УВ [7, 8]. Хронический УВ необходимо отличать от нейтрофильной крапивницы, не ассоциированной с васкулитом. Лечение больных УВ разнообразно – от Н1-антигистаминных препаратов до иммунодепрессантов в зависимости от тяжести заболевания.
В некоторых случаях крапивницу необходимо дифференцировать с буллезным пемфигоидом [10]. Чаще болеют пациенты после 60 лет. В начале заболевания на продромальном (небуллезном) периоде заболевания клинические проявления разнообразны и могут включать волдыри, что способно приводить к диагностическим ошибкам [11]. Такие элементы могут быть единственным проявлением заболевания на протяжении нескольких месяцев. На буллезной стадии заболевания наблюдаются везикулезные и буллезные высыпания. На этой стадии нередко встречаются уртикарные бляшки c кольцевидными и фигурными очертаниями. Возможна уртикарная форма буллезного пемфигоида с уртикарными бляшками как единственным проявлением заболевания. При уртикарной форме заболевания не исключена трансформация в генерализованную буллезную форму [11].
Многоформная экссудативная эритема – острое заболевание кожи и слизистых оболочек, характеризующееся полиморфными высыпаниями и имеющее тенденцию к сезонности высыпаний и рецидивирующему течению [12]. В клинической картине наблюдаются полиморфные элементы, включая пятна, папулы, везикулы. Характерны высыпания в форме мишени. Типична локализация высыпаний в области тыльной поверхности кистей, ладоней, стоп, лица, коленей и предплечий. У большинства пациентов поражаются слизистые оболочки. При ознакомлении с анамнезом необходимо уточнить взаимосвязь с герпетической или микоплазменной инфекцией или приемом лекарственных препаратов (сульфаниламиды, нестероидные противовоспалительные препараты (НПВП), тетрациклин, пенициллин и др.) [12].
Дифференциальная диагностика Т-клеточной лимфомы кожи и крапивницы может представлять трудности в связи с полиморфизмом клинической картины Т-клеточной лимфомы, способной имитировать различные хронические заболевания кожи [13]. Т-клеточная лимфома характеризуется клональной Т-клеточной пролиферацией. Т-клеточная лимфома нередко манифестирует распространенным кожным зудом. На ранних стадиях заболевания кожные инфильтраты, разрешающиеся в течение 24–48 часов и сопровождающиеся зудом, иногда ангиоотеком, могут интерпретироваться как крапивница [14]. Сложность диагностики Т-клеточной лимфомы также обусловлена гистологическими признаками неспецифического хронического воспаления и реактивного лимфаденита на ранних стадиях заболевания [15]. Для своевременной диагностики используют иммунофенотипирование и генотипирование для выявления клональных Т-лимфоцитов.
Пигментная крапивница (также известная как макулопапулезная форма кожного мастоцитоза) – наиболее распространенная форма кожного мастоцитоза. Пигментная крапивница характеризуется красно-коричневыми макулами и папулами, при механическом раздражении которых формируется волдырь (синдром Дарье) [16]. У некоторых пациентов также наблюдается уртикарный дермографизм на внешне неизмененной коже.
В основном пигментной крапивницей болеют дети. Манифестация до года наблюдается в 80% случаев [16]. Прогноз заболевания благоприятный. Как правило, симптомы разрешаются в подростковом возрасте [17]. В типичных случаях диагноз не вызывает затруднений у опытных специалистов, тем не менее в ряде клинических ситуаций возникает необходимость в дифференциальной диагностике с крапивницей [17]. Например, на ранних этапах заболевания высыпания могут напоминать волдыри, но более стойкие и в большей степени гиперпигментированные, чем эритематозные [17]. Со временем высыпания приобретают бурое окрашивание. Гиперпигментации могут сохраняться достаточно длительно, затем бледнеют.
Системные симптомы связаны с высвобождением медиаторов тучных клеток и при пигментной крапивнице присутствуют не всегда. Системные проявления обычно характеризуются гиперемией, зудом, уртикарными элементами (отеком и покраснением кожных высыпаний пигментной крапивницы), эпизодами внезапного покраснения лица и верхней части туловища, тахикардией, рвотой, обмороками и шоком. Подобные симптомы могут провоцироваться применением радиоконтрастных средств, опиатов, общей анестезией и ужалением перепончатокрылых насекомых [16].
Диагноз пигментной крапивницы устанавливается на основании характерных клинических проявлений (типичные макулопапулезные высыпания и выраженный симптом Дарье) и результатов гистологического и иммуногистохимического исследований биоптатов пораженной кожи. В биопсийном материале наблюдается 10–20-кратное увеличение количества тучных клеток в области высыпаний при окрашивании толуидином синим, по Романовскому – Гимзе, определяется активность хлорацетилэстеразы [16]. Необходимо отметить, что при ХСК наблюдается трехкратное увеличение количества тучных клеток в биоптатах кожи [18]. При дифференциальной диагностике необходимо учитывать типичное отсутствие воспалительных инфильтратов в дерме, за исключением небольшого количества эозинофилов в редких случаях. Иммуногистохимическое исследование триптазы в биоптатах кожи считается предпочтительным для диагностики мастоцитоза. При обширном поражении кожи (более 50% поверхности тела) и высокой плотности высыпаний в наиболее пораженной области у пациентов могут наблюдаться органомегалия, повышение триптазы в сыворотке и изменения в аспиратах костного мозга [16]. Пациенты только с кожным мастоцитозом обычно имеют уровень триптазы менее 14 нг/мл [16]. Иногда повышение триптазы наблюдается у ряда пациентов с ХСК. В спорных ситуациях может потребоваться определение c-kit-мутации в биоптатах кожи и/или костного мозга.
Ранняя локализованная форма клещевого боррелиоза (болезнь Лайма) способна манифестировать мигрирующей эритемой, которую необходимо дифференцировать от крапивницы [19]. Мигрирующая эритема является характерным кожным симптомом ранней стадии болезни Лайма. Мигрирующая эритема может сопровождаться зудом или жжением. На ранней стадии клещевого боррелиоза у пациентов наблюдаются невыраженный интоксикационный синдром, катаральные явления и увеличение региональных лимфатических узлов, близких к входным воротам инфекции. При мигрирующей эритеме гистологическая картина в биопсийном материале представлена поверхностными или диффузными лимфоцитарными инфильтратами с привлечением плазматических клеток и может иметь некоторое сходство с гистологическими изменениями при крапивнице. Нередко мигрирующая эритема остается нераспознанной, что приводит к ошибочным диагнозам [20].
При диагностике болезни Лайма анамнестические данные могут указывать на факт пребывания в эпидемиологически опасных зонах [20]. Серологическая диагностика клещевого боррелиоза характеризуется недостаточной информативностью, поскольку инфицирование Borrelia burgdoferi может протекать без формирования специфических антител [21]. В связи с этим целесообразно проведение ПЦР-диагностики для выявления возбудителя в биопсийном материале, периферической крови и синовиальной жидкости. Ранняя диагностика болезни Лайма и адекватная антибиотикотерапия имеют решающее значение для предупреждения рецидивов и поздних осложнений заболевания.
Полиморфные высыпания беременных (известные еще как зудящие уртикарные папулы и бляшки беременных) характеризуются возникновением на коже интенсивно зудящих отечных эритематозных папул и бляшек. Высыпания чаще возникают у первородящих в третьем триместре беременности и разрешаются на 7–10-е сутки после родов [22]. Высыпания преимущественно локализуются в области живота, бедер и ягодиц, часто – в области стрий. Гистологические изменения в биопсийном материале включают спонгиоз, отек сосочкового слоя дермы и периваскулярную лимфоцитарную инфильтрацию [23].
Фиксированные лекарственные высыпания характеризуются возникновением высыпаний с одной и той же локализацией при повторном применении причинно-значимого лекарственного средства. Причинами фиксированных высыпаний могут быть НПВП, сульфаниламиды и другие препараты [24]. Трудности в дифференциальной диагностике с крапивницей нередко обусловлены эволюцией кожных элементов при фиксированных лекарственных высыпаниях, которые на разных этапах могут напоминать уртикарные. Начальные элементы представлены пятнами темно-красного цвета с синюшным оттенком, которые способны прогрессировать в папулу или бляшку, иногда приводят к образованию пузыря. По мере разрешения высыпаний центр кожных элементов становится сероватого цвета, и регресс высыпаний происходит от центра к периферии с формированием гиперпигментации [24]. При разрешении элементы приобретают коричневую окраску и форму колец и гирлянд и могут напоминать уртикарные элементы. Высыпания сопровождаются зудом и жжением и способны персистировать до трех недель. При дифференциальной диагностике ведущее значение отводится сбору фармакологического анамнеза и тщательному физикальному обследованию.
Аутоиммунный прогестероновый дерматит встречается редко и характеризуется полиморфными высыпаниями, которые возобновляются циклически каждый месяц в лютеиновую фазу менструального цикла и спонтанно разрешаются во время менструации [25]. Нередко высыпания представлены уртикарными элементами. Считается, что в основе патогенеза лежит гиперчувствительность к прогестерону. Обострение заболевания может наблюдаться при использовании оральных контрацептивов, содержащих прогестерон. Отмечено увеличение частоты случаев аутоиммунного прогестеронового дерматита при экстракорпоральном оплодотворении [25]. Десенситизация к прогестерону описана как метод терапии аутоиммунного прогестеронового дерматита [25].
Ретикулярный эритематозный муциноз – редкое заболевание, возникающее у женщин среднего возраста и отличающееся возникновением эритематозных пятен, узелков и бляшек, располагающихся в виде сетчатых фигур [26]. У некоторых пациентов наблюдаются уртикароподобные пятна и папулы, требующие дифференциальной диагностики с крапивницей. Характерна локализация высыпаний на груди, верхних отделах живота и спине. При гистологическом исследовании биоптата кожи наблюдаются периваскулярные и перифолликулярные лимфоцитарные инфильтраты и отложения муцина между коллагеновыми волокнами в сосочковой части дермы и верхних слоях сетчатой части дермы [26]. Дифференциальный диагноз с крапивницей проводится на основании характерных клинических проявлений в сочетании с гистологическими признаками.
При сочетании крапивницы и лихорадки у пациентов необходимо проводить дифференциальную диагностику с системными заболеваниями соединительной ткани и АВЗ, включая криопирин-ассоциированные периодические синдромы (КАПС) и синдром Шнитцлера.
Уртикарные и уртикароподобные высыпания часто встречаются при системной красной волчанке (СКВ) и считаются кожными проявлениями СКВ, особенно в активную фазу заболевания. ХСК может быть одним из первых симптомов СКВ и на десять лет предшествовать ее манифестации [27]. По мнению некоторых авторов, ХСК может указывать на тяжелое течение и неблагоприятный прогноз СКВ [27].
При систематическом анализе 42 исследований установлено, что коморбидность ХСК и СКВ у взрослых варьируется от 0 до 21,9%, а коморбидность УВ и СКВ – от 0 до 20% [27]. У детей с СКВ ХСК наблюдается в 0–1,2% случаев. Данных о частоте выявления СКВ среди пациентов с ХСК в настоящее время недостаточно. При ретроспективном анализе 12 778 взрослых пациентов с ХСК выявлено, что больные ХСК имеют значительно более высокий риск развития СКВ (отношение шансов 14,6; p < 0,001) по сравнению с контрольной группой [28]. Оказалось, что риск развития СКВ у женщин с ХСК в 26,7 раза выше, чем у женщин контрольной группы.
Механизмы взаимосвязи ХСК и СКВ остаются недостаточно изученными. Новые сведения о патогенезе IgG- и IgE-опосредованной аутореактивности указывают на воспаление, аутоиммунитет, активацию системы комплемента и коагуляционного каскада как общие звенья патогенеза ХСК и СКВ [27].
Диагностика СКВ у больных с хроническими уртикарными или уртикароподобными высыпаниями может вызывать трудности у клиницистов. Больные ХСК с подозрением на СКВ обычно находятся под наблюдением аллергологов и дерматологов. Вариабельность клинических проявлений, слабовыраженные общие симптомы и малоинформативные лабораторные тесты затрудняют своевременную диагностику СКВ у пациентов с уртикарными или уртикароподобными высыпаниями [29]. Сочетание кожного процесса с артралгиями, общим недомоганием и умеренной лейкопенией имеет значение в диагностике СКВ у этих пациентов. Длительная непрерывная или волнообразная лихорадка в сочетании с суставным синдромом и кожным процессом должны вызывать подозрения о СКВ [29]. Таким образом, динамическое наблюдение, комплексное обследование и междисциплинарное ведение пациента совместно с ревматологом необходимы для своевременной диагностики СКВ у данной группы пациентов.
Уртикарные высыпания являются одним из ключевых симптомов некоторых аутовоспалительных заболеваний, изучению которых в последние годы врачи различных специальностей, в частности ревматологи, уделяют особое внимание. АВЗ представляют собой большую гетерогенную группу редких, часто генетически детерминированных состояний, которые проявляются периодическими приступами воспаления и манифестируют лихорадкой и клинической симптоматикой, напоминающей ревматическую, в отсутствие аутоиммунных или инфекционных причин [30]. В основе развития АВЗ лежат процессы аутовоспаления, о котором впервые заговорили D. Kastner и O`Shea в конце ХХ в. [31]. Мутации в определенных генах приводят к дисфункции естественного врожденного иммунитета, гиперпродукции провоспалительных цитокинов, в первую очередь интерлейкина (ИЛ) 1-бета, и развитию вследствие этого клинических и лабораторных признаков системного воспаления (асептическое воспаление кожи, слизистых и серозных оболочек, суставов, глаз, повышение скорости оседания эритроцитов (СОЭ), С-реактивного белка (СРБ), SAA и других острофазовых белков). В одной из современных классификаций АВЗ, представленных в литературе, выделена группа АВЗ, при которых системное воспаление сочетается с уртикарными высыпаниями [32]. Говоря о кожных проявлениях, в первую очередь следует остановиться на группе КАПС.
КАПС представляют собой группу редких врожденных АВЗ, которая включает в себя:
- семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (familial cold autoinflammatory syndrome/familial cold urticaria – FCAS/FCU);
- синдром Макла – Уэллса (Muckle – Wells syndrome – MWS);
- хронический младенческий нервно-кожно-артикулярный синдром/младенческое мультисистемное воспалительное заболевание (chronic infantile onset neurologic cutаneous articular/neonatal onset multisystem inflammatory disease – CINCA/NOMID) [33–35].
Частота встречаемости составляет около 1 на 1 млн, что делает эти заболевания истинно орфанными. Все три представителя данной группы обусловлены мутацией гена NLRP3 (CIAS1), расположенного на длинном плече первой пары хромосом и кодирующего белок криопирин. Тип наследования – аутосомно-доминантный.
Перечисленные синдромы характеризуются ранним началом, как правило, на первом году жизни, рецидивирующей или персистирующей лихорадкой, уртикарной сыпью, широким спектром поражения суставов от артралгий до рецидивирующего и персистирующего артрита при тяжелых вариантах, а также (для MWS и CINCA/NOMID) поражением центральной и периферической нервной системы. Основным осложнением является амилоидоз, развивающийся вследствие хронического воспаления, который нередко является причиной гибели пациентов.
FCAS/FCU был впервые описан в 1940 г. R. Kile и H. Rusk [36], генетическая мутация открыта в 2001 г. [37]. Заболевание проявляется провоцируемыми воздействием холода эпизодами лихорадки, сыпи по типу крапивницы и артралгиями, иногда отмечаются конъюнктивит, головная боль. Cимптомы возникают через один-два часа после воздействия холода, достигают пика через 6–8 часов после начала и исчезают через 24 часа. Эпизоды чаще имеют место в холодное время года. Дебют заболевания в 95% случаев – в первые полгода жизни, часто с рождения. Случаи амилоидоза при FCAS/FCU исключительно редки (2–4%) [34, 36].
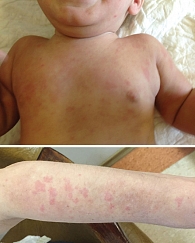
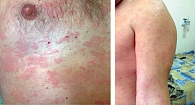
MWS является промежуточным по тяжести представителем КАПС и впервые был описан в 1962 г. T. Muckle и M. Wells [37]. Генетическая мутация открыта одновременно с FCAS в 2001 г. MWS характеризуется повторяющимися эпизодами лихорадки и уртикарной сыпи (рис. 1), ассоциированными с суставными и глазными проявлениями. Дебют заболевания, как правило, в детском возрасте, но не исключен и во взрослом состоянии. Суставной синдром варьируется от коротких эпизодов артралгий до рецидивирующих артритов крупных суставов. Частым симптомом атак является конъюнктивит, эписклерит или иридоциклит [34, 35]. Заболевание может протекать в виде повторяющихся эпизодов, однако нередко длительно персистирует. Нейросенсорная глухота развивается в 50–70% случаев, чаще в подростковом или молодом взрослом возрасте, и является одним из кардинальных диагностических признаков заболевания. Имеется описание семей с повторными случаями MWS, в том числе в России [38, 39]. АА-амилоидоз развивается у 20–40% пациентов.
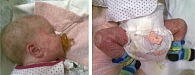
CINCA/NOMID-синдром является наиболее тяжелой формой КАПС. Впервые описан в 1973 г. J. Lorber, в 1980-е гг. представлен A.M. Prieur и C. Griscelli, а также D. Goldsmith как определенный клинический тип заболевания [40]. Ассоциация с NLRP3(CIAS1)-геном была обнаружена в 2002 г. Большинство случаев CINCA/NOMID встречались спорадически. Клинические проявления CINCA/NOMID-синдрома дебютируют уже на первом году жизни, во многих случаях – с рождения. Визитной карточкой CINCA/NOMID наряду с лихорадочным синдромом является триада, отражающая вовлечение в процесс трех больших систем организма: кожи, суставов и центральной нервной системы (ЦНС). Лихорадка часто ежедневная, рецидивирует на протяжении болезни и не бывает эпизодической, в редких случаях отсутствует [32, 34, 35, 40, 41]. Уртикарная сыпь, иногда с первых дней жизни, в отличие от других синдромов способна персистировать в течение длительного времени практически постоянно, может быть макулезно-папулезной (рис. 2). Поражение ЦНС имеет место почти у всех больных и может проявляться хроническим асептическим менингитом (90%). Более поздние неврологические нарушения включают повышение внутричерепного давления, приводящее к позднему закрытию переднего родничка, развитию гидроцефалии, отмечается задержка умственного развития и формирования высших когнитивных функций (70%). Типичный симптом, как и при MWS, – нейросенсорная глухота (75%), развивающаяся уже на ранних сроках заболевания. Характерным и частым является поражение суставов, у 2/3 пациентов в виде артралгий или транзиторного неэрозивного артрита. У 1/3–1/2 больных уже к двум годам жизни развивается тяжелая инвалидизирующая артропатия. Офтальмологические проявления включают конъюнктивит, передний (50%) или задний (20%) увеит, может развиться атрофия зрительного нерва, приводящая к снижению зрения у 25% и слепоте у половины больных. Прогноз у пациентов с синдромом CINCA/NOMID крайне неблагоприятный. Смертность в подростковом возрасте составляет около 20%, в основном из-за развития инфекционных осложнений или неврологических нарушений. Основным осложнением и причиной гибели пациентов является АА-амилоидоз, который у 20% развивается уже к 20 годам.
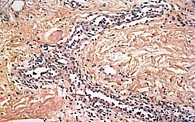
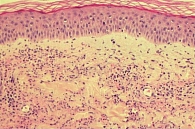
Для всех трех синдромов характерны практически постоянно, на протяжении всей жизни, сохраняющиеся кожные высыпания, однако они не являются аллергическими, их называют уртикароподобными или «псевдокрапивницей» [34]. Изменения, выявляемые при морфологическом исследовании кожи, характеризуются периваскулярной инфильтрацией нейтрофильного характера, отеком дермы, отсутствием признаков васкулита, тучных клеток и продуктов их деградации (рис. 3).
Важным дифференциально-диагностическим признаком служит повышение уровня острофазовых показателей (СОЭ, СРБ, SAA, лейкоцитоз). Аутоантитела (АНФ, РФ, АЦЦП и др.) не выявляются. Окончательно диагноз устанавливается с помощью молекулярно-генетической диагностики: типирование гена NLRP3.
Единственными эффективными препаратами для лечения КАПС являются ГИБП – ИЛ-1 ингибиторы (анакинра, рилонацепт, канакинумаб) (рис. 4).
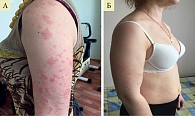
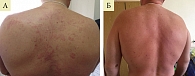
Еще одним заболеванием, требующим включения в дифференциально-диагностический поиск при наличии ярких кожных высыпаний, является синдром Шнитцлера (СШ), который по своим проявлениям очень напоминает КАПС, в первую очередь MWS. СШ – редкое АВЗ, относящееся к группе полигенных или мульфакториальных заболеваний (генетическая мутация не найдена), характеризуется рецидивирующими кожными уртикарными высыпаниями в сочетании с моноклональной гаммопатией, ассоциированными с клиническими и биологическими признаками воспаления и риском развития АА-амилоидоза и лимфопролиферативных заболеваний [43, 44]. Частота встречаемости СШ является орфанной, в мире описано всего около 250 больных [43]. В России также имеется немногочисленный опыт диагностики этого заболевания врачами различных специальностей – аллергологами-иммунологами, дерматологами, ревматологами, гематологами [44]. Патогенез СШ пока не совсем ясен. Одна из гипотез предполагает отложение IgM-парапротеина, приводящее к образованию иммунных комплексов и активации комплемент-каскада, что лежит в основе кожных проявлений СШ. Активно обсуждаются аутовоспалительные механизмы развития болезни [43, 45]. Кожные уртикарные высыпания обычно являются первым и основным симптомом болезни, локализуются на туловище, конечностях, ладонях и подошвах, в области головы и шеи, сохраняются в течение 12–24 часов, могут исчезать или сохраняться постоянно (рис. 5). К проявлениям системного воспаления при данном заболевании относятся также рецидивирующая лихорадка, боли в костях, мышцах, артралгии/артрит, лимфаденопатия, гепато- или спленомегалия, повышение уровня острофазовых маркеров (СОЭ, СРБ, SAA). Моноклональная IgM-гаммопатия является биологическим маркером болезни. При морфологическом исследовании кожи выявляется периваскулярная нейтрофильная инфильтрация в отсутствие лейкоцитокластического васкулита, характерного для истинного уртикарного васкулита, отека дермы (рис. 6) [43, 44, 46]. В лечении СШ используют, в частности, НПВП, глюкокортикостероиды (ГК), колхицин. Но они эффективны какой-то период времени и стойкой ремиссии не обечпечивают. В ряде публикаций показана эффективность ИЛ-1 ингибитора анакинры [45, 47]. Имеется также успешный зарубежный и российский опыт применения канакинумаба у больных СШ, который демонстрирует стойкое исчезновение сыпи (рис. 7), других воспалительных признаков, в том числе нормализацию уровня острофазовых маркеров [48, 49]. Однако на сегодняшний момент СШ не является официально зарегистрированным для терапии ингибиторами ИЛ-1, поэтому требуется дальнейшее изучение данной опции лечения у таких пациентов.
Острый фебрильный нейтрофильный дерматоз (синдром Свита) характеризуется лихорадкой, нейтрофильным лейкоцитозом и кожными высыпаниями в виде болезненных отечных узлов или папул красно-фиолетового цвета [50]. При слиянии элементов образуются бляшки неправильной формы с четкими границами. При разрешении кожа в центре элементов приобретает нормальный вид, и высыпания приобретают кольцевидную или дугообразную форму. Появлению высыпаний предшествуют лихорадка до 39–40 °С, недомогание. Динамика высыпаний характеризуется ухудшением высыпаний в течение нескольких недель с постепенным разрешением элементов. В периферической крови наблюдаются лейкоцитоз более 10000/мм3, увеличение количества нейтрофилов, повышение СОЭ и СРБ [50]. При гистологическом исследовании характерными признаками являются выраженная нейтрофильная инфильтрация дермы с образованием лейкоцитоклазии и значительный отек эпидермиса и сосочкового слоя дермы. Синдром Свита необходимо отличать от нейтрофильной крапивницы и УВ. Терапия проводится ГКС.
При сочетании крапивницы и приступов внезапной гиперемии лица и верхней половины туловища дифференциально-диагностические мероприятия должны быть направлены на исключение анафилаксии, системного мастоцитоза, синдрома моноклональной активации тучных клеток и карциноидного синдрома.
Системный мастоцитоз характеризуется накоплением тучных клеток в коже, костях и висцеральных оболочках и обусловлен D816V-мутацией в KIT-гене рецептора тирозинкиназы [51]. Данная мутация приводит к постоянной активации тирозинкиназы и неконтролируемой пролиферации тучных клеток [51]. При системном мастоцитозе наблюдаются внезапное покраснение кожи, особенно лица и верхней части туловища, крапивница, тошнота, рвота, предобморочные и обморочные состояния, анафилаксия [52].
Данные симптомы могут возникать спонтанно или после воздействия характерных триггеров (морфина, кодеина, алкоголя или трения больших участков кожи) [51]. Диагностические сложности могут возникать при симптомах, провоцируемых неспецифическими факторами (прием НПВП, холод, контакт с водой), что можно трактовать как острую эпизодическую или хроническую крапивницу [17]. В дифференциальной диагностике имеют значение повышенный уровень триптазы, характерная клиническая картина и исследование биоптата костного мозга для выявления мутации D816V в KIT-гене рецептора тирозинкиназы [51].
Синдром моноклональной активации тучных клеток характеризуется:
- симптомами, обусловленными высвобождением медиаторов тучных клеток;
- клональностью тучных клеток, доказанной путем выявления аберрантной популяции тучных клеток, экспрессирующих CD2/CD25, при биопсии костного мозга и/или мутации D816V в KIT-гене рецептора тирозинкиназы [51].
Между тем у пациентов с синдромом моноклональной активации тучных клеток не увеличено количество реактивных тучных клеток и не повышена пролиферация тучных клеток [51]. У таких пациентов не выполняются диагностические критерии для системного мастоцитоза. Термин «cиндром моноклональной активации тучных клеток» используют в практике с 2007 г. [51]. Клинически у пациентов наблюдаются рецидивирующие анафилактические эпизоды с гипотензией и обмороками, возникающие без видимых причин (идиопатическая анафилаксия) или после ужаления перепончатокрылых насекомых. Диагноз подтверждается с помощью биопсии костного мозга с проведением иммуногистохимического и молекулярно-генетического исследований.
Карциноидный синдром наблюдается примерно у 10% пациентов с карциноидными опухолями с локализацией в желудочно-кишечном тракте, реже в легких и редко в репродуктивной системе [52]. Карциноидный синдром сочетается с симптомами внезапного покраснения (особенно лица и верхней половины туловища), тяжелой гипотензией, тахикардией, бронхоспазмом, абдоминальными болями и диареей [52, 53]. Карциноидный синдром диагностируется при исследовании суточной экскреции 5-гидроксииндолуксусной кислоты в моче – главного метаболита серотонина. Уровень 5-гидроксииндолуксусной кислоты в моче повышен у пациентов с карциноидным синдромом в отличие от нормального уровня у больных мастоцитозом.
По определению EAACI/GA2LEN/EDF/WAO (2013 г.) у ряда больных крапивницей симптомы заболевания представлены изолированными ангиоотеками [1]. Дифференциальная диагностика изолированных ангиоотеков подробно рассмотрена в недавних публикациях [54, 55].
Алгоритм дифференциальной диагностики крапивницы в клинической практике
У большинства пациентов диагноз крапивницы не вызывает затруднений с учетом данных физикального обследования, анамнестических данных, результатов провокационных тестов и лабораторного обследования. Однако при обследовании в ряде случаев у врачей возникают диагностические сложности.
Прежде всего важно разграничить типичные и атипичные характеристики уртикарных высыпаний с целью дифференциальной диагностики с УВ. Наиболее частой причиной рецидивирующих уртикарных высыпаний является ХСК, но практикующему врачу необходимо помнить о ряде менее распространенных заболеваний, сопровождающихся уртикарными высыпаниями. У пациентов с уртикарными высыпаниями необходимо проводить тщательный дифференциальный диагноз между различными формами крапивницы и некоторыми синдромами/заболеваниями, сопровождающимися волдырными высыпаниями. Следует определить вариант течения болезни: острый или хронический. При ознакомлении с анамнезом важно выяснить, существует ли связь с физическими факторами, ассоциации с инфекцией, лекарственными средствами, пищевыми продуктами и т.д. Атипичные характеристики волдырей, такие как длительность сохранения более 24 часов, резидуальные явления (гиперпигментация), внекожные проявления (лихорадка, артралгии и т.д.), помогут обосновать проведение биопсии кожи.
На следующем этапе дифференциальной диагностики надо уточнить, представляют ли уртикарные высыпания у данного пациента редкие аутовоспалительные синдромы. При сочетании уртикарных высыпаний с интермиттирующими приступами лихорадки, болями в костях, суставах необходимо исключать СКВ и другие заболевания соединительной ткани. Кроме того, изменения лабораторных показателей у больных с уртикарными высыпаниями могут свидетельствовать о лежащей в основе патологии, например СКВ. Некоторые заболевания (буллезный пемфигоид) могут сопровождаться уртикароподобными высыпаниями, которые необходимо дифференцировать от крапивницы. У ряда пациентов волдыри могут сочетаться с другими кожными элементами, и полиморфность высыпаний необходимо учитывать при дифференциальной диагностике c многоформной экссудативной эритемой, полиморфными высыпаниями беременных и т.д. Уртикарные высыпания также могут сопровождаться системными симптомами, что требует исключения карциноидного синдрома, анафилаксии и синдрома моноклональной активации тучных клеток.
Таким образом, дифференциальная диагностика крапивницы крайне важна перед назначением биологической генно-инженерной терапии крапивницы и в случаях ее неэффективности, а также при атипичных проявлениях заболевания. Условием успешной дифференциальной диагностики крапивницы являются комплексное обследование и ведение пациента с учетом междисциплинарного подхода.
E.Yu. Borzova, S.О. Salugina
Russian Medical Academy of Continuous Postgraduate Education
V.A. Nasonova Research Institute of Rheumatology
Contact person: Elena Yuryevna Borzova, eborzova@gmail.com
Urticaria – a heterogenous group of diseases characterized by wheals and/or angioedema. The importance of the differential diagnosis in chronic spontaneous urticaria is highlighted by the need for a diagnosis verification before the biological treatment with monoclonal anti-IgE antibodies and in cases of a treatment failure. In typical urticaria cases, the diagnosis is mainly straightforward for clinicians. However, in atypical lesions, the differential diagnosis could be difficult due to variable clinical manifestations, complex interdisciplinary aspects of the disease and insufficient awareness of rare diseases and syndromes, associated with urticaria or urticaria-like lesions. The characteristic features of diseases associated with wealing or urticaria mimickers are outlined. A differential diagnosis algorithm is introduced for atypical urticaria cases and for difficult cases of urticaria and fever, urticaria and arthralgia, urticaria and hypotension and/or flushing. The diagnosis and the gene-engineered biological treatment of autoinflammatory diseases are particularly emphasized. In prospect, the precision of disease phenotyping and the differential diagnosis in urticaria is likely to be enhanced through the combined use of clinical assessments, a laboratory work-up and the histopathology with genomic and postgenomic technologies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.