Алгоритм персонифицированного лечения дистальной симметричной сенсорно-моторной полиневропатии у больных сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English

Эпидемиология сахарного диабета и диабетической полиневропатии
По оценке Международной диабетической федерации, в 2015 г. в мире насчитывалось 415 млн больных сахарным диабетом (СД), к 2040 г. их число увеличится до 642 млн. В ближайшие годы заболеваемость достигнет 10%.
Согласно данным Всероссийского эпидемиологического исследования распространенности СД 2 типа среди взрослого населения, сегодня в стране более 6 млн больных. При этом 54% из них не знают о наличии указанной патологии. Каждый пятый житель России находится в состоянии предиабета [1]. Крайне негативной тенденцией признано увеличение числа больных в возрастной категории до 50 лет.
На долю пациентов с СД 1 типа в среднем приходилось 5,6%, с СД 2 типа – 92,2%, с другими метаболическими нарушениями – 2,2%.
Диабетическая невропатия регистрировалась у 38,4% больных СД 1 типа и 19,0% больных СД 2 типа [2].
Внедрение современных методов диагностики способствует повышению выявляемости данного осложнения СД. Так, при обследовании 103 стационарных больных СД 2 типа диабетическая полиневропатия (ДПН) отмечалась в 74,7% случаев [3]. Высокая встречаемость ДПН могла быть связана с включением в исследуемую когорту только пациентов стационара. В других исследованиях с аналогичной популяцией больных частота диагностирования ДПН составляла чуть более 30% случаев [4]. Нельзя исключить и роль такого фактора, как степень тяжести СД. В последние годы в стационары госпитализируются более тяжелые пациенты.
Распределение исследуемой когорты в зависимости от стадии ДПН показало преобладание симптомной (второй) стадии (ДПН-2) – 41% случаев. На долю субклинической (первой) стадии (ДПН-1) приходилось лишь 33%. Распределение больных СД 2 типа в зависимости от стадии ДПН существенно отличалось от такового стационарных больных СД 1 типа. Частота встречаемости ДПН-1 среди них составила 45,8% случаев, ДПН-2 – 17,5% [5].
В 2015 г. в мире насчитывалось от 30 до 40 млн больных СД с симптомной дистальной симметричной диабетической полиневропатией.
В разных странах и этнических группах распространенность ДПН широко варьируется. Это может быть связано как с различием обследованных когорт, используемых критериев диагностики, так и с генетическими факторами, влияющими на формирование окислительного стресса [6, 7].
Диагностика диабетической полиневропатии и ее стадий
При выявлении ДПН необходимо опираться не на сенсорные феномены, отмечаемые больными (например, Общую шкалу симптомов (Total Symptom Score – TSS)) [8], а на наличие неврологического дефицита, который в большей мере отражает функциональное и морфологическое состояние соматических нервных волокон. Именно поэтому рекомендуется использовать Шкалу невропатических симптомов нижних конечностей (Neuropathy Impairment Score – Low Limb – NIS-LL), оценивающую силу мышц, состояние рефлексов и чувствительность в ногах.
В настоящее время оптимальным методом диагностики ДПН у пациентов с СД признана NIS-LL плюс семь электрофизиологических тестов [9].
При проведении электромиографии (ЭМГ) анализируются амплитуда М-ответа, скорость распространения возбуждения (СРВ) и резидуальной латенции (РЛ) при стимуляции двигательных нервов (n. peroneus, n. tibialis), а также амплитуда чувствительного (S) ответа и СРВ при стимуляции чувcтвительного нерва (n. suralis).
В зависимости от клинического состояния выделяют несколько стадий ДПН. Принципы определения стадий разработаны P.J. Dyck и подтверждены на совещании Торонтской группы ведущих экспертов по ДПН в 2010 г. [10, 11]. Так, наличие типичных жалоб в отсутствие неврологического дефицита свидетельствует о возможной ДПН, типичные жалобы в сочетании с неврологическим дефицитом без ЭМГ-обследования – о вероятной ДПН. Диагноз считается достоверным только при ЭМГ-подтверждении поражения периферических нервов.
Отсутствие жалоб, неврологического дефицита, а также изменений при ЭМГ-обследовании свидетельствует о нулевой стадии ДПН (ДПН-0). При ДПН-1 больной не предъявляет типичных жалоб, однако наблюдаются изменения при проведении ЭМГ, по крайней мере в двух нервах нижних конечностей, один из которых обязательно должен быть чувствительным (n. suralis). ДПН-1 в свою очередь подразделяют на a и b. ДПН-1а характеризуется изменениями, выявленными при проведении ЭМГ, в отсутствие жалоб и неврологических признаков, ДПН-1b – незначительным неврологическим дефицитом (снижение рефлексов или поверхностной чувствительности в ногах по NIS-LL). Признаками ДПН-2 считаются изменения при ЭМГ-обследовании, неврологический дефицит и типичные невропатические сенсорные феномены (боль, жжение, онемение, парестезии). Ее подразделяют на ДПН-2а (двигательные нарушения отсутствуют) и ДПН-2b (больной не может или с затруднением стоит и ходит на пятках). Если ДПН приводит к нарушению социальной и/или трудовой адаптации, ставится диагноз «ДПН третьей стадии» (ДПН-3).
В последние годы активно развиваются методы ранней диагностики поражения тонких волокон, которые в первую очередь повреждаются у больных СД. К инвазивным методам относится панч-биопсия кожи стоп с последующим иммуногистохимическим анализом плотности нервных волокон (маркер PGP 9,5), к неинвазивным – исследование плотности тонких нервных волокон в роговице с помощью конфокального микроскопа [12].
Такое детальное исследование тонких волокон в первую очередь необходимо для своевременной помощи больным, то есть на ранних стадиях поражения нервов.
Лечение
На первом месте в лечении пациентов с ДПН стоит контроль СД, что предусматривает достижение целевых значений глюкозы в крови [13]. Установлено, что у больных СД 1 типа достижение нормогликемии незначительно, но достоверно уменьшает риск развития ДПН, у больных СД 2 типа – достоверно не влияет на риск ее развития и течение. Поэтому не вызывает сомнений необходимость патогенетического лечения ДПН.
Патогенетическое лечение ДПН определяется механизмами поражения клеточных структур при гипергликемии. Согласно современным представлениям к патологии клеток при СД приводят два процесса: нарушение метаболизма и изменения кровотока в сосудах микроциркуляторной системы, тесно связанные с развитием окислительного стресса [14].
Основными патогенетическими препаратами, доказавшими свою эффективность в масштабных рандомизированных контролируемых исследованиях (РКИ), признаны антиоксиданты, способствующие уменьшению выраженности окислительного стресса (альфа-липоевая кислота (АЛК), Актовегин), препараты тиамина, уменьшающие выраженность метаболических нарушений в нерве (бенфотиамин). Существует также большое количество препаратов, воздействующих на различные механизмы нарушений метаболизма и кровоток в системе микроциркуляции: ингибиторы альдозоредуктазы, гамма-линоленовая кислота, аналоги простациклина, фактор роста нервов, ацетил-L-карнитин, Трайкор и многие другие, которые в настоящее время используются при ДПН редко, поскольку требуется проведение дополнительных РКИ [15].
В большинстве обзоров, посвященных патогенетическому лечению ДПН, рассматриваются препараты, которые применялись в РКИ, в то же время практически не обсуждается их персонифицированное использование [16–19]. Лишь в небольшом количестве исследований оценивается влияние некоторых лекарственных средств на конкретную симптоматику [20]. Однако неправомерно назначать один и тот же препарат пациентам от 20 до 60 лет с СД 1 и 2 типов и пациентам старше 60 лет с СД 2 типа, руководствуясь только уровнем доказательности эффективности терапии, поскольку не учитываются другие процессы, происходящие в нервной системе. Речь, в частности, идет о метаболической энцефалопатии (при СД 1 и 2 типов) и смешанной (сосудисто-метаболической) (пожилые лица преимущественно с СД 2 типа) [21].
На сегодняшний день самым изученным препаратом является АЛК – мощный липофильный антиоксидант.
Высокая эффективность трехнедельных капельных инфузий 600 мг АЛК у больных ДПН-2 доказана в отдельных РКИ [22] и подтверждена результатами метаанализа четырех РКИ [23]. В нескольких РКИ продемонстрирована достоверная эффективность ежедневного перорального приема (утром натощак) 600 мг АЛК в течение месяца [24]. Достоверная эффективность АЛК при ДПН зафиксирована в девяти РКИ. Это единственный препарат, который имеет столь масштабную доказательную базу и уровень доказательности А в лечении ДПН [11].
В экспериментальных исследованиях показано, что бенфотиамин (жирорастворимый тиамин) снижает содержание промежуточных продуктов обмена глюкозы, определяющих метаболические клеточные нарушения. Основанием для лечения бенфотиамином служит снижение содержания тиамина в плазме крови больных СД 1 и 2 типов [25]. Тиамин способствует активации транскетолазы, которая уменьшает метаболические нарушения в клетках [26].
Эффективность бенфотиамина в дозах 300 и 600 мг при ДПН доказана в шести РКИ, однако только в исследовании BENDIP приняло участие достаточно большое количество пациентов с ДПН [27]. Поэтому некоторые ученые считают, что для подтверждения эффективности должны быть проведены дополнительные исследования [28]. В исследовании с участием больных СД 1 типа, получавших бенфотиамин 24 месяца в дозе 300 мг в сутки, не отмечено достоверного изменения состояния периферических нервов при проведении ЭМГ и маркеров воспаления [29]. Указанная работа позднее была подвергнута серьезной критике из-за неадекватного подбора больных и дизайна исследования [30].
Препарат Актовегин (компания «Такеда», Япония) представляет собой высокоочищенный гемодиализат, получаемый методом двойной ультрафильтрации из крови телят. В состав препарата входят более 200 низкомолекулярных соединений (менее 5000 Да), что исключает развитие прионных заболеваний, например болезни Крейцфельда – Якоба, при инфузиях.
Актовегин содержит неорганические (электролиты – натрий, калий, кальций, магний, хлориды, соединения азота) и органические (ацетат, лактат, аминокислоты, нуклеозиды, гликосфинголипиды, инозитолфосфоолигосахариды, промежуточные продукты углеводного и жирового обмена, антиоксидантные ферменты) вещества.
Препарат оказывает инсулиноподобный эффект, не взаимодействуя с рецепторами к инсулину, что важно для больных СД 2 типа с инсулинорезистентностью. Актовегин увеличивает поглощение тканями кислорода, что повышает устойчивость клеток к гипоксии. Он также нормализует эндотелийзависимые реакции (доказательство – увеличение кислородного метаболизма сосудистой стенки). Как следствие, улучшается кровоток [31]. Показано, что у пациентов с сердечно-сосудистой недостаточностью Актовегин снижает образование активных форм кислорода, данный эффект носит дозозависимый характер [32]. Актовегин уменьшает апоптоз (активность каспазы 3), увеличивает число синаптических связей и дозозависимо уменьшает окислительный стресс в нейронах [33]. Препарат улучшает проведение возбуждения по чувствительным волокнам и уменьшает апоптоз в волокнах седалищного нерва за счет уменьшения активности PARP (сигнальных полимераз). Сказанное выше подтверждает влияние Актовегина на механизмы клеточного поражения при СД [34].
Действие Актовегина у больных ДПН изучено в РКИ. Одна группа (n = 35) получала плацебо, вторая (n = 35) – Актовегин перорально (по 600 мг три раза в день) в течение 24 недель [35]. Улучшение состояния в группе Актовегина отмечено у большинства пациентов уже через восемь недель лечения, оптимальный эффект – через 16. На фоне приема Актовегина зафиксировано достоверное улучшение клинических показателей и увеличение СРВ по сравнению с приемом плацебо.
В двух открытых исследованиях эффективности инфузий (от 15 до 20) Актовегина у больных СД 1 и 2 типов и ЭМГ-подтвержденной ДПН-2а и -2b наблюдалось снижение количества жалоб больных и выраженности неврологического дефицита, увеличение амплитуды сенсорного ответа и СРВ [36, 37].
В 2009 г. опубликованы результаты рандомизированного двойного слепого плацебоконтролируемого исследования эффективности и безопасности Актовегина у пациентов с СД 2 типа и ДПН-2а и -2b, проводившегося в 26 клинических центрах. В исследование было включено 567 больных. 281 пациенту сделали 20 внутривенных инфузий Актовегина (250 мл 20%-ного раствора), после чего их перевели на пероральный прием препарата в дозе 600 мг три раза в сутки в течение 140 дней. Другие 286 больных сначала получали внутривенную плацебо-терапию, затем пероральную.
Эффективность лечения оценивалась по TSS и порогу вибрационной чувствительности, который определялся биотензиометром.
Вторичные критерии эффективности – динамика показателей неврологического дефицита (NIS-LL) и качества жизни (Шкала психического здоровья).
Наилучшие результаты получены в снижении степени неприятных ощущений в ногах. При этом достоверное улучшение отмечалось как по общей сумме баллов TSS, так и по каждому отдельно оцениваемому симптому (табл. 1). В группе Актовегина по сравнению с группой плацебо выявлено достоверное уменьшение сенсорного неврологического дефицита и порога вибрационной чувствительности.
В течение всего периода наблюдения также определяли уровни глюкозы в крови натощак и гликированного гемоглобина (HbA1c). Результаты свидетельствуют о том, что эффективность Актовегина связана с действием препарата, а не с изменением контроля СД.
В группе Актовегина по сравнению с группой плацебо наблюдалось значимое улучшение качества жизни.
Оба вида терапии имели сопоставимый профиль безопасности [38].
Проведенные исследования позволяют сделать следующий вывод: Актовегин может быть использован в лечении ДПН-2, поскольку именно такие больные включались во все открытые исследования и РКИ.
В неврологической, терапевтической и хирургической практике Актовегин применяют при состояниях, сопровождающихся ишемией и гипоксией, а следовательно, окислительным стрессом.
Крайне важна для пожилых пациентов с СД 2 типа и ДПН способность Актовегина улучшать когнитивные функции. Когнитивные нарушения снижают способность больных адекватно контролировать гипергликемию. В частности, пациенты забывают вовремя сделать инъекцию инсулина или принять сахароснижающий препарат, не могут рассчитать дозу инсулина, утрачивают контроль питания. Как следствие, увеличивается риск развития типичных осложнений СД, приводящих к инвалидизации и смерти. Установлено, что когнитивная дисфункция у пожилых больных СД ассоциируется с увеличением риска смерти за два года на 20%.
При обследовании лиц пожилого и старческого возраста с СД 2 типа выявлено, что только 36% из них не имеют когнитивных и/или эмоциональных нарушений [39].
Результаты эпидемиологических исследований свидетельствуют о связи диабета и деменции. Так, у пациентов пожилого возраста с СД чаще встречались болезнь Альцгеймера и сосудистая деменция. Наблюдение за этими больными в течение двух лет показало, что новые случаи деменции, как правило, развиваются у страдающих СД 2 типа.
Результаты большинства исследований когнитивных функций подтвердили, что СД 1 и 2 типов приводит к легким или умеренным когнитивным нарушениям с ограниченным влиянием на повседневную активность. Деменция у таких пациентов отмечается редко.
Анализ результатов экспериментальных и клинических исследований позволяет сделать вывод в отношении основных механизмов развития диабетической энцефалопатии. Таковыми признаны гипергликемия, приводящая к метаболическим нарушениям в нейронах головного мозга, связанным с окислительным стрессом; недостаток инсулина и инсулинорезистентность в мозговой ткани; поражение сосудов микроциркуляторного русла и нарушение текучести крови, также обусловливающие развитие патологии мозговой ткани.
Высказано предположение, что структурно-функциональные изменения головного мозга при СД аналогичны изменениям, происходящим при естественном старении, а значит, диабетическую энцефалопатию следует рассматривать как ускоренное старение мозга.
В настоящее время Актовегин широко используется для лечения сосудистых заболеваний головного мозга и когнитивных нарушений различной степени тяжести.
Достоверная его эффективность как при пероральном, так и парентеральном применении для коррекции когнитивных нарушений у больных, не страдающих СД, продемонстрирована в нескольких РКИ [40, 41].
В открытом исследовании с участием 60 пациентов с СД 2 типа и когнитивными нарушениями различной степени тяжести внутривенное введение 400 мг Актовегина в течение трех недель привело к улучшению суммы баллов по Шкале оценки психического состояния (Mini-Mental Scale Examination – MMSE), причем в наибольшей степени в отношении памяти [42].
Представляет интерес работа В.В. Захарова и В.Б. Сосиной, которые назначали Актовегин для лечения умеренных когнитивных расстройств 60 больным СД 2 типа. Актовегин принимали перорально в дозе 1200 мг в сутки в течение трех месяцев. Нейропсихологическое обследование всех участников с помощью набора тестов проводилось дважды, при этом использовалась качественная и количественная оценка результатов. Терапия Актовегином способствовала улучшению когнитивных функций – преимущественно внимания и регуляции произвольной деятельности. Кроме того, она хорошо переносилась [43].
Все РКИ по изучению эффективности и безопасности различных лекарственных препаратов при ДПН проведены на когортах пациентов с ДПН-2а и -2b, поскольку у них можно проанализировать динамику симптомов (TSS и NIS-LL). Однако у большей части больных СД 1 и 2 типов отмечается ДПН-1. Из-за отсутствия у таких пациентов типичных жалоб и неврологического дефицита оценить эффективность терапии не представляется возможным. Поэтому данные об изменении состояния периферической нервной системы на фоне лечения препаратами разных фармакологических групп также отсутствуют.
Нами проведено исследование эффективности Актовегина при ДПН-1. В него было включено 40 больных СД 2 типа в возрасте 55,5 ± 6,3 года. Средняя длительность СД составила 3,5 ± 2,3 года, уровень HbA1c – 7,1 ± 0,8%.
У всех участников исследования диагностирована субклиническая ДПН, подтвержденная ЭМГ. Поэтому для оценки состояния использовали ЭМГ, панч-биопсию кожи стоп для иммуногистохимического анализа плотности нервных волокон (маркер PGP 9,5) в эпидермисе и дерме, а также для анализа содержания эндотелия в дерме (маркер CD 34). Контролем служили биоптаты мышц, взятые у десяти здоровых добровольцев того же возраста.
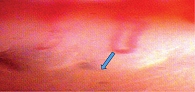
Для оценки микроциркуляции сосудов проводилась компьютерная капилляроскопия с помощью цифрового капилляроскопа «Капилляроскан-1» (компания «Новые энергетические технологии», Россия). Капилляроскоп позволял получать изображение капилляров ногтевого ложа с 125- и 450-кратным увеличением в эпонихии четвертого или третьего пальца левой руки при температуре кожи не менее 30 оС.
Данные обрабатывались с помощью программного обеспечения, позволяющего просматривать записанные изображения, измерять диаметр капилляров во всех отделах (артериальном, переходном, венозном), периваскулярную зону (рис. 1).
Оценка эндотелиальной функции до и после теста «ишемия – реперфузия» проводилась на аппарате «Тонокард» (Россия) с использованием высокочувствительных датчиков, которые располагались в проекции плечевой артерии и артерии запястья. Замер амплитуды пульсовых волн артерий запястья проводился автоматически. Затем в манжету, находившуюся на плече, подавали воздух под давлением, превышающим систолическое артериальное давление на 30–40 мм рт. ст., с целью пережать плечевую артерию. По окончании трехминутной фазы ишемии проводился повторный замер амплитуд пульсовых волн на артериях запястья в течение 60 секунд (фаза реперфузии). Эндотелиальная функция определяется как отношение амплитуд пульсовых волн до и после пережатия, выраженное
в процентах.
Оценка показателей проводилась исходно и через пять месяцев.
Участники исследования были рандомизированы на две сопоставимые по антропометрическим показателям группы. В группе Актовегина (n = 20) средний возраст пациентов составил 57,6 ± 6,8 года, индекс массы тела – 33,6 кг/м2, длительность СД – 2,3 ± 2,3 года, HbA1c – 6,5 ± 0,5%. Лечение проводилось по следующей схеме: десять инфузий препарата 250 мл 20%-ного раствора, затем прием таблеток в дозе 200 мг три раза в день. Длительность лечения – пять месяцев.
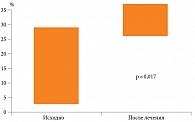
По окончании терапии Актовегином улучшились ЭМГ-показатели и увеличилась плотность нервных волокон, а также содержание эндотелиальных структур [3, 44].
При проведении капилляроскопии отмечено улучшение состояния сосудов микроциркуляторного русла и эндотелиальной функции (рис. 2).
Реализация персонифицированного подхода к патогенетической терапии
АЛК является препаратом выбора при лечении молодых пациентов с ДПН-2а и -2b в отсутствие пролиферативной ретинопатии. У больных с пролиферацией сосудов сетчатки АЛК может вызвать геморрагии. В такой ситуации предпочтение следует отдавать Актовегину.
Не рекомендуется назначать АЛК больным старше 75 лет, а также при нарушениях сердечного ритма. Таким больным показан Актовегин.
Еще одной причиной выбора Актовегина для лечения ДПН-2 у лиц пожилого и старческого возраста может стать наличие или риск развития когнитивных нарушений.
Бенфотиамин более подходит для адъювантного лечения. Он может использоваться при ДПН в комбинации с одним из антиоксидантов, так как реализует свой эффект через уменьшение метаболических нарушений в волокнах периферических нервов (табл. 2).
Заключение
Вопрос о терапии ДПН-1 остается открытым и чрезвычайно важным. Полученные нами данные свидетельствуют, что Актовегин воздействует на основные механизмы формирования субклинической ДПН, потенциально способен улучшить состояние периферических нервов и предотвратить прогрессирование заболевания. Именно такая задача должна ставиться при проведении РКИ в когорте таких пациентов.
На данный момент проведено только одно исследование способности фармпрепарата замедлять прогрессирование поздних осложнений СД, – FIELD. В масштабное РКИ включено 9795 больных СД 2 типа. Исследователи оценивали влияние длительной (в течение пяти лет) терапии фенофибратом (препаратом Трайкор) на риск развития поздних осложнений СД [45]. Установлено, что применение фенофибрата высоко достоверно препятствует прогрессированию ретинопатии и уменьшает вероятность проведения лазерной коагуляции сетчатки, частоту ампутации конечности. Исследование FIELD является прекрасной моделью для будущих исследований, посвященных лечению субклинической ДПН.
A.S. Fokina, I.A. Strokov, A.V. Zilov, K.I. Strokov
I.M. Sechenov First Moscow State Medical University
Scientific Clinical Center of Russian Railways, JSC
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
In the article the issues of prevalence, diagnosis, stages, pathogenesis and treatment of distal symmetric sensory-motor diabetic polyneuropathy are on discussion. On the basis of literature data and own researches the algorithm is offered for personalized treatment based on the stage of disease and presence of other diabetes complications (diabetic retinopathy and encephalopathy).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.